大黄素增强顺铂对膀胱癌T24细胞移植瘤抑制作用的实验研究
马 勇,张桂铭,孙立江
(青岛大学附属医院泌尿外科,山东青岛 266021)
·基础研究·
大黄素增强顺铂对膀胱癌T24细胞移植瘤抑制作用的实验研究
马 勇,张桂铭,孙立江
(青岛大学附属医院泌尿外科,山东青岛 266021)
目的 探讨大黄素增强顺铂对膀胱癌T24细胞裸鼠皮下移植瘤的化疗作用及其机制。方法 建立膀胱癌T24细胞的裸鼠皮下移植瘤动物模型,将荷瘤鼠随机分为:Con组(生理盐水)、Cis组(顺铂50 mg/kg)、Emo组(大黄素40 mg/kg)和Cis+Emo组(联合用药,顺铂50 mg/kg+大黄素40 mg/kg)。腹腔注射给药,每3 d 1次,共8次。给药后测量肿瘤体积及质量。采用原位末端转移酶标记技术(Tunel)检测各组标本肿瘤细胞凋亡情况。免疫组织化学法检测肿瘤组织核转录因子(NF-κB)、凋亡抑制因子(XIAP)和胱天蛋白酶(Caspase-3)蛋白的表达。RT-PCR检测NF-κB、XIAP和Caspase-3 mRNA的表达。结果 Cis+Emo组肿瘤体积和质量明显小于其他各组。Tunel实验显示,Cis+Emo组细胞凋亡水平明显高于其他各组。免疫组化和RT-PCR结果显示:与Con组相比较, Emo组和Cis+Emo组的NF-κB、XIAP蛋白、mRNA的表达显著下降;与Cis组和Emo组相比较,Cis+Emo组的NF-κB、XIAP蛋白、mRNA的表达显著下降;与其他各组相比,Cis+Emo组的Caspase-3蛋白和mRNA的表达显著增强。结论 大黄素可以通过下调NF-κB和XIAP、上调Caspase-3基因和蛋白的表达,增强顺铂对膀胱癌T24细胞移植瘤诱导凋亡作用。
大黄素;顺铂;膀胱癌;化疗耐药;NF-κB;XIAP;Caspase-3;细胞凋亡
膀胱癌是一种常见的泌尿生殖系统肿瘤。全国肿瘤登记地区,膀胱癌发病率7.49/104,占中国恶性肿瘤发病的2.5%[1]。移行细胞癌是膀胱癌的主要病理类型,其复发率、转移率高,对肿瘤的一级、二级预防有效等特点,决定了其是化学预防干预的理想模型[2]。长期以来,顺铂被认为是治疗移行细胞癌的一种重要化疗药物,但顺铂单药化疗的总体反应率高达35%左右[3]。因此寻找一种新的药物来增强膀胱癌的化疗效果显得尤其重要。
大黄素是大黄的一种重要有效单体,细胞实验及动物实验均表明,大黄素对多种肿瘤细胞的生长均有抑制作用[4-6],但大黄素是否可以增强顺铂对膀胱癌的化疗作用目前尚鲜见报道。本研究通过建立裸鼠膀胱癌移植瘤模型,并联合大黄素和顺铂共同作用,探讨大黄素是否可以提高增强顺铂对膀胱移行细胞癌裸鼠移植瘤的生长抑制作用。
1 材料与方法
1.1 药物和试剂大黄素(emodin,纯度>98%,购于美国Sigma公司)溶解于DMSO浓度<0.1%(体积分数)的生理盐水中。顺铂(Cisplatin,Cis),购于齐鲁制药有限公司。Trizol试剂购于Invitrogen公司,cDNA第一链合成试剂盒购于Fermentas。兔抗人肿瘤组织核转录因子(NF-κB)抗体、凋亡抑制因子(X-linked inhibitor of apoptosis protein,XIAP)抗体和胱天蛋白酶(Caspase-3)抗体购于abcam公司。
1.2 细胞系和细胞培养人膀胱癌细胞株T24购自美国模式培养物集存库(American Type Culture Collection,ATCC)。细胞培养于37℃含5%CO2(体积分数)的培养箱中。使用添加有10%胎牛血清(体积分数)并100 U/mL青霉素和100 U/mL链霉素的RPMI1640培养基进行细胞培养,待贴壁生长至70%~80%时使用胰蛋白酶消化传代。
1.3 动物4~6周龄BALB/c nu/nu雄性裸小鼠32只,体重20~22 g,购于中科院上海实验动物中心。饲养于SPF级屏障系统的洁净层流架内,控制室温在(25±1) ℃,相对湿度40%~60%,使用灭菌处理过的饲料。
1.4 模型建造和实验方案收集对数生长期的T24细胞悬液,将其细胞悬液注射于裸鼠背部靠近后肢部位的皮下,每只注射0.2 mL约5×106个细胞。
2周后,将裸鼠按肿瘤体积大小排序并随机分成4组,每组8只:Con组(生理盐水)、Cis组(顺铂50 mg/kg)、Emo(Emodin)组(大黄素40 mg/kg)[7]和Cis+Emo组(联合用药,顺铂50 mg/kg和大黄素40 mg/kg)。腹腔注射给药,每3 d 1次,共8次。每次用药前及处死裸鼠前均称量裸鼠体重并测量肿瘤短径(a)和长径(b)。肿瘤体积计算公式按照v=π/6×a2×b。末次用药1周后用10%水合氯醛麻醉裸鼠取部分肿瘤组织置于4%多聚甲醛固定,留取部分新鲜组织保存于液氮备用。
1.4.1 TUNEL法检测细胞凋亡 按照原位末端转移酶标记技术(transferase-mediated nick end labeling,TUNEL)l试剂盒说明书的步骤进行操作,加tunel反应液37℃孵育1 h后封片,用激光共聚焦显微镜400倍下进行拍照,每张切片均寻找10个典型视野。以不含标本的空白玻片做为对照。
1.4.2 免疫组化 免疫组织化学染色法检测肿瘤组织核转录因子(NF-κB)、XIAP(X染色体相关凋亡抑制蛋白)XIAP和Caspase-3对各组标本的同一横截面进行连续切片,所得石蜡切片进行常规二甲苯脱蜡,梯度乙醇水化,0.3%H2O2封闭,微波抗原修复,10%山羊血清封闭,兔抗人Ⅰ抗4℃孵育过夜,PBS洗涤后滴加HRP标记的二抗37℃孵育半小时,DAB显色3~5 min,冲洗后苏木素复染,流水冲洗返蓝后梯度乙醇脱水封片镜检。
1.4.3 RNA提取及RT-PCR 按照说明书所描述的步骤,用Trizol试剂提取总RNA,用紫外分光光度计对所提取的RNA测浓度。使用1 μg总RNA进行逆转录合成第一链cDNA,将所得模板取1 μL行PCR扩增,取5 μL扩增产物置于0.5%琼脂糖凝胶电泳并成像。所用的引物序列如表1。表中GAPDH为甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase)。
表1 RT-PCR所用的引物序列

基因引物序列产物大小NF-κB300bp 上游5'-CCTGCACTCAATCAAGAAGTTGC-3' 下游5'-TTCCTGCTCTGTTTGGTGAGGCT-3'XIAP259bp 上游5'-GCAGAATCATCACGAAGTGG-3' 下游5'-GCAACGCGAGTCTGTGTTTTTG-3'Capase-3309bp 上游5'-AGCAAACCTCAGGGAAACATT-3' 下游5'-GTCTCAATGCCACAGTCCAGT-3'GAPDH216bp 上游5'-AACGGATTTGGTCGTATTGGG-3' 下游5'-TCGCTCCTGGAAGATGGTGAT-3'
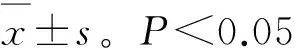
2 结 果
2.1 末次用药后1周各组肿瘤体积和肿瘤质量的变化末次用药后 1周,各组肿瘤质量和体积如表2所示。与对照组相比,Emo组与Cis组的瘤体平均体积均明显小于对照组 (P<0.05),但Cis+Emo组抑制肿瘤的作用更为明显,与其他各组相比,差异均有统计学意义(P<0.05)。

图1 大黄素增强顺铂对T24细胞移植瘤的抑瘤作用
2.2 大黄素增强顺铂诱导肿瘤细胞的凋亡作用 Tunel阳性细胞细胞核发出黄绿色荧光,通过对比各组中黄绿色荧光的累积吸光度值,可以发现,与其他3组相比,Cis+Emo组累积吸光度显著升高,差异有统计学意义(图2、表2)。
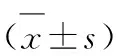
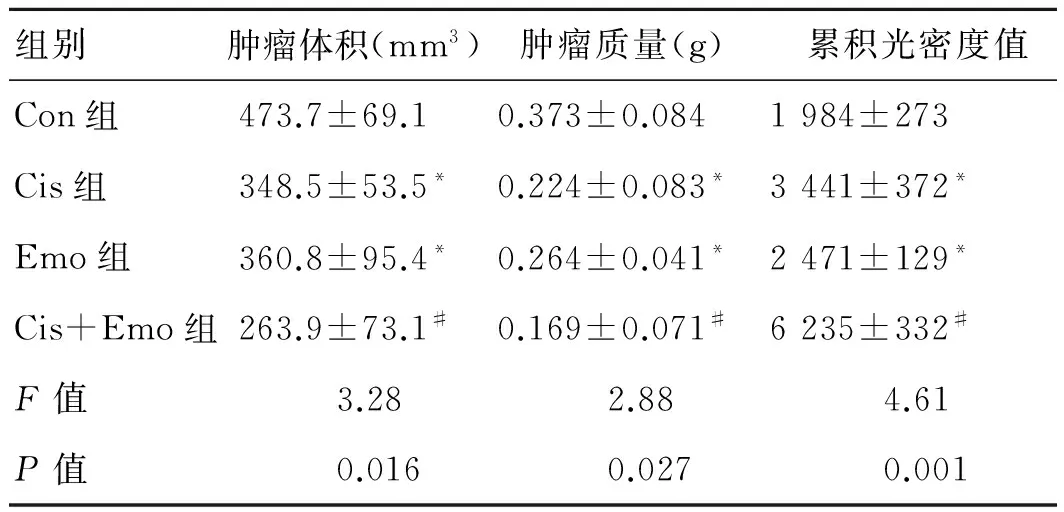
组别肿瘤体积(mm3)肿瘤质量(g) 累积光密度值Con组473.7±69.10.373±0.0841984±273Cis组348.5±53.5*0.224±0.083*3441±372*Emo组360.8±95.4*0.264±0.041*2471±129*Cis+Emo组263.9±73.1#0.169±0.071#6235±332#F值3.282.884.61P值0.0160.0270.001
*与Con组相比,P<0.05;#与其他3组相比,P<0.05。
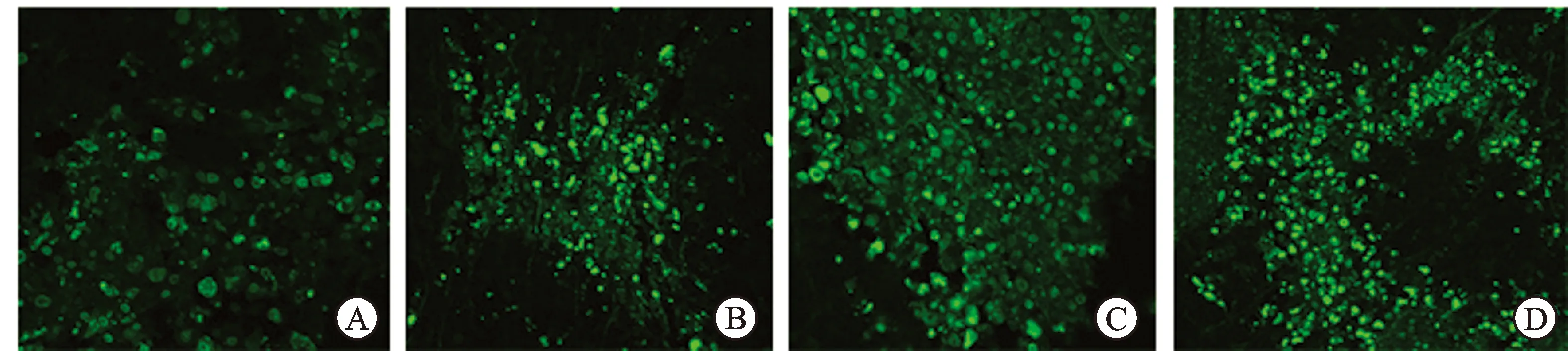
图2 Tunel法检测细胞凋亡(阳性细胞发出黄绿色荧光)。
2.3 免疫组化法检测NF-κB、XIAP、Caspase-3蛋白在各组肿瘤组织中的表达应用IPP软件对免疫组化图片进行分析,各组肿瘤组织中NF-κB和P-g p蛋白的表达量以平均光密度值的形式表示,各组平均光密度值见图3、表3。
2.4 逆转录PCR法检测NF-κB、XIAP和Caspase-3 mRNA在各组肿瘤中的表达量大黄素可以显著下调NF-κB和XIAP mRNA的表达量,增强Caspase-3 mRNA的表达量(图4、表4)。
表3 免疫组化法检测NF-κB、XIAP、Caspase-3蛋白在各组肿瘤组织中的表达
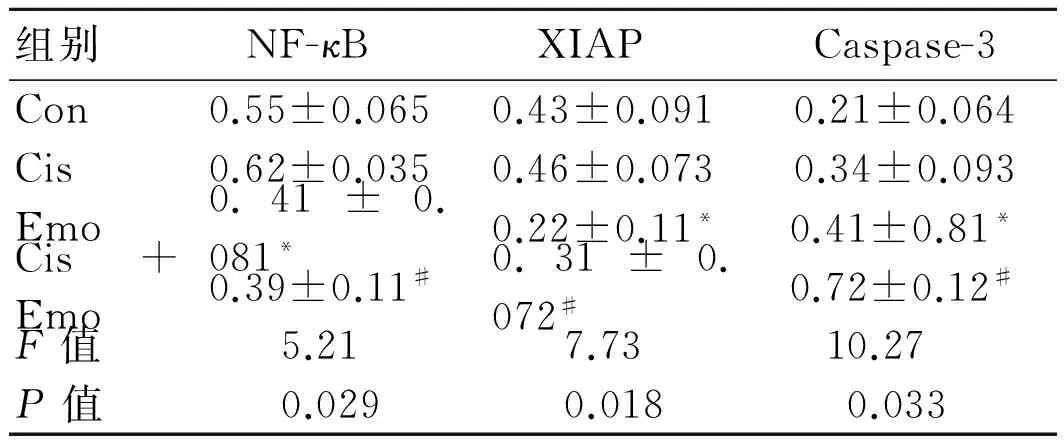
组别NF-κB XIAP Caspase-3Con0.55±0.0650.43±0.0910.21±0.064Cis0.62±0.0350.46±0.0730.34±0.093Emo0.41±0.081*0.22±0.11*0.41±0.81*Cis+Emo0.39±0.11#0.31±0.072#0.72±0.12#F值5.217.7310.27P值0.0290.0180.033
*与Con组相比,P<0.05;#与其他3组相比,P<0.05。
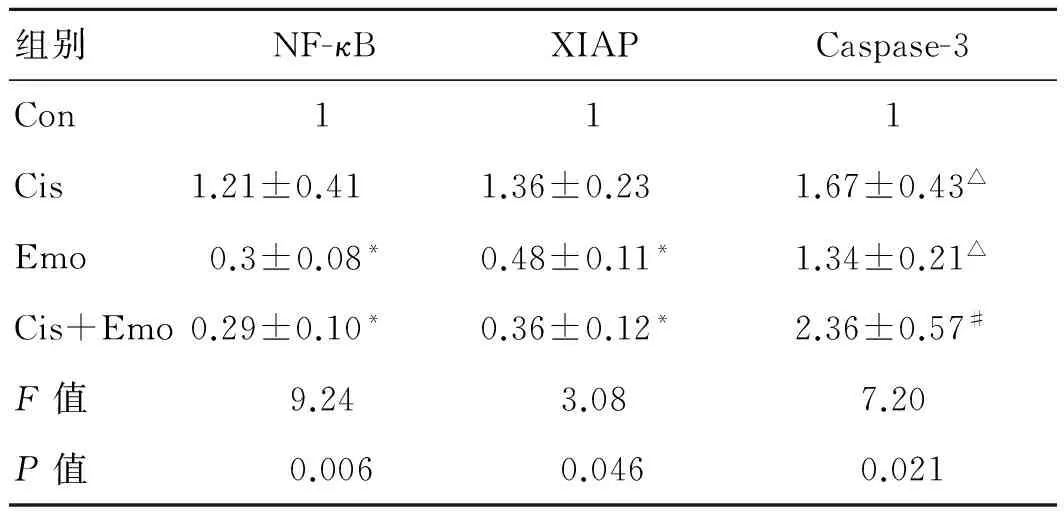
组别NF-κBXIAPCaspase-3Con111Cis1.21±0.411.36±0.231.67±0.43△Emo 0.3±0.08*0.48±0.11*1.34±0.21△Cis+Emo0.29±0.10*0.36±0.12*2.36±0.57#F值9.243.087.20P值0.0060.0460.021
与Con组和Cis组相比,*P<0.05;与其他3组相比,#P<0.05;与Con组相比,△P<0.05。
3 讨 论
目前非肌层浸润性膀胱癌的主要治疗方法是经尿道电切术;术后需要长时间的膀胱灌注化疗来预防肿瘤的复发,然而由于内源性或获得性的耐药,单药化疗往往难以阻止肿瘤的复发。对于非肌层浸润性膀胱癌,多药联合化疗的方案优于单药灌注疗法,但其复发率仍然居高不下[8]。因此寻找一种新的药物来增强膀胱癌的化疗效果显的尤其重要。
大黄素(Emodin,6-甲基-1,3,8-三羟基蒽醌),是从大黄属、蓼属、鼠李属和番泻叶中分离出来的主要有效单体。大黄素可作用于癌细胞中癌基因的信号转导通路,其促凋亡作用对癌细胞有效,正常细胞则不敏感[9]。大黄素可以抑制胰腺癌、卵巢癌、肺癌和白血病等多种肿瘤细胞的生长[4-6,10]。在胰腺癌裸鼠移植瘤实验中,大黄素可以通过促进细胞凋亡来增强吉西他滨的化疗作用[11]。其机制均为作用于肿瘤细胞的信号转导通路,在基因和蛋白水平上影响细胞的信号转导来实现的。
凋亡是细胞内在的死亡程序,它参与细胞的许多病理生理进程,在生物细胞中具有高度的保守性[12]。参与细胞凋亡的信号转导通路有两条,一是内源性的死亡受体通路,一是外源性的线粒体通路。胱天蛋白酶家族-Caspase蛋白参与这两条通路当中,在细胞凋亡中发挥重要作用[12]。人体肿瘤细胞的一个重要特点就是对那些可以在敏感细胞中诱导凋亡的因素产生耐受,使得肿瘤细胞免于凋亡,进入无限增殖的程序[13]。NF-κB是一种普遍存在的核转录因子,与机体免疫、炎症、细胞生长、增殖和分化等有关。越来越多的证据表明,NF-κB在肿瘤细胞恶性转化和增殖过程中发挥重要作用[14],XIAP(X染色体相关凋亡抑制蛋白)是一种凋亡抑制因子,它可以通过抑制Caspase家族蛋白的活性来发挥抗凋亡作用,事实表明,XIAP的过量表达是肿瘤细胞化疗效果不好的重要原因之一[6]。本实验结果显示:大黄素和顺铂联合组肿瘤细胞凋亡程度明显高于顺铂单药组,从而增强顺铂对膀胱癌T24细胞移植瘤的生长抑制作用。大黄素的促凋亡作用是通过下调NF-κB及XIAP的表达量,上调Caspase-3的表达来实现的。
总之,大黄素联合顺铂可以增强膀胱癌T24细胞移植瘤诱导凋亡作用。本实验表明其机制可能是通过抑制核转录因子NF-κB的表达,下调XIAP基因的表达,并使膀胱癌细胞中Caspase-3蛋白表达增强,最终促进肿瘤细胞凋亡,从而增强了化疗效果。本研究将为大黄素联合顺铂治疗膀胱癌的临床应用提供实验依据,为膀胱癌的临床治疗开辟新的途径。
[1] 韩苏军, 张思维, 陈万青, 等.中国膀胱癌发病现状与流行趋势分析[J]. 癌症进展, 2013,1 (11): 89-95.
[2] BUSBY JE, KAMAT AM. Chemoprevention for bladder cancer[J]. J Urol, 2006,176:1914-1920.
[3] ROBERTS JT.Chemotherapy for metastatic bladder cancer[J]. Clin Oncol (R Coll Radiol),2005,17:514-523.
[4] GUO HC, BU HQ, LUO J,et al.Emodin potentiates the antitumor effects of gemcitabine in PANC-1 pancreatic cancer xenograft model in vivo via inhibition of inhibitors of apoptosis[J]. Int J Oncol, 2012, 40:1849-1857.
[5] LI J, LIU P, MAO H, et al, ZHANG H.Emodin sensitizes paclitaxel-resistant human ovarian cancer cells to paclitaxel-induced apoptosis in vitro[J]. Oncol Rep, 2009,21: 1605-1610.
[6] SHIOZAKI EN, SH YI.Caspases, IAPs and Smac/DIABLO: mechanisms from structural biology[J]. Trends Biochem Sci, 2004, 29: 486-494.
[7] CHA TL,QIU L, CHEN CT, WEN Y, HUNG MC. Emodin down-regulates androgen receptor and inhibits prostate cancer cell growth[J]. Cancer Res,2005, 65:2287-2295.
[8] SCHULZE M, STOTZ N, RASSWEILER J.Retrospective analysis of transurethral resection, second-look resection, and long-term chemo-metaphylaxis for superficial bladder cancer: indications and efficacy of a differentiated approach[J]. J Endourol, 2007,21:1533-1541.
[9] HUANG Q, LU G, SHEN HM, et al. Anti-cancer properties of anthraquinones from rhubarb[J] . Med Res Rev, 2007, 27:609-630.
[10] KO JC, SU YJ,et al.Suppression of ERCC1 and Rad51 expression through ERK1/2 inactivation is essential in emodin-mediated cytotoxicity in human non-small cell lung cancer cells[J]. Biochem Pharmacol, 2010, 79: 655-664.
[11] CHEN H, WEI W, GUO Y, et al. Enhanced effect of gemcitabine by emodin against pancreatic cancer in vivo via cytochrome C-regulated apoptosis[J]. Oncol Rep, 2011,25:1253-1261.
[12] HENGARTNER MO.The biochemistry of apoptosis[J]. Nature, 2000,407:770-776.
[13] FULDA S.Tumor resistance to apoptosis[J]. Int J Cancer, 2009, (124) 511-515.
[14] NEUMANN M,NAUMANN M.Beyond IkappaBs: alternative regulation of NF-kappaB activity[J]. FASEB J, 2007, 21: 2642-2654.
(编辑 何宏灵)
Emodin enhances the antitumor effect of cisplatin on bladder cancer T24 cell xenografts
MA Yong,ZHANG Gui-ming,SUN Li-jiang
(Department of Urology,the Affiliated Hospital of Qingdao University,Qingdao 266021,China)
Objective To investigate the enhancement effect of cisplatin on the chemoresistance of T24 cell xenograft. Methods The models of T24 cell xenograft on athymic mice were established and randomized into four groups with intraperitoneal (IP) injection of different drugs: group Con (0.9% sodium chloride), group Cis (cisplatin, 50 mg/kg), group Emo (emodin, 40 mg/kg) and group Cis+Emo (cisplatin,50 mg/kg; emodin, 40 mg/kg). The drugs were injected once per three days, eight times in all. The tumor volume was measured during the drug therapy. The mice were sacrificed one week after the last injection. Immunohistochemistry (IHC) was performed to detect the expression of NF-κB, XIAP and Caspase-3 proteins. RT-PCR was used to detect the expression of NF-κB, XIAP and Caspase-3 mRNA. Results One week after the last administration, the mean tumor volume and tumor weight in group Cis+Emo were significantly decreased as compared to the other groups. RT-PCR analysis showed the expression of NF-κB and XIAP mRNA in Emo and Cis+Emo groups were significantly downregulated. IHC analysis showed the expression of NF-κB and XIAP were downregulated in Emo and Cis+Emo groups compared to the other two groups. Conclusions Emodin can enhance the antitumor effect of cisplatin on bladder cancer T24 cell xenograft. Apoptosis promotion is possibly one of the mechanisms.
eemodin; cisplatin; chemoresistance;bladder cancer; NF-κB; XIAP; Caspase-3;apoptosis
2014-10-29
2015-01-26
孙立江,教授,主任医师,博士研究生导师.E-mail:slijiang999@sohu.com
马勇(1978-),男(汉族),博士研究生.研究方向:泌尿系统肿瘤.E-mail:coralmy@163.com
R737.14
A
10.3969/j.issn.1009-8291.2015-04-015

