两段反应串联的二氯乙烷、氯化氢氧氯化制三、四氯乙烯
花海,崔咪芬,费兆阳,陈献,汤吉海,乔旭
(1南京工业大学材料化学工程国家重点实验室, 江苏 南京210009;2南京工业大学化学化工学院,江苏 南京 210009)
引言
三氯乙烯(TCE)、四氯乙烯(PCE)是重要的有机氯溶剂,主要用作溶剂、金属脱脂剂、金属清洗剂、有机萃取剂、干洗剂等。同时二者还是新型制冷剂的合成原料,随着氟里昂的全面禁用,三、四氯乙烯的需求势必增加[1]。另外,随着我国氯碱工业规模的逐渐扩大,每年生产超过500万吨的副产氯化氢。由于氯化氢腐蚀性大、运输成本高,往往被制成廉价的盐酸出售。这既增加了原厂的生产成本和环境成本,也是氯资源的巨大浪费。开发以氯化氢为氯元素来源的三、四氯乙烯生产工艺意义重大。相较于乙炔法、直接氯化法[2]、催化裂解法[3]、热氯化法[4-6]等传统三、四氯乙烯生产工艺,氧氯化法有着工艺流程短、成本低、原料多样化的优点。
美国富美实公司[7-8]和匹兹堡玻璃公司[9-10]都开发过各自的氧氯化法联产三、四氯乙烯的工艺。前者在 400℃的反应温度下,运用固定床或流化床反应器氧氯化二氯乙烷(EDC)或乙烯制备三、四氯乙烯。由于反应强放热,需用大量氮气作为稀释剂,生产成本高、物料损失大。后者虽无稀释,但为提高产品收率,采用两段式氧氯化反应生产三、四氯乙烯,由于有机原料和大部分氧气均由第1段反应器通入,接触后发生深度氧化,使有机氯的收率下降、原料浪费。经历两段氧氯化反应后,约15%的有机物被氧气氧化成了COx,最终三、四氯乙烯收率约为73%。
本文通过对二氯乙烷、氯化氢氧氯化复杂反应体系的剖析,拟采用第1段氯化氢氧化制氯气和第2段二氯乙烷与生成的氯气及未反应完的氧气发生反应制三、四氯乙烯的两段反应串联工艺。针对第1段氯化氢氧化制氯气的Deacon反应,本实验室已进行了催化剂、工艺及动力学的系统研究[11-15],研发出了性能较优异的氯化氢氧化催化剂;第2段中二氯乙烷与生成的氯气及未反应完的低浓度氧气反应,能够有效避免有机物料的深度氧化,提高目的产物的收率。同时由于采用两段式反应工艺,可采用不同的催化剂和反应工艺条件,以提高每一段的催化反应性能。
1 反应体系剖析
以二氯乙烷、氯化氢和氧气为原料的氧氯化制三、四氯乙烯的反应十分复杂,主要反应有5类,分别为氯烷烃取代氯化生成多氯烷烃、多氯烷烃脱氯化氢生成多氯烯烃、多氯烯烃加成氯化生成多氯烷烃、多氯烷烃和多氯烯烃与氧气深度氧化生成COx及氯烷烃取代氯化和多氯烷烃脱氯化氢副产的氯化氢一并与氧气发生Deacon反应生成氯气;前3类反应都是多步连串反应,构成的反应网络如图 1所示。
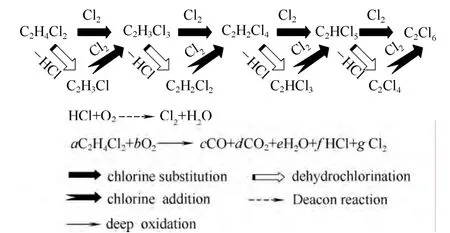
图1 反应网络Fig.1 Diagram of reaction network
其中取代氯化属于自由基链式反应,高温可以加快自由基的生成速率[16];对于加成氯化,高温亦可以促进氯气的均裂,加快氯化反应速率;钾元素作为氧氯化催化剂最为常见的助剂,能够很好地提高氧氯化催化剂的各项性能[17]。对于脱氯化氢反应,钾元素的增加可以提高脱氯化氢反应的选择性[18]。另外,取代氯化和脱氯化氢均有副产氯化氢生成,因此增加催化剂活性组分的含量,可以提高氯化氢氧化反应速率[12],从而促进取代氯化和脱氯化氢反应的发生。
二氯乙烷、氯化氢氧氯化联产三、四氯乙烯的总反应方程式如下
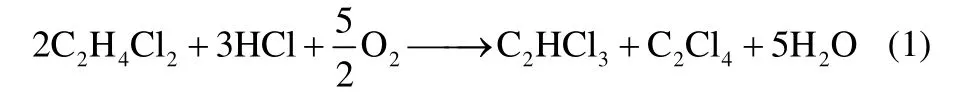
按式(1)计算的反应热为-694.2 kJ·mol-1。
其中,氯化氢和氧气制氯气的 Deacon反应,反应热为-28.9 kJ·mol-1。由于反应热不大,第 1段可采用结构简单的固定床反应器。
其中二氯乙烷、氯气氧氯化联产三、四氯乙烯的反应方程式如下
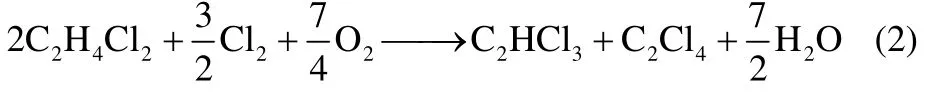
按式(2)计算的反应热为-609.0 kJ·mol-1,属于热效应很大的强放热反应,因流化床具有移热能力强、等温性好、易于连续反应-再生的优势[19],采用流化床反应器更适宜。
2 实验方法
2.1 氧氯化反应装置及操作
二氯乙烷氧氯化性能评价装置如图2所示。该反应性能评价装置采用实验室自主设计的玻璃材质固定床-流化床串联反应系统,反应器内径均为 24 mm,高度约500 mm;反应器外部设有三段控温电加热炉控制反应器床层温度。氯化氢与氧气分别通过质量流量计计量后通入第1段固定床反应器,维持其出口氯化氢转化率70%以上,此时第1段反应器催化剂装填量为5 g,温度为430℃,压力为0.1 MPa;第1段反应产物由流化床底部进入流化段,二氯乙烷进料流量由高压恒流泵控制,经预热气化后从流化床反应器下部侧线通入。反应气体总通入量大于240 ml·min-1时,流化状态能够保持稳定。反应后气体由流化床反应器的顶部排出,可凝产品经 0℃冷阱冷凝,不凝组分经碱液吸收瓶处理后排空。各管路均设有加热带保温,冷阱收集液分层,获得反应的油相产品。
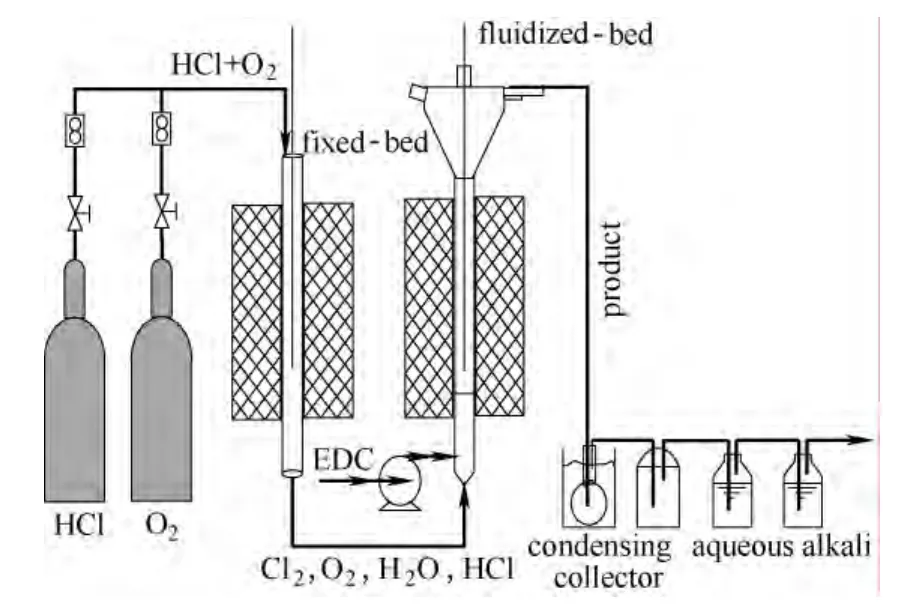
图2 两段反应串联的反应装置Fig.2 Reaction equipment of two reactions in series
2.2 催化剂制备与表征
按照一定质量比称取 CuCl2·2H2O、Ce(NO3)3·6H2O、KCl、水、ReY 分子筛,将CuCl2·2H2O、Ce(NO3)3·6H2O和KCl溶于水中,搅拌,再加入ReY分子筛,充分混匀,挤条成型,制成直径3 mm的条状,110℃下烘干,然后550℃下焙烧3 h制得。
流化床催化剂为固定床催化剂经过破碎和筛分后制得的,其颗粒尺寸在20~100 μm之间。由于氧氯化反应与氯化氢氧化反应对催化剂活性组成要求的不同,实验中对流化床催化剂的活性组分负载量进行了优化。
CO2-TPD:在美国麦克仪器公司 AutoChemⅡ2920上进行,TCD检测器检测并记录信号。首先称取一定质量的催化剂,以高纯He(99.999%)在500℃下预处理 1 h,冷却至 120℃后,通入 CO2(10%)-He (90%)混合气处理1 h,然后继续在120℃的He气氛吹扫2 h,以10℃·min-1升温至600℃进行程序升温脱附。
2.3 产物组成分析
采用山东鲁南瑞鸿化工仪器有限公司的SP-6800A型气相色谱仪分析,氢火焰检测器,SE-54毛细管色谱柱,柱温 140℃,检测室温度 200℃,汽化室温度 200℃。定量分析方法为内标法,内标物选取为对氯甲苯。气相产品主要为碳氧化物及微量氯乙烯;液相产品成分复杂,为多种氯烷烃、氯烯烃及微量单碳氯烃的混合物。出峰次序为二氯乙烯、三氯乙烯、三氯乙烷、四氯乙烯、四氯乙烷、五氯乙烷和六氯乙烷等,各产物已由气质联用分析仪确认。
3 实验结果与讨论
3.1 二段反应串联工艺与单段氧氯化工艺的比较
为了证明二段串联工艺的优越性,分别在二段反应串联工艺(工艺 A)和单段反应工艺(工艺 B) 中进行了一系列的实验。单段反应工艺中氧气、氯化氢和二氯乙烷被直接通入流化床内进行反应。
比较了两种工艺不同进料配比时的反应结果,具体见表1。从表1中可见,在实验进料配比下,工艺A中三、四氯乙烯总收率及有机氯的总收率均优于工艺 B,工艺 A中三、四氯乙烯的总收率68.7%~83.4%,工艺 B中三、四氯乙烯的总收率57.4%~79.1%,高出4~11个百分点;尤其在实验进料配比范围内,工艺A的有机氯的总收率均维持在94.7%~96.3%,有效地避免了有机物深度氧化的发生;反观工艺 B,有机氯的总收率仅 85.0%~90.7%,工艺A比工艺B的有机氯的总收率高6~10个百分点,且工艺A有机氯的总收率随进料配比的变化影响更小,这使得进料配比能够在更大范围内变化。

表 1 不同进料配比下二段反应串联工艺与单段工艺的比较Table 1 Comparison of yields between two-stage process and single-stage process with feeding of different molar ratios
图3为两种工艺在不同重时空速条件下的反应结果,显示工艺A的三、四氯乙烯的收率及有机氯的总收率均比工艺B高;尤其在重时空速较大时工艺A更具有优越性。
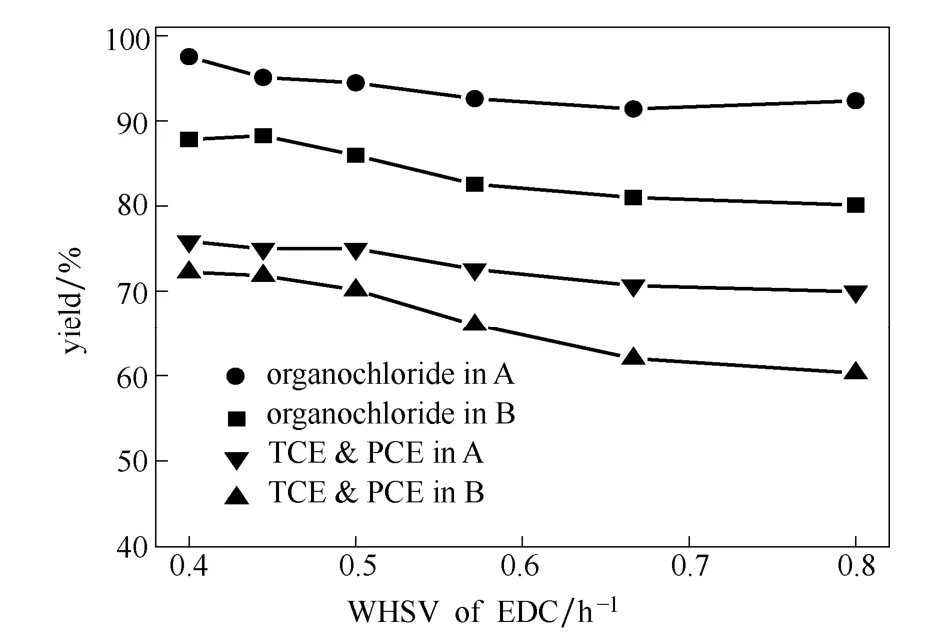
图3 不同二氯乙烷重时空速下二段反应串联工艺与单段工艺收率的比较Fig.3 Comparison of yields between single-stage process and two-stage process with different WHSV (fluidized-bed conditions:EDC:O2:HCl (mol)=1:1.5:2, 430 , 0.1 MPa)℃
以二氯乙烷、氯化氢和氧气进料摩尔比为1:1.25:1.5(按二氯乙烷、氯化氢氧氯化反应的理论配比)为例,两种工艺反应产物分布的对比见表2。从表中可见,工艺A除氯化深度较低的三、四氯乙烷外,其余氯烃产品的收率较工艺B均有较大幅度的提升,三、四氯乙烯的总收率上升 19.7%,达到68.7%;有机氯的总收率上升13.3%,达到96.3%。这是由于第1反应段能为第2反应段提供大量的氯气,以加速二氯乙烷取代氯化反应的发生,加深了反应器内混合物的氯化深度,生成了更多的四、五氯乙烷,从而提高了三、四氯乙烯的总收率;同时,氯化深度的增加提升了产品混合物的抗氧化性能,且第1段发生的氯化氢氧化反应降低了通入第2段流化床内的氧气浓度,从而降低了有机氯被氧气氧化的速率,提高了有机氯的总收率。
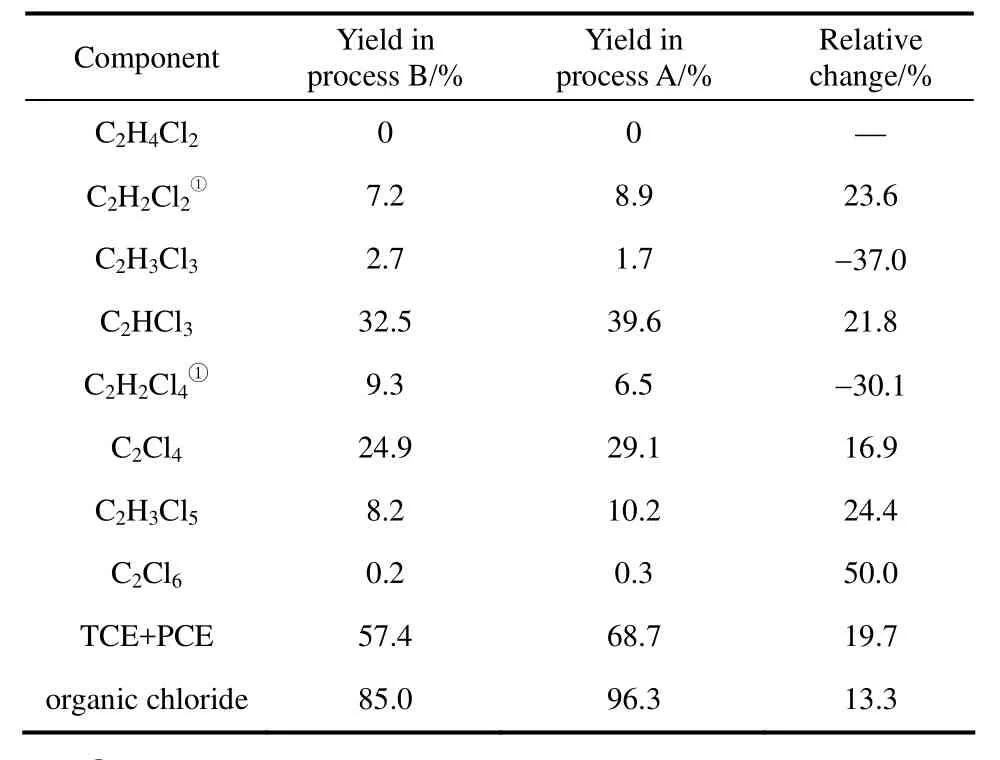
表2 两种工艺产物组成的比较Table 2 Comparison of product compositions between process A and process B
3.2 二段反应中催化剂的钾铜比对反应的影响
对于已研发的氯化氢氧化制氯气的Ce-Cu-K催化剂:氧化铈能够显著提高催化剂储释氧的能力[20],以增加氯化氢氧化性能,因此其铈铜比例不考虑调整;然而第2段催化剂除需要对氯化氢氧化制氯气反应有催化作用外,还需具有促进氯烷烃脱氯化氢反应的能力。脱氯化氢反应则需要催化剂具有适宜的碱度。本节固定Cu、Ce的负载量,改变K的负载量,以 Cu为质量基准,考察催化剂碱性对反应结果的影响。
采用 CO2-TPD技术对不同钾负载量的催化剂的表面碱性进行了分析,图4为3种钾铜质量比下的CO2-TPD曲线。从图中可见,钾负载量的增加可以使催化剂在 200~300℃形成一个强的 CO2脱附峰,这样的脱附峰在钾含量较低的催化剂样品中并不明显。可见钾负载量的增加能够提升催化剂的表面碱性。
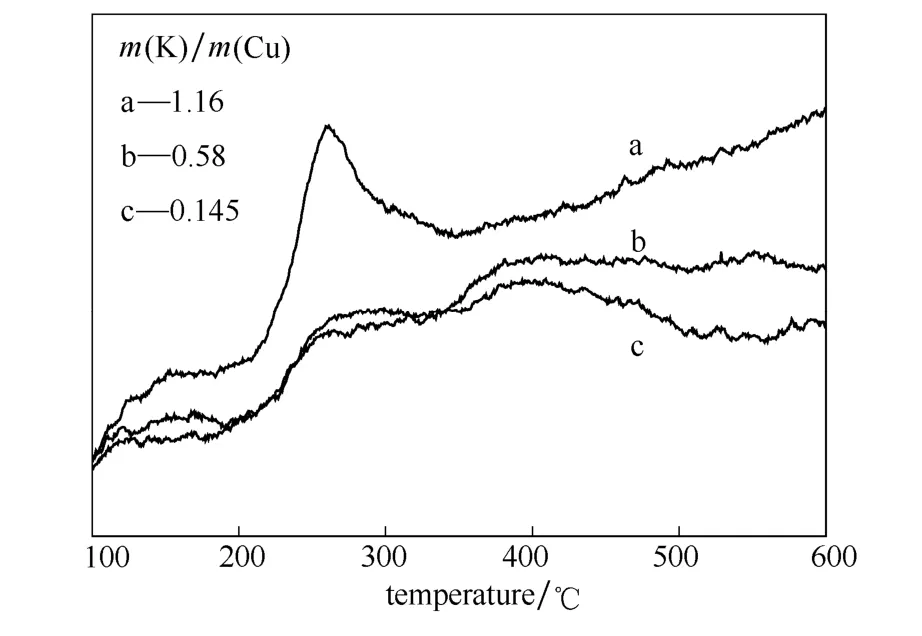
图4 不同钾铜质量比催化剂的CO2-TPD谱图Fig.4 CO2-TPD profiles of catalysts on differentm(K)/m(Cu)

图5 钾铜质量比对反应收率的影响Fig.5 Effect ofm(K)/m(Cu) on reaction yields(fluidized-bed conditions:0.5 h-1(WHSV of EDC), 430℃,0.1 MPa, EDC:O2:HCl (mol)=1:2:2)
图5为钾含量对反应结果的影响,从图5 (a)中可见,随着钾铜质量比由0.145增加至0.73,三、四氯乙烯的收率由 49.7%上升至 76.7%,有机氯总收率由64.7%上升至91.2%,0.73时达到最优。此后,随着钾含量的进一步上升,三、四氯乙烯的收率及有机氯的总收率随之下降。当钾铜质量比增大至1.16时,三、四氯乙烯收率较最优时下降了5.2个百分点,有机氯总收率下降了4.2个百分点。另外发现当二者质量比低于0.3时,反应器内催化剂的流化质量较差,导致三、四氯乙烯收率及有机氯总收率较低。
图 5 (b)揭示了催化剂钾含量与反应体系中氯烷烃脱除氯化氢能力的关系。随着催化剂中钾负载量的增加,反应产物中氯烷烃的收率逐渐下降,而三种氯烯烃的总收率逐渐上升。这说明通过增加催化剂的钾负载量,能够显著地增强催化剂的脱氯化氢的能力。随着钾铜质量比从0.29上升至1.16,催化剂的脱氯化氢能力逐渐增强,副产二氯乙烯(DCE)的产率由1.6%上升至12.1%;而当该比例高于0.73时,氯烯烃的总收率维持在80%左右,不再明显增加,这使得此时三、四氯乙烯总收率呈下降趋势。另外,文献中提到氯化铜催化剂的黏度与其铜含量直接相关,该氯化铜负载量下催化剂的流化性能不佳[21]。多次实验后发现,使用氯化钾作为催化剂助剂能够降低催化剂在高温时的黏性。当钾铜质量比大于0.3时,反应器可以长时间稳定操作。图5 (b)中第1个点的氯烷烃收率明显偏低,这是因为当钾铜质量比低于0.2时,反应温度下反应器内催化剂发生完全板结,无法流动,使得氯烷烃的收率出现异常。
3.3 二段反应中催化剂活性组分质量含量对反应的影响
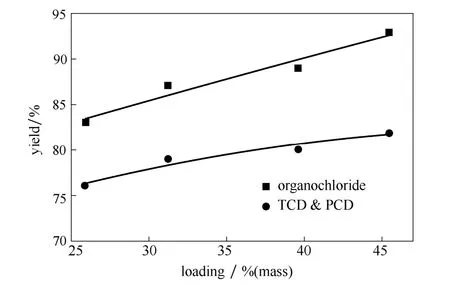
图6 活性组分质量含量对收率的影响Fig.6 Effect of loading amount of catalyst on yields(fluidized-bed conditions:0.5 h-1(WHSV of EDC), 430,℃0.1 MPa, EDC:O2:HCl (mol)=1:2:2)
维持催化剂中Ce/Cu/K比例不变,考察催化剂焙烧后CuCl2、CeO2和KCl三活性组分质量占催化剂总质量的百分比对反应收率的影响。实验结果如图6所示。从图中可见:较高的活性组分质量含量能够显著提高三、四氯乙烯的总收率和有机氯的总收率。当活性组分质量含量达到 45.5%时,三、四氯乙烯的总收率最高为82.8%,有机氯的总收率为93.1%。这是由于较高的活性组分质量含量有利于氯化氢氧化制氯气反应的发生[13,22],提高了氯气的生成速率和氯气浓度,从而促进了三、四氯乙烯的总收率和有机氯的总收率的上升。
3.4 二段反应器的工艺条件优化
本节控制第1段氯化氢氧化段的反应温度、压力及催化剂用量不变。考察第2段工艺条件对反应结果的影响。
3.4.1 第2段操作温度的优化 第1段反应器温度不变,考察了第2段流化床反应器操作温度对反应结果的影响,见图7。由图可见,在410~435℃内,二氯乙烷的转化率均达100%。反应温度由410℃提高至 430℃,三、四氯乙烯的总收率及有机氯总收率逐渐提高。430℃为最优反应温度,该反应温度下三、四氯乙烯的总收率可达 83.1%,有机氯总收率可达96.1%。当反应温度进一步升高至435℃时,有机氯的总收率和三、四氯乙烯的总收率均明显下降,可见过高的反应温度对该反应是不利的。

图7 反应温度对结果的影响Fig.7 Effect of temperature on reaction result (fluidized-bed conditions:0.5 h-1(WHSV of EDC), 0.1 MPa, EDC:O2:HCl(mol)=1:1.8:2.4)
3.4.2 第2段重时空速对反应的影响 维持其他条件不变,通过改变催化剂的装填量来改变二氯乙烷重时空速。考察其重时空速对反应结果的影响,结果如图8所示。可见,在实验范围内,二氯乙烷的转化率都达到了 100%,已反应完全;重时空速的降低有利于该反应的发生,因此三、四氯乙烯的总收率和有机氯的总收率都随之提高。适宜的二氯乙烷的重时空速在0.5 h-1附近,当降低重时空速至0.4 h-1时,三、四氯乙烯的总收率和有机氯的总收率略有下降;继续降低重时空速,会由于六氯乙烷生成量增加导致堵塞反应器出口管道,同时导致三、四氯乙烯的总收率进一步下降。
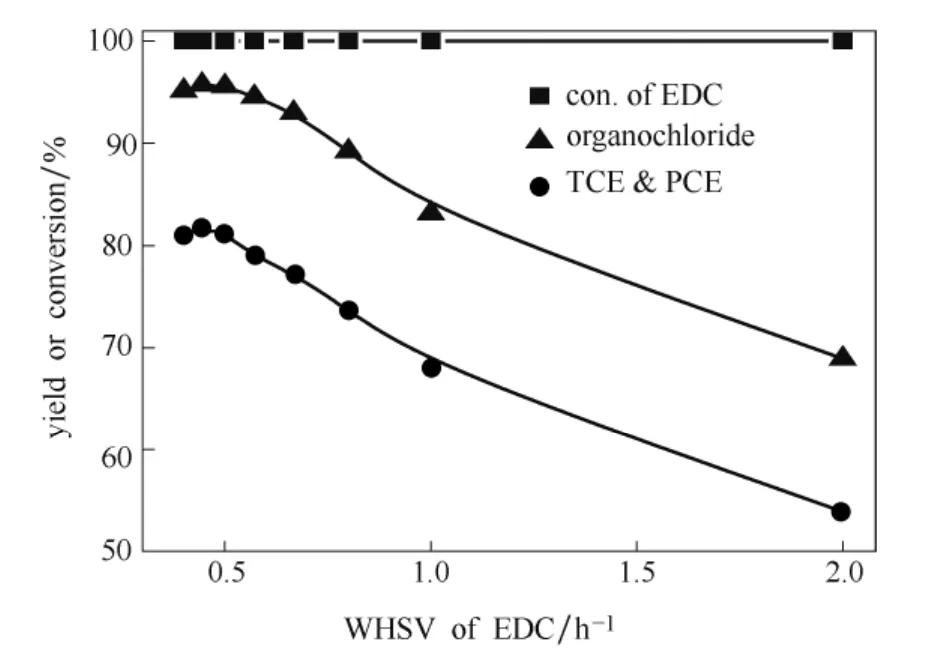
图8 二氯乙烷重时空速对反应结果的影响Fig.8 Effect of WHSV of EDC on reaction result(fluidized-bed conditions:430 ℃ , 0.1 MPa, EDC:O2:HCl(mol)=1:1.8:2.4)
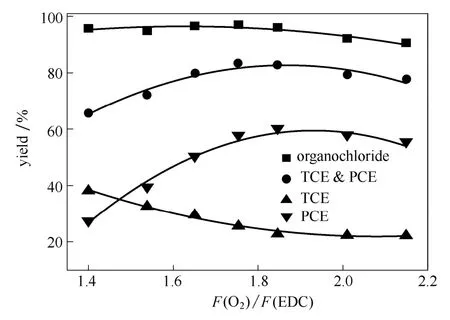
图9 氧通量对反应结果的影响Fig.9 Effect of oxygen flux on reaction result (fluidized-bed conditions:0.5 h-1(WHSV of EDC), 430 , 0.1 MPa,℃EDC:HCl (mol)=1:2.4)
3.4.3 氧气与二氯乙烷进料摩尔比的影响 保持二氯乙烷与氯化氢的进料流量(摩尔比为1:2.4)不变,改变第1段反应器入口的氧气通入流量,改变氧气与二氯乙烷进料摩尔比,反应结果见图 9。当氧气与二氯乙烷的摩尔比由1.4增加至1.8时,有机氯的总收率变化很小,维持在95%附近,而四氯乙烯收率上升较快,三氯乙烯收率下降较慢,二者总收率由 65.6%上升至 83.4%。在这一阶段氧气通入量的增加会促进氯化氢氧化反应的发生,增加反应的氯化深度,有利于四氯乙烷向五氯乙烷转化,从而生成更多的四氯乙烯,显著提高了四氯乙烯的收率。另外,在此氧气通入量条件下,副产氯烷烃的收率随着氧气通入量的上升而下降。根据文献报道,少量氧气的存在能够与氯烷烃中的氢原子直接反应生成水和氯烯烃,加速氯烯烃的生成反应[1],减少氯烷烃副产物的收率,提高三、四氯乙烯的总收率。只有当氧气与二氯乙烷进料摩尔比大于1.85时,氧气的进一步增加才会导致有机氯深度氧化反应的发生,导致物料收率发生明显下降。从图中可见,适宜的氧气与二氯乙烷进料摩尔比为1.65~1.85。
3.4.4 氧气与二氯乙烷、氯化氢进料配比的影响保持二氯乙烷流量不变,通过改变第1段氧气、氯化氢的进料流量可以调节三、四氯乙烯的联产比例,以满足市场对三、四氯乙烯的不同需求。因此实验考察了进料组成变化对反应产物组成的影响。图10中a、b和c分别为按照单产三氯乙烯、1:1联产三、四氯乙烯及单产四氯乙烯的理论配比进料时的反应结果;图10中d、e和f为氯化氢和氧气按照单产四氯乙烯的理论配比分别过量10%、20%及30%时进料的反应结果。结果显示,随着氯化氢与氧气的通入量的增加,反应产物的氯化深度逐步加深。由于四氯乙烯接近二氯乙烷氧氯化反应网络的终端,氯化氢与氧气适当的过量有利于减少二氯乙烯、四氯乙烷和五氯乙烷等副产物的产生,同时提升三、四氯乙烯的总收率。配比a时氧气通入量不足导致氯化深度不够,二氯乙烷未能反应完,产物分布较平均;同时副产产生的氯化氢也不能被充分氧化,最终致使三、四氯乙烯的总收率仅41.3%;配比b~e时有机氯的总收率均能达到95%左右,其中三氯乙烯的总收率由 39.6%降至 27.3%,四氯乙烯的总收率由29.1%增至56.1%;e的反应结果最佳,在此配比下,反应的三、四氯乙烯的总收率最高可达83.4%,其余副产有机氯的总收率为12.7%。氯化氢与氧气进一步过量(配比 f)时,反应总收率会由于氧气的通入量过高而下降。

图10 进料组成对反应结果的影响Fig.10 Effect of feed composition on reaction result(fluidized-bed conditions:0.5 h-1(WHSV of EDC), 430℃,0.1 MPa; EDC:O2:HCl (mol):a—1:1:1; b—1:1.25:1.5;c—1:1.5:2; d—1:1.65:2.2; e—1:1.8:2.4; f—1:1.95:2.6)
4 结 论
(1)通过对二氯乙烷、氯化氢、氧气氧氯化制三、四氯乙烯的复杂反应体系的剖析,提出了包含5类反应的反应网络;并将复杂反应体系分解为两段反应串联进行,并实验证明了两段反应串联工艺的优越性;相较于单段反应工艺,两段反应串联工艺有机氯的总收率维持在95%左右,比单段反应工艺提高了4~10个百分点;三、四氯乙烯的总收率最高达83.4%,而单段反应工艺最高仅79.1%。
(2)适当的钾含量对于氯化氢氧化催化剂应用于本反应体系是必要的,以铜的质量为基准,适宜的钾铜质量比为0.73。在此配比下,等比提高第二段流化床催化剂的活性组分质量含量能够提升有机氯的总收率和三、四氯乙烯的收率。此比例下,增加催化剂的质量含量,当活性组分质量含量达到45.5%时,三、四氯乙烯的总收率最高为82.8%,有机氯的总收率为93.1%。
(3)对第 2段氧氯化反应的工艺条件进行了优化,结果表明适宜的反应温度为 430℃;适宜的二氯乙烷重时空速为0.5 h-1;氧气适当过量有利于加深产物的氯化深度,降低副产物的收率,但不宜超过二氯乙烷的1.85倍,二氯乙烷、氧气与氯化氢的进料配比1:1.8:2.4时结果最优,此时三、四氯乙烯收率最高可达 83.4%,有机氯的总收率可达96.1%。
[1] Sutherland I W, Hamilton N G, Dudman C C, Jones P, Lennon D,Winfield J M. Chlorination and dehydrochlorination reactions relevant to the manufacture of trichloroethene and tetrachloroethene.Reaction pathways [J].Applied Catalysis A-General, 2011, 399 (1/2):1-11.
[2] Kang Hongjie (康宏杰), Zhong Jinian (钟继年), Du Juan (杜娟).Method for preparing trichloroethylene and perchloroethylene from dichloroethane as raw material [P]:CN, 201110125629.5. 2011-12-07.
[3] Jiang Zhenghui (江政辉), Zhong Jinguang (钟劲光), Wu Ming (吴明). Method for preparing tetrachloroethylene by pentachloroethane gas phase catalysis method [P]:CN, 201310072018.8. 2013-05-22.
[4] Guo Ge (郭戈), Cheng Xinyu (程新玉), Zhao Zhengdong (赵正东),Li Honglin (李红林), Yin Jiexin (殷杰信), Huang Zehua (黄泽华).Industrial preparation method for tetrachloroethylene [P]:CN,201210286513.4. 2012-12-12.
[5] Liu Shigang (刘世刚). Tetrachloroethylene production device andmethod [P]:CN, 201310071626.7. 2013-05-22.
[6] Gorton E M, Mcgreevy R E. Process for making tetrachloroethylene[P]:US, 4002695. 1977-01-11.
[7] Berkowitz S, Prak H, Meadow M. Oxychlorination process for preparing trichloroethylene and tetrachloroethylene [P]:US, 3527819.1970-09-08.
[8] Diamond L H, Yardley P, Lobunez W. Catalysts for oxychlorination reactions [P]:US, 3360483. 1967-12-26.
[9] Bohl L E, Vancamp R M. Production of perchloroethylene and trichloroethylene utilizing oxychlorination reaction [P]:US, 3642918.1972-02-15.
[10] Bohl L E, Vancamp R M. Particle size control in fluidized oxychlorination reaction [P]:US, 3296319. 1967-01-03.
[11] Chen Xian (陈献), Qiao Xu (乔旭), Cui Mifen (崔咪芬), Tang Jihai(汤吉海). Study on oxidation of HCl over RE-Cu-K/Y-zeolite catalyst[J].Chemical Reaction Engineering and Technology(化学反应工程与工艺), 2007, 23 (5):477-480.
[12] Chen Xian (陈献), Qiao Xu (乔旭), Tang Jihai (汤吉海), Cui Mifen(崔咪芬). Preparation and catalytic performance of rare earth composite molecular sieve catalyst [J].Journal of Chemical Engineering of Chinese Universities(高校化学工程学报), 2008, 22(1):118-121.
[13] Chen Xian (陈献), Lü Gaoming (吕高明), Tang Jihai (汤吉海), Cui Mifen (崔咪芬), Zhou Zhe (周哲), Cao Rui (曹锐), Qiao Xu (乔旭).Research on preparation of nano complex Ce-Cu-K catalyst loaded in the Y-type zeolite and its performance [J].Journal of Chemical Engineering of Chinese Universities(高校化学工程学报), 2011, 25(1):109-113.
[14] Cao Rui (曹锐), Fei Zhaoyang (费兆阳), Chen Xian (陈献), Tang Jihai (汤吉海), Cui Mifen (崔咪芬), Qiao Xu (乔旭). Synergetic effect of CuO and CeO2on hydrogen chloride catalytic oxidation [J].Chemical Reaction Engineering and Technology(化学反应工程与工艺), 2013, 29 (4):295-300.
[15] Xie Xingxing (谢兴星), Fei Zhaoyang (费兆阳), Dai Yong (戴勇),Xu Xihua (徐希化), Chen Xian (陈献), Tang Jihai (汤吉海), Cui Mifen (崔咪芬), Qiao Xu (乔旭). Structure of ceria-based mixed oxides and its influence on HCl catalytic oxidation performance [J].Journal of Molecular Catalysis(China)(分子催化), 2014, 28 (6):507-514.
[16] Bryukov M G, Slagle I R, Knyazev V D. Kinetics of reactions of Cl atoms with ethane, chloroethane, and 1,1-dichloroethane [J].The Journal of Physical Chemistry A, 2003, 107 (34):6565-6573.
[17] Liu J, Lu X J, Zhou G D, Zhen Kaiji, Zhang Wenxiang, Cheng Tiexin.Effect of KCl on CuCl2/gamma-Al2O3catalyst for oxychlorination of ethane [J].React.Kinet.Catal.Lett., 2006, 88 (2):315-323.
[18] Qin Yue (秦越), Zhang Wei (张伟), Wang Bo (王博), Ma Yangbo (马洋博), Mao Wei (毛伟), Lü Jian (吕剑). Research advance on catalysts for synthesis of hydrofluoroolefins by dehydrohalogenation reaction [J].New Chemical Materials(化工新型材料), 2011, 39 (12):34-37.
[19] Wang Yao (王垚), Di Zouxing (狄佐星), Li Yuxin (李玉新), Wei Fei(魏飞). Multiphase catalytic reactors for methanol-to-olefins [J].CIESC Journal(化工学报), 2014, 65 (7):2474-2484.
[20] Fei Zhaoyang, Liu Haoyue, Dai Yong, Ji Weijie, Chen Xian, Tang Jihai, Cui Mifen, Qiao Xu. Efficient catalytic oxidation of HCl to recycle Cl2over the CuO-CeO2composite oxide supported on Y type zeolite [J].Chemical Engineering Journal, 2014, 257:273-280.
[21] Chang Peiting (常培廷), Hu Gangshi (胡刚石), Han Minghan (韩明汉), Wu Qin (吴勤), Wei Fei (魏飞), Jin Yong (金涌). Conversion of hydrogen chloride to chlorine in a two-zone circulating fluidized bed reactor [J].The Chinese Journal of Process Engineering(过程工程学报), 2006, 6 (1):47-50.
[22] Wang Lunwei (王伦伟), Han Minghan (韩明汉), Wu Yulong (吴玉龙), Jin Yong (金涌). Conversion of hydrogen chloride to chlorine by catalytic oxidation [J].The Chinese Journal of Process Engineering(过程工程学报), 2003, 3 (4):340-345.

