腹腔镜直肠癌根治术的安全性探讨*
赵玉国,张建文,黄仁峰,杨文斌,罗一民
(郴州市第一人民医院,湖南 郴州,423000)
腹腔镜技术因具备机体创伤小、康复快、住院时间短等优点在外科领域得到广泛应用,腹腔镜直肠癌根治术的操作也日臻熟练,但作为近年新的外科手术方式,其安全性、肿瘤根治程度被人们普遍关注,本文通过分析我院胃肠外科腹腔镜与传统开腹直肠癌根治术患者的临床资料,进一步探讨腹腔镜直肠癌根治术的安全性。
1 资料与方法
1.1 临床资料 随机选取2012年7月至2014年7月我院收治的腹腔镜直肠癌根治术患者60 例作为研究对象(腹腔镜组),45~72 岁,住院时间10~14 d;传统开腹直肠癌根治术72 例患者作为对照组(开腹组),44~73 岁,住院时间14~25 d;患者术前均在肠镜下取肿瘤组织活检,手术后肿瘤标本送病理检测基质金属蛋白酶-7(MMP-7)表达水平。纳入标准:(1)病理明确诊断直肠癌;(2)原发病灶为直肠,无转移;(3)无明显心肺疾病可耐受手术;(4)愿意积极接受手术治疗。排除标准:(1)术前接受过放、化疗的直肠癌及过度肥胖患者;(2)有急性肠梗阻或穿孔表现;(3)可能伴有术中出血风险的疾病及腹部大手术史致腹腔严重粘连;(4)复发或继发性结直肠癌或局部进展或晚期患者。手术均由同一组医师完成。两组患者一般资料差异无统计学意义(P>0.05),具有可比性。见表1。
表1 两组患者一般资料的比较(±s)

表1 两组患者一般资料的比较(±s)
* Mann-Whitney U 检验
?
1.2 手术方法 两组术前准备相同,采用全身麻醉,患者取改良膀胱截石位。开腹(腹腔镜手术组建立气腹)后,不进行任何手术操作,用200 ml 温生理盐水冲洗腹腔局部肿瘤位置及膀胱直肠陷窝(女性为道格拉斯窝),轻轻搅动后吸出腹腔冲洗液约100 ml,高速离心后HE 染色查找癌细胞。手术操作严格遵守全直肠系膜切除(total mesorectal excision,TME)原则及无瘤原则,对肿瘤的淋巴引流区进行全面清理,按无瘤原则进行切除。两组手术腹腔内操作均使用超声刀。在肿瘤切除后、关腹前用温生理盐水200 ml 冲洗腹、盆腔,搅动后取约100 ml 腹腔冲洗液。高速离心后HE 染色查找癌细胞,发现一个癌细胞为腹腔冲洗液为阳性。肿瘤标本采用免疫组化检测MMP-7 表达水平。
1.3 结果判定 (1)HE 染色阳性结果判断,如出现细胞核大、核深染、核畸形、核异常分裂象及核浆比例失常等明显形态学特征性表现。此外腹腔冲洗液中能找到异形的间皮细胞、血细胞、巨噬细胞。病理医生读片判断结果,且病理医生不知道涂片来源与分组情况。(2)根据半定量计分法判定免疫组化结果,通过高倍显微镜下观察,阳性细胞呈棕黄色,根据阳性细胞染色程度和染色细胞百分率记分:0 分是不着色,1 分是着色淡,着色中2 分,着色深3 分;着色细胞在计数细胞中的百分率:小于5%为0 分,1 分为6%~25%,2 分为26%~50%,大于或等于51%为3 分;用每张切片染色得分与细胞平均着色百分率得分相乘:≤1 分为阴性(-),2~3分为(+)、4~6 分为(++)、>6 分为(+++),阳性表达是指≥(+)。
1.4 观测指标 (1)术中指标:手术时间、术中出血量、切口长度;(2)术后恢复指标:术后镇痛时间、排气时间、尿管留置时间、肺部感染、吻合口漏、切口感染、肠梗阻、住院时间;(3)安全性指标:环周切缘、清扫淋巴结数量、肿瘤至远切缘长度、冲洗液癌细胞阳性率、MMP-7 表达水平。
1.5 统计学处理 采用SPSS 18.0 统计软件进行整理分析。计数及等级资料以频数(构成比)形式表示,计数资料组间比较采用卡方检验或Fisher 精确概率法,等级资料比较采用Mann-Whitney U 检验;计量资料以均数± 标准差(±s)形式表示,组间比较采用独立样本t 检验,P <0.05 为差异有统计学意义。
2 结 果
2.1 术中指标 手术均顺利完成,腹腔镜组无一例中转开腹,手术时间长于开腹组,术中出血量、切口长度明显优于开腹组,差异有统计学意义(P<0.05)。见表2。
2.2 术后恢复指标 腹腔镜组术后镇痛时间、排气时间、尿管留置时间、住院时间短于开腹组,差异有统计学意义(P <0.05);切口感染、肠梗阻、肺部感染、吻合口漏发生率两组相比差异无统计学意义(P>0.05)。见表3。
2.3 安全性指标 环周切缘、清扫淋巴结数量、肿瘤至远切缘长度、冲洗液癌细胞阳性、MMP-7 阳性表达两组差异无统计学意义(P >0.05)。见表4。
表2 两组患者术中指标的比较(±s)
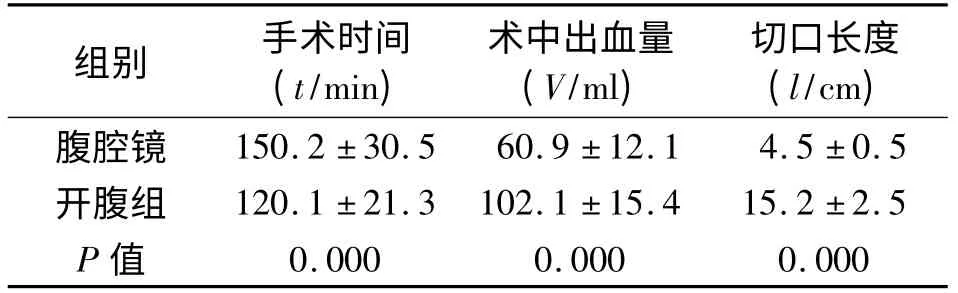
表2 两组患者术中指标的比较(±s)
?
表3 两组患者术后恢复指标的比较(±s)

表3 两组患者术后恢复指标的比较(±s)
* Fisher 精确概率法
?
表4 两组患者手术安全性指标的比较(±s)
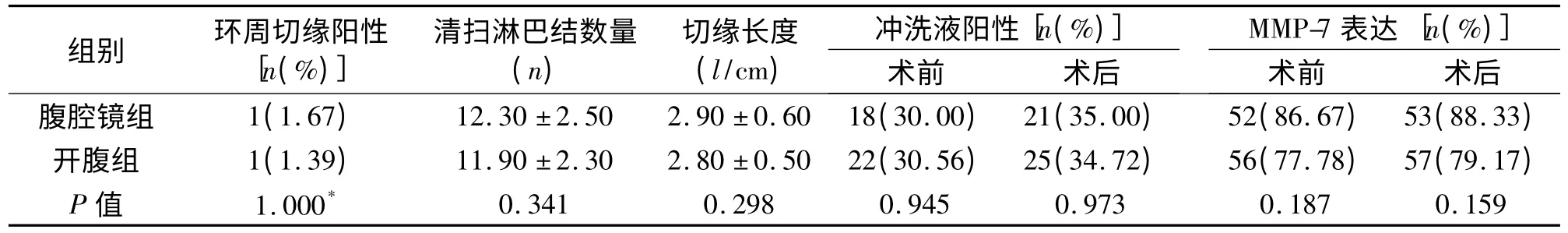
表4 两组患者手术安全性指标的比较(±s)
* Fisher 精确概率法
?
3 讨 论
结直肠癌是消化道常见的恶性肿瘤,位居男性恶性肿瘤的第三位,在女性中位居第二位,发病率不断上升[1]。外科手术治疗是结直肠癌的主要治疗手段,传统开腹TME 是标准术式,但微创技术的快速发展使得腹腔镜技术在胃肠外科得到广泛应用,腹腔镜直肠癌手术现逐渐成为治疗直肠癌手术的成熟术式之一[2]。目前,对于腹腔镜TME 安全性研究的临床资料相对较少。
腹腔镜直肠癌手术的死亡率低于传统开腹手术,其优点包括:术后疼痛减轻、胃肠功能恢复快、住院时间短、恢复健康快及免疫抑制轻[3-4]。腹腔镜与传统开腹手术的操作技术、淋巴清扫范围基本相同,初步疗效及肿瘤根治效果、远期疗效也已得到证实[5-6]。腹腔镜肿瘤手术能否得到认可,其关键在于能否达到开腹手术的根治标准[7]。本组研究表明,腹腔镜组手术时间长于开腹组,可能与团队配合熟练程度、手术例数不足有关;进一步加强手术团队的协作、制定详细的手术操作分工及手术操作过程标准化,短期内即可达到甚至优于开腹手术的手术时间。本组术中出血量、切口长度、术后镇痛时间、排气时间、尿管留置时间、住院时间均优于开腹组,可能因腹腔镜手术入路选择、间隙分离更准确,超声刀止血彻底,减少了术中出血。术中机械牵拉轻微,对内脏干扰少,腹腔镜可放大局部视野,利于神经的识别与保护,切口长度明显缩短,患者疼痛减轻,可早期下床活动等因素均利于患者术后功能的恢复,如排气时间早、尿管留置时间短,同时镇痛时间明显缩短。腹腔镜手术较开腹手术切口小,切口主要用途是取出标本,因此切口暴露时间短、切开时对腹壁肌肉与神经的损伤小、术中切口容易保护、污染率低,术后发生切口感染率一般较低,尤其Miles 术腹部仅为Trocar 穿刺孔,避免了器械与手的细菌传播途径,感染的可能性更低。腹腔镜手术对肠管机械刺激少,肠管几乎未暴露在周围环境,切口明显缩短,术后粘连性肠梗阻的几率一般较低,但本研究切口感染、粘连性肠梗阻发生率两组差异无统计学意义,可能是本组患者例数、观察时间有限所致,并且本组腹腔镜手术切口感染患者系肥胖患者脂肪液化后并发的感染,而非开腹手术患者可能系切口直接污染所致。腹腔镜手术与开腹手术均采用吻合器进行吻合,游离肠管及保留的系膜相差不多,因此,直肠癌的手术方式与术后吻合口漏并无直接联系[7],本研究中两组吻合口漏发生率亦无明显差异,不论环周切缘、清扫淋巴结数量、肿瘤至远切缘长度两组差异均无统计学意义,表明腹腔镜直肠癌根治术能达到开腹手术的效果,是治疗直肠癌的有效手段。腹膜返折以上的直肠癌可直接发生腹腔种植转移,发生腹腔转移重要的先决条件是癌细胞脱落至腹腔,机制可能是CO2导致腹膜损伤,使腹腔游离的肿瘤细胞粘附腹膜发生种植转移。本研究发现两组术前、术后冲洗液癌细胞阳性数差异无统计学意义,表明腹腔镜直肠癌手术不会增加癌细胞腹腔内脱离的风险,这可能是因为腹腔镜手术借助腔镜器械完成,这使手术操作对肿瘤组织刺激更小,手术更精细。
基质金属蛋白酶(matrix metalloproteinases,MMPs)在肿瘤发展中具有重要作用:(1)MMPs 对肿瘤生长具有调节作用,如MMP-9 减少可抑制肿瘤的生长速度,使肿瘤具有更高的分化程度;(2)对肿瘤细胞凋亡及血管生成的调节,如MMP-3、MMP-7 等具有调节肿瘤细胞凋亡作用,且MMPs 还能降解细胞外基质,调节肿瘤血管的生成,促进肿瘤细胞转移[8]。MMP-7 为MMPs 家族主要成员之一,主要功能是降解多种跨膜蛋白、弹力纤维、Ⅳ型胶原纤维及纤维连接素,与肿瘤的侵袭、转移密切相关[9],且在结直肠癌伴有腹腔微转移的情况下,MMP-7 阳性表达率会更高,表明MMP-7 在腹腔微转移中具有重要作用。然而,国内外对CO2气腹是否影响MMP-7 表达的相关研究较少,CO2气腹能否影响MMP-7 的表达水平及肿瘤细胞侵袭力,并通过这种变化促使肿瘤细胞发生种植转移?本研究通过比较腹腔镜手术组与开腹组术前、术后MMP-7 表达水平,结果表明与开腹手术相比,腹腔镜直肠癌根治术不会影响MMP-7 的表达,这也体现了腹腔镜直肠癌手术的安全性。由于本实验选择的病例数较少,检验方法较单一,仅CO2气腹对结直肠癌细胞MMP-7 表达的初步探讨,其远期效应尚待进一步研究。但CO2气腹使腹腔内局部微环境发生改变,包括血流下降、缺氧、酸中毒等,影响细胞能量代谢与生长周期,进而影响肿瘤细胞的生长及转移;CO2气腹是否促进直肠癌细胞其他MMPs(MMP-2、MMP-9 等)发生改变,影响肿瘤细胞的侵袭力及种植转移尚待下一步研究。
综上所述,与开腹手术相比,腹腔镜直肠癌手术尽管手术时间长,但具有手术出血少、术后住院时间短、康复快等优点,且符合根治要求,是安全、可行的,值得在临床上推广应用,可作为直肠癌根治性治疗的首选方案。
[1]汪建平.重视结直肠癌流行病学研究[J].中国实用外科杂志,2013,33(8):622-624.
[2]李国新,梁耀泽.腹腔镜结直肠癌手术应用及其评价[J].中国实用外科杂志,2010,30(3):186-190.
[3]Hong D,Tabet J,Anvari M.Laparoscopic vs.open resection for colorectal adenocarcinoma[J].Dis Colon Rectum,2001,44(1):10-18.
[4]Tjandra JJ,Chan MK.Systematic review on the short-term outcome of laparoscopic resection for colon and rectosigmoid cancer[J].Colorectal Dis,2006,8(5):375-388.
[5]Anderson C,Uman G,Pigazzi A.Oncologic outcomes of laparoscopic surgery for rectal cancer:a systematic review and meta-analysis of the literature[J].Eur J Surg Oncol,2008,34(10):1135-1142.
[6]Bonjer HJ,Hop WC,Nelson H,et al. Laparoscopically assisted vs open colectomy for colon cancer:a meta-analysis[J]. Arch Surg,2007,142(3):298-303.
[7]何二松,姚清深,周腾贤.腹腔镜直肠癌根治术的可行性、安全性及肿瘤根治性分析[J].腹腔镜外科杂志,2014,19(7):518-523.
[8]马顺茂,贾漪涛,刘红磊,等.结直肠癌组织MMP-7、MMP-9 表达与腹腔微转移的相关性研究[J].现代肿瘤医学,2011,19(6):1157-1160.
[9]Yoshimoto M,Itoh F,Yamamoto H,et al.Expression of MMP-7(PUMP-1)mRNA in human colorectal cancers[J].Int J Cancer,1993,54(4):614-618.

