真盐生植物梭梭和囊果碱蓬幼苗耐干旱能力的研究
丁效东,张士荣,刘阳超,冯固*
(1.青岛农业大学资源与环境学院,山东 青岛266109;2.中国农业大学资源与环境学院,北京100193)
盐生植物是指在当地盐土、重度盐渍化生境中正常并能完成生活史的自然植物区系[1],对于干旱区生态系统构建和稳定起着不可替代的作用。盐生植物种子库分布在土壤表层1~2cm,是植物群落建成的物质基础[2]。干旱区春季土壤的盐分含量、水分含量和温度变化剧烈,盐生植物种子在萌发阶段和幼苗生长阶段同时遭受着高盐度、干旱脱水-复水等土壤环境变化的影响。在一些干旱地区,降雨时间和降雨量都是不可预测的,种子遇降水萌发后,幼苗很可能再次受到干旱胁迫,幼苗若具有耐干旱脱水的能力,复水后可以继续生长,进而可以保证种群的繁衍[2-3]。干旱时间与植物干旱后复水时能否存活有着密切的联系[4-5]。
萌发初期的幼苗遭受高渗透势环境,幼苗的生存具有致命的影响。一些旱生植物、沙生植物的幼苗具备适应干旱脱水的能力,种子遇降水萌发后,幼苗很可能受到干旱胁迫,幼苗若具有耐干旱脱水的能力,复水后可以继续生长,进而可以保证种群的繁衍[3]。前人对盐生植物适应土壤干湿交替变化的不利环境的策略开展了大量研究,但是这些研究大多集中在种子萌发阶段的适应机制方面。例如,高浓度盐抑制种子使其不萌发,当盐浓度降低时快速萌发,而种子中脱水子叶含有叶绿素时保证萌发的幼苗快速生长[6]。迄今为止,盐生植物幼苗是否具备适应干旱脱水的能力这一问题尚缺乏深刻认识。
干旱和复水过程都会对植物造成氧化胁迫,在复水过程中产生的损伤比在干旱过程中产生的损伤更多[7]。上述研究多集中于旱生、沙生植物上,而对干旱区盐生植物研究鲜有报道。白梭梭(Haloxylon persicum)、梭梭(Haloxylon ammodendron)和囊果碱蓬(Suaeda physophora)3种植物干旱脱水的种子中含有叶绿素[8-9],这些叶绿素对种子萌发后幼苗的快速生长具有重要作用[9],然而这种特性在3种植物耐干旱脱水能力的关系尚不清楚。随着干旱时间的延长,白梭梭、梭梭和囊果碱蓬的耐干旱脱水能力有何变化,在干旱再复水后3种植物根部细胞的受伤和死亡情况怎样以及是如何克服氧化胁迫的?基于上述科学问题,本文以旱生植物白梭梭为对照,比较了真盐生植物囊果碱蓬、盐生-旱生植物梭梭在遭受高盐度生理干旱或干旱脱水后再遇复水环境后其幼苗生存能力,以期为理解干旱区植物盐生植物种群构建过程提供理论依据。
1 材料与方法
1.1 实验材料
白梭梭种子采自新疆古尔班通古特沙漠(N 44°22.019′,E 87°55.021′);梭梭和囊果碱蓬采自新疆阜康县八一水库周边(N 44°13.107′,E 87°41.052′)。种子在室温条件下风干后,保存于-10℃冰箱中待用。
1.2 实验设计与处理
1.2.1 干旱时间对耐干旱脱水能力的影响 2008年4月将白梭梭、梭梭和囊果碱蓬种子放入垫有两层滤纸的洁净干旱的直径为90mm培养皿中,先用700mmol/L NaCl预处理3d,以增加种子萌发时的整齐率;然后一部分转到含有去离子水(CK处理)中生长,另一部分转到300mmol/L NaCl溶液中1d(去离子水或盐溶液浸没种子1/2~2/3体积),使种子萌发;每种植物选取根长为0~1cm进行试验,分为4个重复,每个重复20棵幼苗。将幼苗转到培养皿中,然后把培养皿放置在底部放入饱和CaBr2,相对湿度为18.5%的干旱器中;再把干燥器放在智能人工气候箱中进行黑暗、干旱处理,培养箱温度控制在20℃的恒温。处理期间,初始24h内每隔2h称重一次;然后每隔24h称重,直至幼苗水分含量不再变化为止。将干旱7d后的幼苗再次转至底部垫有滤纸的有机玻璃板上,滤纸由去离子水或300mmol/L NaCl溶液湿润;然后把有机玻璃板放在智能人工气候箱中,并倾斜45°放置,培养箱温度控制在20℃的恒温,每天光照12h,光强为42μmol/(m2·s);干旱幼苗在上述条件下继续生长72h(底部滤纸始终保持湿润)。按上述同样的操作过程,进行14,21和28d的干旱和复水实验。
1.2.2 不同干旱处理对幼苗子叶叶绿素含量的影响 种子在700mmol/L NaCl溶液中处理3d后,按照下面(1)和(2)步骤进行处理后测定叶绿素含量。1)用去离子水溶液培养时,当幼苗胚长到2~3cm时,取多株幼苗1.6g左右的子叶,子叶分为两组,每组4个重复,每个重复0.2g左右;把子叶放在敞口培养皿中,将培养皿放置在干燥器中,干燥器的底部放有饱和CaBr2,且相对湿度为18.5%。然后将干燥器放在智能人工气候箱中进行干旱处理:一组为黑暗处理;另外一组为光照处理,光强为42μmol/(m2·s),培养箱温度控制在20℃的恒温。子叶干旱5d后,用95%乙醇研磨后过滤,然后在665和649nm波长下测定叶绿素a和叶绿素b含量。以未经干旱的根长为2~3cm的3种植物幼苗子叶的叶绿素含量作为对照。2)用300mmol/L NaCl培养,按(1)中相同的步骤进行处理,然后测定黑暗、光照中干旱的以及未干旱的子叶的叶绿素含量。
1.3 测定指标
1.3.1 干旱时间和NaCl处理对存活率的影响 以幼苗是否生长作为存活的依据,若幼苗能够生长,则视其为活的幼苗,存活率(%)=幼苗的存活数/幼苗干旱数×100,并进行反正弦转化。
1.3.2 干旱复水后幼苗平均伸长速率的测定 复水后每隔24h测定幼苗的长度,每个重复的20株幼苗的平均长度为一个重复。幼苗的平均伸长速率=(L3-L0)/3,L3和L0分别为同一个重复的20株幼苗的复水3d和复水前的平均长度。
1.3.3 幼苗相对含水量的测定 干旱前对每个重复称重(FW0)。前24h内每隔2h称重,然后每隔24h称量幼苗的重量,计算失水率,复水前再称重,复水后每隔24h称重。含水量用相对质量来表示,相对质量(%)=FWn/FW0×100。FWn表示干旱或复水第n小时或天数后重量。
1.3.4 希夫试剂和Evan’s blue染色 复水后,在各处理中随机选几株幼苗。将幼苗的根放入2mL希夫试剂(Schiff’s reagent)中,20min后在洗液中冲洗,并将根保存在洗液中,然后在体视镜下观察并照相。同时,从每个处理中再随机选几株幼苗,将幼苗的根放入2mL 0.5%的Evan’s blue试剂,10min后用去离子水冲洗3次,然后在体视镜下观察并照相。
1.3.5 叶绿素含量的测定 叶绿素a和叶绿素b含量按Ca=13.95D665-6.88D649,Cb=24.96D649-7.32D665计算(式中的D665和D649表示在波长665和649nm时的吸光度)[10]。
1.4 数据统计与分析
对胚根长度为1~2cm白梭梭、梭梭和囊果碱蓬幼苗干旱存活率的数据经反正弦转化后用SAS分别进行单因素分析。用LSD法在P=0.05水平进行多重比较。
2 结果与分析
2.1 干旱时间对存活率的影响
长度为1~2cm的白梭梭幼苗干旱7,14,21和28d后的干旱存活率之间均不存在显著性差异(表1),说明白梭梭的耐干旱能力比较强。长度为1~2 cm的梭梭幼苗干旱7,14和21d的存活率之间的大小关系是:7d幼苗 >14d幼苗 >21d幼苗,而三者之间均不存在显著性差异,但三者均与干旱28d的存在显著性差异,干旱复水后长度为1~2cm的梭梭的成活率随着干旱时间的延长而降低。长度为1~2cm的囊果碱蓬幼苗干旱7和14d的成活率不存在显著性差异,但都比较低,长度为1~2cm的囊果碱蓬幼苗干旱21和28d后都死亡,成活率为0,说明长度为1~2cm的囊果碱蓬幼苗的在此条件下在干旱时间上的极限点小于等于21d,也同时说明长度为1~2cm的囊果碱蓬幼苗干旱后成活率也是随着干旱时间的延长而降低(表1)。
对3种植物干旱相同时间后的存活率进行方差分析,白梭梭幼苗干旱7和14d的成活率均大于梭梭幼苗的成活率;而前两者的幼苗的成活率高于囊果碱蓬幼苗干旱7和14d的成活率;当幼苗干旱21和28d时,三者之间的存活率均存在显著性差异,存活率之间为:白梭梭幼苗>梭梭幼苗>囊果碱蓬幼苗。因此,在3种植物中,白梭梭的耐干旱能力最强,其次是梭梭,囊果碱蓬的耐干旱能力最差。
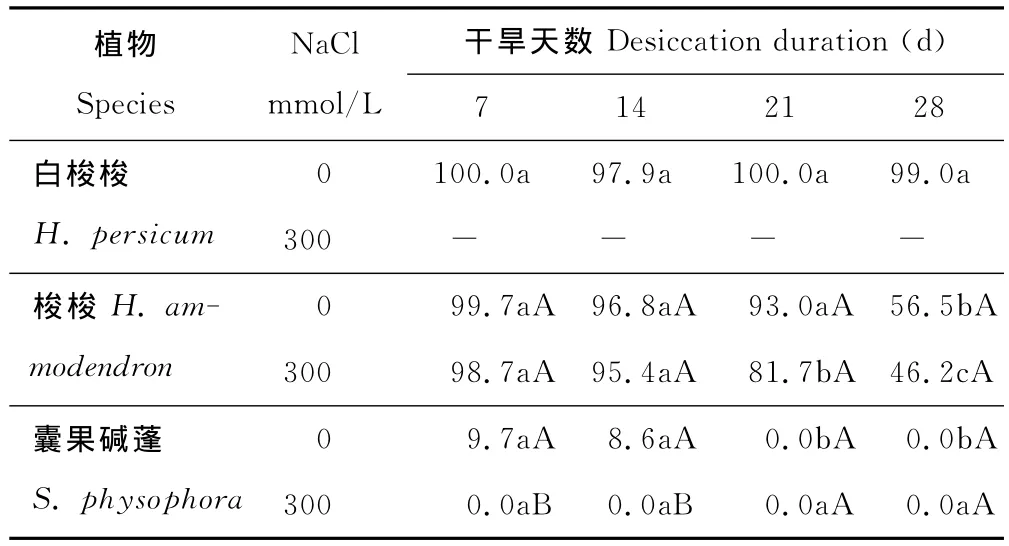
表1 长度为1~2cm白梭梭、梭梭和囊果碱蓬幼苗干旱7,14,21和28d的存活率Table 1 Survival rate of 1-2cm H.persicum,H.ammodendronand S.physophoraseedlings after 7,14,21and 28days desiccation
用300mmol/L NaCl溶液处理1~2cm梭梭幼苗能降低其耐干旱能力,但与用去离子水处理的干旱7,14,21和28d的成活率均不存在显著性差异;但是用去离子水处理的囊果碱蓬幼苗干旱7和14d后的存活率与用300mmol/L NaCl溶液处理的均存在显著性差异;而所有干旱21和28d的1~2cm囊果碱蓬幼苗都死亡。说明300mmol/L NaCl降低了梭梭和囊果碱蓬的耐干旱能力。
2.2 干旱复水后幼苗的伸长速率的差异
图1表明,3种植物在干旱7,14,21,28d后,幼苗干旱复水后的幼苗伸长速率总体趋势是均随着干旱时间的延长而减小。对白梭梭而言,干旱21d后幼苗经复水,其伸长速率显著性降低;而对梭梭而言,干旱28d后幼苗经过复水,其伸长速率有显著性降低;而囊果碱蓬来说,干旱14d后,幼苗经复水,其伸长速率有显著性降低。说明三者对干旱胁迫后,遇到适宜的环境后,对环境的敏感程度是不同的(图2)。

图1 长度为1~2cm的白梭梭、梭梭和囊果碱蓬幼苗干旱7,14,21和28d复水后的伸长速率Fig.1 Seedling elongation of 1-2cm H.persicum,H.ammodendronand S.physophoraseedlings after 7,14,21and 28days desiccation

图2 长度为1~2cm白梭梭(a)、梭梭(b)和囊果碱蓬(c)幼苗干旱28d复水后生长情况Fig.2 Rehydration of 1-2cm H.persicum (a),H.ammodendron(b)and S.physophora(c)seedlings after 28days desiccation
2.3 脱水和复水过程中幼苗的水分含量变化
图3表明,长度为1~2cm的白梭梭、梭梭和囊果碱蓬幼苗干旱处理时,开始2h内含水量下降速率最快,此后趋缓,干旱24h后趋于稳定。在干旱的前12h内,1~2cm囊果碱蓬幼苗在300 mmol/L NaCl溶液处理后,含水量的下降速度小于用去离子水处理的;但是1~2cm梭梭在经过300mmol/L NaCl溶液处理后,其含水量的下降速度与用去离子水处理时基本一致。
复水过程中,白梭梭、梭梭和囊果碱蓬幼苗的相对质量在前24h内增加最快,此后白梭梭和梭梭幼苗的相对质量增加速度趋缓。复水72h后,白梭梭和梭梭经4个不同干旱时间处理,复水后的相对质量中均是CK白梭梭的相对质量最大,CK梭梭的相对质量次之,300mmol/L NaCl溶液处理的相对质量最小。而复水24h后囊果碱蓬的相对质量开始下降,这体现了幼苗死亡后开始被降解,也从侧面反映出复水后囊果碱蓬幼苗的存活状况。
2.4 希夫试剂和Evan’s blue试剂染色
图4结果表明,用去离子水培养的长度为1~2cm的白梭梭幼苗干旱28d后复水3d,根表皮部分细胞死亡(图4b),但受伤的细胞比较少(图4a),这是由于修复机制在发挥作用,把干旱和复水造成的损伤进行修复;用去离子水培养的长度为1~2cm的梭梭幼苗干旱28d后复水3d(图4c,d),其死亡的和损伤的细胞数量明显多于白梭梭,但少于用300mmol/L NaCl溶液培养的长度为1~2cm的梭梭幼苗(图4e,f),用300mmol/L NaCl溶液培养的长度为1~2cm的梭梭幼苗在300mmol/L NaCl溶液中复水后根尖明显发生弯曲,说明盐害比较严重;用去离子水(图4g,h)和300mmol/L NaCl溶液(图4i,j)培养的长度为1~2cm的囊果碱蓬幼苗干旱28d后均死亡,用希夫试剂和Evan’s blue试剂染色后,均为黑色,说明复水时囊果碱蓬幼苗没有成活,由于死亡时间长,植物细胞内与染色试剂发生反应的化学物质被降解,不与染色剂发生反应而被染色。3种植物干旱复水后根部细胞的受损和死亡情况表明,这3种植物中白梭梭的耐干旱能力最强,梭梭次之,囊果碱蓬的耐干旱能力最弱。

图3 长度为1~2cm白梭梭、梭梭和囊果碱蓬幼苗干旱7(a),14(b),21(c)和28(d)d复水3d相对质量变化Fig.3 Relative weight of 1-2cm H.persicum,H.ammodendronand S.physophoraseedlings with 7(a),14(b),21(c)and 28(d)days of desiccation and 3days of rehydration

图4 白梭梭、梭梭和囊果碱蓬幼苗不同处理干旱28d复水后希夫试剂和Evan’s blue试剂染色Fig.4 The coloration of H.persicum,H.ammodendron and S.physophoraseedlings with 28days desiccation and 3days rehydration
2.5 干旱处理对幼苗子叶叶绿素含量影响
表2结果表明,白梭梭、梭梭和囊果碱蓬幼苗在黑暗和光照状态下干旱处理后,叶绿素含量均与对照没有显著性差异,因此3种植物均属于“同型叶绿素型回生植物”,白梭梭、梭梭和囊果碱蓬可能具有较强的抗氧化系统,能清除在光照下干旱由光合系统产生的自由基,进而减少自由基对植物组织产生的危害,而不是通过降解叶绿体,阻止自由基的产生来防止光对植物干旱时产生的危害。
用去离子水或300mmol/L NaCl溶液处理梭梭和囊果碱蓬时,两种处理的梭梭幼苗,鲜样之间、黑暗下干旱后以及光照下干旱后,其幼苗叶绿素含量均不存在显著性差异;而囊果碱蓬幼苗的鲜样之间、黑暗下干旱后幼苗之间和光照下干旱后幼苗之间的叶绿素含量均存在显著性差异。这说明梭梭耐盐胁迫的能力大于囊果碱蓬耐盐胁迫的能力。

表2 白梭梭、梭梭和囊果碱蓬幼苗不同处理后的叶绿素含量Table 2 Chlorophyll content of H.persicum,H.ammodendron and S.physophoraseedlings mg/g
3 讨论与结论
盐生植物种子萌发对环境的适应对策研究的比较多,主要包括种子萌发时较高的耐盐性、种子休眠、种子具有多态性、丰富的种子库、特异的萌发时空特性、较好的繁殖策略[11-12]。降雨引发植物种子瞬时萌发,但随后在一段时间内也会遭受干旱、盐渍等多重胁迫。许多旱生植物幼苗具有耐干旱脱水的能力,当干旱的幼苗在复水时,它们又能长出新根和新叶,发育成正常的植株[13]。因此幼苗的耐干旱脱水特性具有重要的生态学意义。
不同植物的幼苗在不同的发育阶段对脱水的忍耐力可能有差异[14]。研究发现,幼苗干旱时间越长,重新水合后幼苗的恢复率就越低。在0~28d内,梭梭和囊果碱蓬随着干旱时间的延长而幼苗的恢复率显著降低,这与前人的研究结果一致[5];但白梭梭幼苗干旱7,14,21和28d后的存活率之间没有显著性差异,说明白梭梭耐干旱能力比较强。植物能够忍耐一定程度的干旱脱水,重新复水之后又能恢复生长,但幼苗生长到一定阶段之后,干旱脱水会造成幼苗永久死亡,二者之间的临界点即为耐脱水极限点[15],研究发现,根长为1~2cm的囊果碱蓬幼苗在耐干旱过程中,耐脱水极限点为21d;而根长为1~2cm的白梭梭和梭梭幼苗在干旱28d后依然具有存活的幼苗。因此,为了确定这两种植物在干旱时间方面的耐脱水极限点,干旱时间需要进一步延长。
通过希夫试剂和Evan’s blue试剂染色研究发现,白梭梭的耐干旱能力比较强,干旱28d后复水,根部的死亡细胞和受损伤细胞较少,而梭梭根部的死亡细胞和受损伤细胞明显比白梭梭多;300mmol/L NaCl溶液会使梭梭的根尖发生弯曲,根尖大部分死亡,受伤细胞也较多;干旱28d后囊果碱蓬幼苗全部死亡并发生降解。Sgherri等[7]认为,由于氧化胁迫,干旱和复水过程都会对幼苗产生损伤,而在复水过程中产生的损伤比其在干旱过程更严重。因此,这3种植物所受到的损伤是在干旱过程中还是复水过程中,或者两者皆有,需要进一步研究。
干旱胁迫引起新陈代谢的中断会引起许多问题,其中最大的问题是氧化胁迫[16]。当干旱发生在光照下,叶绿素中的激发能转移到氧元素上,生成大量的单线态氧,如果这些能量不能通过光合途径来释放并产生O2,则会诱导自由基的产生,生成一系列活性氧簇(ROS)[17]。这一系列活性氧簇,尤其是超氧化物和羟基自由基会对细胞的主要成分造成伤害[18]。植物克服干旱胁迫主要进化为3种机制,第一种机制是减少自由基的产生。在干旱胁迫下,一些回生植物会自动降解掉其叶绿素,所以被称为“异型叶绿素型”回生植物[19]。第二种机制是植物受到干旱胁迫后,可以维持其叶绿素,因此,需要具有比“异型叶绿素型”回生植物更好的抗氧化机制[19],被称之为“同型叶绿素型”回生植物。另外还有一种居于前两者之间的机制,此种植物干旱后会保留其绝大部分叶绿素,属于“半同型叶绿素型”[20]。本研究发现,白梭梭、梭梭和囊果碱蓬同属“同型叶绿素型回生植物”,在干旱胁迫下,这些植物会在形态和生理上做出响应,不是通过降解叶绿体来阻止自由基的产生,以防止光对植物干旱时产生的危害,这3种植物可能具有很强的抗氧化系统来适应干旱胁迫环境。
[1]Xi J B,Zhang F S,Mao D R,et al.Saline-soil distribution and halophyte resources in Xinjiang.Chinese Journal of Soil Science,2005,3:209-303.
[2]Zhang K,Tian C Y,Li C J.Review of progress of studies on salt-tolerance mechanisms of annual halophytes.Chinese Journal of Plant Ecology,2009,6:1220-1231.
[3]Huang Z Y,Dong M,Zhang S M.Strategies of seed germination on sand dune and seedling desiccation tolerance of Psammochloa villosa (Poaceae).Acta Ecologica Sinica,2004,25(2):298-303.
[4]Netting A G.pH,abscisic acid and the integration of metabolism in plants under stressed and non-stressed conditions:cellular responses to stress and their implication for water relations.Australian Journal of Plant Physiology,2000,51(343):147-158.
[5]Zhu Y J,Dong M,Huang Z Y.Adaptation strategies of seed germination and seedling growth to sand dune environment.Chinese Journal of Plant Ecology,2006,17(1):137-142.
[6]Zhang S R,Song J,Wang H,et al.Effect of salinity on photosynthesis and chloroplasts ultrastructure in cotyledons of desiccated seeds of halophytes or xerophyte growing in central Asia.Journal of Plant Ecology,2010,3:259-267.
[7]Sgherri C L M,Loggini B,Puliga S,et al.Antioxidant system in Sporobolus stapfianus-changes in response to desiccation and rehydration.Phytochemistry,1994,35:561-565.
[8]Song J,Feng G,Tian C,et al.Osmotic adjustment traits of Suaeda physophora,Haloxylon ammodendron and Haloxylon persicum:A comparison of short-term stress experiment to field condition.Plant Science,2006,170:113-119.
[9]Li Y,Zhang S R,Song J,et al.Chorophyll in desiccated seeds of a euhalophyte,Suaeda Physophora,and its significancy in plant adaptation to salinity during germination.Science in China Series C:Life Sciences,2008,51(5):410-417.
[10]Li H S.Principle and Technology of Plant Physiological and Biochemical Experiment[M].Beijing:Higher Education Press,2000:133-137.
[11]Song Y G,Li L,Zeng X H,et al.Responses of the germination on dimorphic seeds of Suaeda aralocspica to salt stress.Acta Prataculturae Sinica,2014,23(1):192-198.
[12]Qu X X,Huang Z Y.The adaptive strategies of halophyte seed germination.Acta Ecologica Sinica,2005,25(9):2389-2398.
[13]Wu W H.Plant Physiology[M].Beijing:Science Press,2003:445-446.
[14]Zeng Y J,Wang Y R,Sa R,et al.Response of seed germination of three xeromorphic shrubs to drought stress.Chinese Journal of Applied Ecology,2002,13(8):953-956.
[15]Evenari M,Shanan L,Tadmor N.The Negev,the Challenge of a Desert(2nd edition)[M].Cambridge:Harvard University Press,1982.
[16]VicréM,Farrant J M,Driouich A.Insights into the cellular mechanisms of desiccation tolerance among angiosperm resurrection plant species.Plant,Cell and Environment,2004,27:1329-1340.
[17]Smirnoff N.The role of active oxygen in the response of plants to water deficit and desiccation.New Phytologist,1993,125:27-58.
[18]Mundree S G,Baker B,Mowla S,et al.Physiological and molecular insights into drought tolerance.African Journal of Biotechnology,2002,1:28-38.
[19]Oliver M J,Tuba Z,Mishler B D.The evolution of vegetative desiccation tolerance in land plants.Plant Ecology,2000,151:85-100.
[20]Kranner I,Beckett R P,Wornik S,et al.Revival of a resurrection plant correlates with its antioxidant status.Plant Journal,2002,31:13-24.
参考文献:
[1]郗金标,张福锁,毛达如,等.新疆盐渍土分布与盐生植物资源.土壤通报,2005,3:209-303.
[2]张科,田长彦,李春俭.一年生盐生植物耐盐机制研究进展.植物生态学报,2009,6:1220-1231.
[3]黄振英,董鸣,张淑敏.沙鞭(禾本科)种子在沙丘上的萌发策略及幼苗的耐干燥特性.生态学报,2004,25(2):298-303.
[5]朱雅娟,董鸣,黄振英.种子萌发和幼苗生长对沙丘环境的适应机制.植物生态学报,2006,17(1):137-142.
[10]李合生.植物生理生化试验原理和技术[M].北京:高等教育出版社,2000:133-137.
[11]宋以刚,李利,曾歆花,等.异子蓬二型性种子萌发对盐胁迫的响应.草业学报,2014,23(1):192-198.
[12]渠晓霞,黄振英.盐生植物种子萌发对环境的适应对策.生态学报,2005,25(9):2389-2398.
[13]武维华.植物生理学[M].北京:科学出版社,2003:445-446.
[14]曾彦军,王彦荣,萨仁,等.几种旱生灌木种子萌发对干旱胁迫的响应.应用生态学报,2002,13(8):953-956.

