玛曲沙化高寒草甸植被、土壤理化性质及土壤微生物数量研究
金红喜,何芳兰,李昌龙,韩生慧,王强强*
(1.甘肃民勤荒漠草地生态系统国家野外科学观测研究站,甘肃 民勤733300;2.甘肃河西走廊森林生态系统国家定位观测研究站,甘肃 武威733000;3.甘肃省治沙研究所,甘肃 兰州730070;4.兰州大学草地农业科技学院,甘肃 兰州730020)
土壤微生物是影响土壤生态过程的一个重要因素,土壤微生物在土壤形成、生态系统的生物地球化学循环、污染物质的降解等方面都具有重要价值[1-2],对环境起着天然的“过滤”和“净化”作用[3-4],对自然生态系统的稳定性发挥着重要的作用。由于土壤中微生物个体微小,数量多,土壤微生物分离和鉴定困难,土壤环境条件复杂等原因,迄今为止仅1%~10%的土壤微生物被分离和鉴定[5],因此限制了人们对土壤微生物在陆地生态系统中重要作用的认识。直到近年来随着微生物分离、鉴定技术的发展[3],生态学家们才开始着手研究地下微生物与地上植物群落及生态系统过程的相互反馈。
玛曲县位于甘肃省西南部,是青藏高原的重要组成部分和黄河的主要水源涵养区,高寒草甸是其最主要的自然资源和牧民赖以生存的重要物质基础[6]。近年来,在人为干扰和自然因素的共同影响下,黄河首曲高寒草甸的生态环境呈恶化趋势,沙物质暴露,草甸沙化显著,在黄河沿岸已形成约220km的沙丘带,全县沙化草甸面积已达100814hm2[7],致使整个区域草场载畜量和草地植被涵养水源功能大为降低,严重制约着该区畜牧业的可持续发展。目前围绕玛曲高寒草甸的沙化机理、治理模式、植被特征等方面已经开展了大量研究[8-10],但是,针对玛曲高寒草甸沙化过程中土壤微生物及其对地上植被变化的响应或反馈尚未见报道。荒漠化过程既影响地上植物、地下微生物群落和生态系统功能,又对地上植物-地下微生物互馈关系有重大影响。因此,分析研究玛曲高寒草甸不同沙化程度的地上植物群落与土壤微生物,探讨高寒草甸沙化与植物群落特征、土壤微生物的动态关系,对高寒草甸沙化生态系统生态恢复具有重要的理论和实践意义。
1 材料与方法
1.1 研究区概况
调查样地位于甘肃省玛曲县欧拉乡和河曲马场境内(102°3′24″-102°10′4″E;33°55′1″-33°57′48″N),海拔3430~3442m。冬春季漫长,严寒多风;夏秋季短,多雨潮湿。年均气温1.2℃,年均降水量615mm,年均蒸发量1352.4mm,年均风速2.5m/s,最大风速36m/s,全年平均8级以上的大风日数77d,最多日数达121d,每年12月至翌年5月为大风季节。土壤类型为草甸土,地表部分或全部被沙土覆盖,植物稀疏,植物种类主要以高山嵩草(Kobresia pygmaea)、青藏苔草(Carex moorcroftii)、垂穗披碱草(Elymus nutans)、藏虫实(Corispermum tibeticum)、裂叶独活(Heracleum millefolium)以及毛穗赖草(Leymus paboanus)等草本植物为主。
1.2 研究方法
1.2.1 沙化等级划分和样地调查 2012年,在玛曲欧拉乡和河曲马场高寒草甸选择典型样地4个,根据魏兴琥等[11]对藏北高寒沙化草甸的划分等级将其分为未沙化、轻度沙化、中度沙化和重度沙化4个等级(表1)。在每个样地设置3个30m×30m的大样方,在每个大样方内根据五点法设置5个1m×1m小样方,总计60个小样方。
1.2.2 植物群落特征测度方法 在2013年8月下旬植物生长季节临近结束,地上生物量达到最高值时,对选择的全部样方内植物群落进行了调查,调查参数包括样方内所有物种名称、种数、各个物种的盖度、多度。完成以上工作后,齐地面刈割地上部分,65℃烘箱干燥72h后测定地上生物量。刈割后,每个样方用根钻(6cm)在样方内5点法取土混合,取样深度0~40cm,然后用清水冲洗,分离出来的根系在65℃烘箱干燥72h后测定地下生物量。
1)群落物种丰富度:丰富度(R)用群落物种数表示。

式中,ni是第i种的个体数,N是所有种个体数的总和,S为种的总数。

表1 玛曲高寒草甸沙化程度分级表Table 1 Classification of desertification degree and corresponding features in Maqu alpine meadow
1.2.3 土样采集 完成以上测量后,在每个样方内除去地面的枯枝落叶及砾石等杂质,挖0~40cm深的一个坡面,分别按0~20,20~40cm分两层(深层、浅层)自下而上取约300g鲜土后,立即装入无菌袋中,置于便携式小冰箱内;此外,用铝盒在每个坡面上0~40cm之间取样,用便携式电子秤立即称重,用于测定土壤含水率。
1.2.4 土壤有机碳、全氮、速效磷以及土壤含水率、pH测定 土壤有机碳采用重铬酸钾氧化法,全氮用半微量凯氏法,速效磷用碳酸氢钠浸提-钼锑抗比色法,土壤含水率用烘干法测定,土壤pH用无二氧化碳蒸馏水(水土比5∶1)浸提后pH计测定[12],测定结果均以干重计。
1.2.5 土壤微生物数量测定 真菌数量测定:采用马丁-孟加拉红培养基,以平板表面涂抹法计数[13];放线菌数量测定:采用改良高氏一号培养基[14],以平板表面涂抹法计数;细菌数量测定:采用牛肉膏蛋白胨琼脂培养基,以平板表面涂抹法计数[14];好气性自生固氮菌:采用阿须贝(Ashby)培养基,平板表面涂抹法计数[13]。
1.3 数据分析
采用Excel和SPSS 17.00软件进行数据统计、分析及处理。
2 结果与分析
2.1 沙化过程中地上植物多样性和生物量的变化
沙化对地上植物多样性及地上/地下生物量产生了较大的影响,除Pielou均匀度指数外,其他指标各水平间存在显著差异(P<0.05)(表2)。其中,植物的丰富度指数和Shannon-Wiener指数值在未沙化的样地中最高,分别是26.13和2.21;随沙化程度的加重,两者都呈现下降趋势,在重度沙化样地中降到最低,分别是2.88和0.80。而群落优势度则逐渐增加,在重度沙化高寒草甸优势度指数达到最大值。而均匀度指数则表现为在轻度沙化样地中出现了略微增加。地上、地下植物的生物量和多样性指数的趋势一样,均在未沙化的样地中最高;随着沙化程度的加重,呈现下降趋势,在重度沙化样地中降到最低。从未沙化到轻度沙化过程,地下生物量相对减少了75.08%;在轻度沙化的样地中,地上/地下生物量比值最大为0.50,其次是中度沙化和重度沙化样地,比值分别为0.42和0.41,而在未沙化的样地中地上/地下生物量比值仅有0.20。

表2 不同沙化程度玛曲高寒草甸的植物群落特征Table 2 The change of plant diversity indexes in the desertification process of Maqu alpine meadow
2.2 沙化过程中土壤含水量、pH以及土壤有机质、全氮、速效磷的变化
从典型的高寒草甸退化到轻度沙化草地、中度沙化草地、重度沙化草地的过程中,高寒草甸的浅层土壤(0~20cm)有机质、全氮、速效磷表现出相类似的趋势,从未沙化到轻度沙化,再到中度沙化都呈现显著下降,而中度沙化和重度沙化的差异不显著。深层土壤(20~40cm)有机质、全氮、速效磷含量都是在轻度沙化达到最高值,其次为未沙化样地,中度沙化和重度沙化样地中的土壤有机质、全氮含量差异不显著,重度沙化的土壤速效磷含量比中度沙化增高34.1%。土壤含水量呈单调减少趋势,依次相对减少71.23%,32.59%,7%(表3);pH值则呈现增加趋势,从未沙化到轻度沙化相对增加4.76%,但轻度沙化、中度沙化、重度沙化样地内的pH值没有产生显著差异。

表3 不同沙化程度玛曲高寒草甸的土壤理化性质特征Table 3 The change of soil properties in the desertification process of Maqu alpine meadow
2.3 沙化过程中土壤微生物数量的变化
从图1可以看出,高寒草甸沙化过程中土壤微生物(微生物总量、细菌、真菌、放线菌和固氮菌)数量发生显著变化(P<0.05)。随沙化程度的加剧,4种微生物数量变化呈现单峰趋势,细菌数量、真菌数量、放线菌数量及微生物总量在轻度沙化阶段出现最大值;固氮菌在中度沙化阶段出现了最大值。不同沙化阶段4种微生物数量及总量大小分别为:轻度沙化>中度沙化>未沙化>重度沙化(细菌数量、真菌数量、放线菌数量及微生物总量);中度沙化>轻度沙化>未沙化>重度沙化(固氮菌数量)。
为了进一步了解高寒草甸沙化过程土壤微生物菌群组成的动态变化,对细菌、真菌、放线菌以及固氮菌数量百分比进行了分析(表4),发现随着沙化程度的不断加剧,4种微生物数量百分比均产生了显著变化(P<0.05)。其中,细菌的数量百分比呈现出减小-增大-减小的趋势,其中中度沙化阶段百分比值最大(89.69%);真菌的数量百分比是先增大后减小,其中轻度沙化阶段的值最大(0.26%);放线菌数量百分比是增大-减小-增大,其中轻度沙化阶段的值最大(16.87%);固氮菌数量百分比呈现出减小-增大-减小的趋势,其中中度沙化阶段的值最大(3.24%)。此外,在整个沙化演替过程中,土壤细菌一直在整个菌群体系中占据主要位置,其数量百分比占80%以上,之后依次为放线菌、固氮菌、真菌。
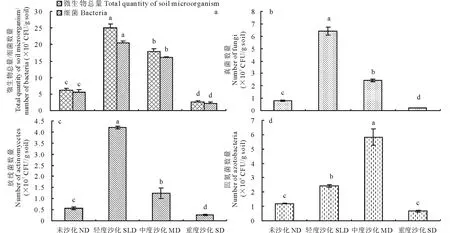
图1 不同沙化程度玛曲高寒草甸的土壤微生物数量变化Fig.1 The change of soil microorganism in the desertification process of Maqu alpine meadow
2.4 沙化过程中植被、土壤微生物数量特征与土壤理化性质的关系
在自然状态下,植物群落的丰富度和生物量不仅取决于群落的结构特征和功能,它还反映群落在演替过程中土壤特征和土壤资源的持续供给能力,以及土壤微生物的功能。因此,分析群落生物量、物种丰富度与土壤微生物数量之间的相关关系,阐明植被变化和土壤微生物互馈关系演化的内在联系具有重要意义。为了使两变量间的相关关系得到真实的反映,本研究采用偏相关分析,分别探讨不同沙化程度条件下地上生物量、地下生物量、丰富度指数与地下微生物总量、细菌、真菌、放线菌和固氮菌的相关关系。
通过相关性分析(表5)可以发现,土壤因子浅层(0~20cm)速效磷含量与浅层有机质含量、浅层全氮含量、深层(20~40cm)速效磷含量、土壤含水量等土壤因子呈极显著正相关关系,与深层全氮含量呈显著相关关系;而深层速效磷含量与浅层速效磷含量、深层有机质、全氮、土壤含水量呈极显著正相关关系,与浅层有机质、pH值呈显著相关关系。而其他因子之间的相关关系都较低,不能完全代表土壤因子的变化,因此,在下面对植被特征值与土壤微生物数量值的偏相关关系分析中,选择深层速效磷含量作为控制变量开展研究。
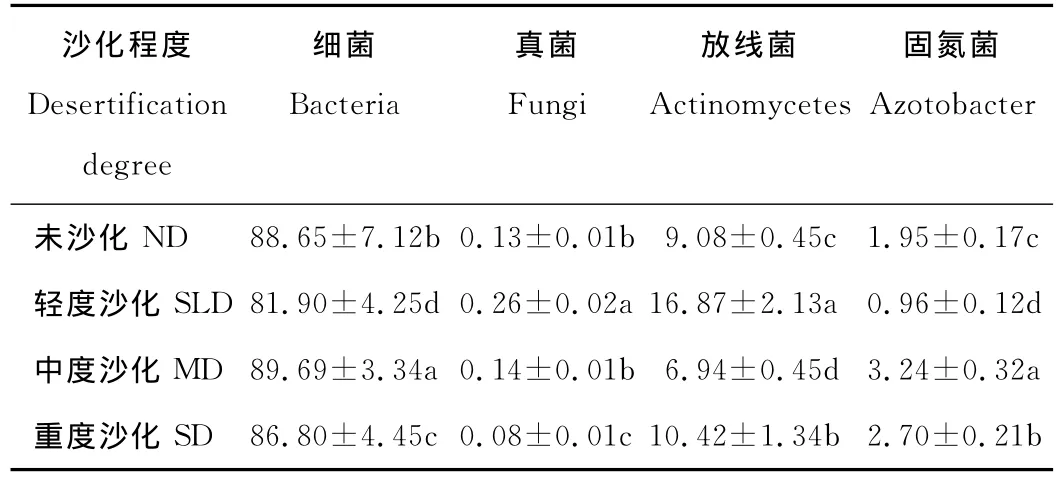
表4 玛曲高寒草甸沙化过程中土壤微生物数量百分比组成Table 4 The ratio of soil microorganism quantity in the desertification process of Maqu alpine meadow %

表5 土壤因子的相关系数矩阵Table 5 Correlation matrix of the soil factor
从表6相关关系和偏相关关系的比较发现,在加入土壤深层速效磷含量作为控制因子后,植被特征值与土壤微生物数量之间的相关性都出现了不同程度的变化。细菌与植被特征值之间的相关关系都从显著相关或无相关变为极显著相关关系,与植物丰富度指数、地上生物量、地下生物量、地上/地下生物量之比的相关关系分别由-0.649,-0.698,-0.585,0.438上涨为-0.973,-0.973,-0.921,0.759。真菌和放线菌与植物丰富度、地上生物量之间的相关关系由极显著相关关系或显著相关关系变为无显著相关关系;而与地下生物量和地上/地下生物量之比的相关关系则分别由-0.527,-0.549,0.327,0.305变化为-0.605,-0.427,0.686,0.568。固氮菌与植被特征值之间的相关关系都出现不同程度的下降,与植物丰富度指数、地上生物量、地下生物量、地上/地下生物量之比的相关关系分别由-0.886,-0.924,-0.775,0.218下降为-0.656,-0.685,-0.473,0.216。除地上/地下生物量之比与土壤微生物数量之间呈正相关关系外,其余植被特征值与土壤微生物数量之间都呈现负相关关系。

表6 植被特征与土壤微生物的相关系数和偏相关系数Table 6 Correlation coefficient and partial correlation between the plant properties and soil microorganism
3 讨论
在关注沙化对高寒草甸产生的影响时,人们往往首先考虑植被盖度和载畜量的变化[15],以及由此引起的水土流失加剧,水源涵养功能衰退[9]等方面,很少有人关注沙化对高寒草甸土壤理化性质的影响[8],更勿论对土壤微生物的影响。本研究表明沙化对高寒草甸的影响是多方面的,不仅表现为极大的降低了地上植物群落的丰富度、多样性和生物量,改变了植物群落的优势度等,而且还表现在对土壤理化性质及土壤微生物数量、结构也产生了显著影响。
魏婷婷等[16]在青海共和盆地的研究表明,随着高寒草甸沙化,地上植物多样性呈现出单峰变化趋势,地上、地下生物量在轻度退化草甸最大,中度沙化草甸最小。而本研究结果表明无论植物多样性,还是植物生物量都呈现出单调递减的趋势。这主要是因为两者划分沙化程度的标准不同,魏婷婷等在研究共和盆地高寒草甸沙化时,在轻度沙化和中度沙化之间加入了轻度退化和中度退化,研究梯度跨度较小,植物受到的外界影响小,植物多样性可能在退化初期由于“中度干扰假说”出现上升。而本研究侧重点在高寒草甸沙化,涉及的沙化梯度跨度大,高寒草甸在发生沙化时,植物受到的外界影响大,因而多样性呈现单调递减变化。而两地的浅层土壤理化性质随沙化的表现较一致,都是在未沙化草甸中土壤有机质、全氮含量最高,在重度沙化草甸中含量最低。表明相对于地上植被,土壤的理化性质比较稳定,受到沙化影响后,其变化有滞后现象。
沙化对地上植物多样性、优势度和生物量的影响在更深层的意义上是造成植物群落组成结构的变化。原来在群落中占据优势地位的高山嵩草、高山早熟禾(Poa alpine)、青藏苔草、鹅绒委陵菜(Potentilla anserina)、钉柱委陵菜(P.saundersiana)等物种退出群落或重要值逐渐减小,种群发育变化受到草甸沙化的严重影响;而藏虫实、裂叶独活、镰荚棘豆(Oxytropis falcata)、微孔草(Microula sikkimensis)等种群逐渐侵入群落,成为重度沙化草甸的优势种群[17]。这些随沙化程度加重而变化的群落物种构成是引起了玛曲高寒草甸群落丰富度、多样性、优势度和生物量减少的深层原因。
董玉祥[15]和彭岳林等[18]对藏北退化高寒草原土壤微生物数量的研究表明,轻度退化草地土壤细菌、放线菌、真菌数量均有不同程度的提高;而中度退化和严重退化导致土壤细菌和真菌数量显著下降,放线菌数量却显著升高,这与本研究在玛曲不同沙化程度高寒草甸上获得的结果相近。玛曲高寒草甸土壤微生物数量的变化主要受到因沙化引起的土壤孔隙度、含水量的改变。在未沙化样地内,植被生长良好、土壤含水率高、土壤粘粒含量高,致使土壤含水量大多呈饱和状态,土壤中过多的水分影响到土壤中的含氧量,最终导致未沙化土壤中微生物数量小于轻度沙化样地土壤微生物数量。而由轻度沙化演替到中度或重度沙化时,土壤微生物数量的下降可能是受土壤理化性质和植被双重影响而逐渐减小。
人们很早就注意到土壤微生物对地上植物的正作用,固氮菌把大气中植物难以利用的氮转化为铵态氮,从而植物可以吸收这些氮素,转化为植物的生产力;尤其在那些土壤中氮比较贫瘠的地区(氮磷钾是植物生产力的主要限制因子),土壤中的固氮菌对群落的生产力具有显著的影响[19]。土壤微生物对植物生产力的正作用也有可能是因为降低了植物病虫害的缘故[20],亦或是菌根真菌改善了植物对其他限制性营养元素(除氮以外)的吸收率[19]。更多的研究表明,土壤细菌对地上植物群落动态、多样性、丰度,甚至在有些情况下对植物入侵有重要作用[21]。
虽然在多数受控实验中,地上植物多样性和地下微生物数量之间呈现正相关性[22-23],而我们研究的自然生态系统却显示,地上植物多样性和地下微生物数量之间表现为负相关性,地上/地下生物量比和地下微生物数量之间则表现为正相关性,这与 Hiiesalu等[24]在北美大草原(the North American Great Plains)的野外调查结果一致。有一些证据表明,土壤微生物和地上植被特征之间虽然会表现一定的相关性,但是这种关系在自然生态系统中很难预测。
同时,也有实验证明,增施氮肥和磷肥会降低玛曲高寒草甸土壤中的微生物数量,改变土壤微生物结构[25]。因此,要检验地上植物与地下土壤微生物之间的关系,就要考虑排除土壤因子对这两者关系的干扰,通过对土壤理化性质与土壤微生物关系的分析,我们认为土壤速效磷的变化对玛曲高寒草甸土壤理化性质起到至关重要的作用,这一观点也得到在同一区域开展的受控实验支持[26]。因此在分析玛曲高寒草甸地上植物与地下土壤微生物之间的相关性时,我们选择土壤深层速效磷作为控制因子。
在加入土壤深层速效磷含量作为控制因子后,地上植被特征值与土壤微生物数量之间的相关关系都发生了改变。土壤微生物总量以及土壤细菌与地上植物的丰富度、地上生物量、地下生物量都呈现极显著负相关关系,而与地上/地下生物量比呈极显著正相关关系。这说明在玛曲高寒草甸中,地上植被的变化与土壤微生物数量及土壤微生物的主要组分―细菌的变化有显著的相关关系,而在地上植被与土壤微生物的这种关系中,土壤理化性质起到相当重要的桥梁作用。
通过研究放射性磷(P)在微生物和植物根系中的分配,Smith等[27]证实了土壤微生物数量增大后,增加了土壤微生物对土壤磷的吸收消耗,使植物根系得不到充足的磷供应,最终导致了地上植物生物量的降低。在本实验中,土壤营养物质随沙化的大量流失,直接导致了地上植物多样性和生物量的降低[16]。而同时,沙化程度加剧后,土壤的孔隙度和含氧量相应提高,这有利于土壤微生物繁殖和活动[18],土壤微生物数量增大和活性提高后,消耗了本来土壤中不多的营养物质,相应减少了地上植被可以利用的营养物质,也会导致地上植物生物量降低。两者叠加后,最终导致地上植物多样性和生物量与土壤微生物数量之间呈现负相关性。总之,高寒草甸地上植物与土壤微生物之间的关系我们还不够清楚,在将来还需要更进一步的实验研究来证实。
[1]van der Putten W H,Bardgett R D,Bever J D,et al.Plant-soil feedbacks:the past,the present and future challenges.Journal of Ecology,2013,101(2):265-276.
[2]Bardgett R D,van der Putten W H.Belowground biodiversity and ecosystem functioning.Nature,2014,515(7528):505-511.
[3]Brussaard L.Biodiversity and ecosystem functioning in soil.Ambio,1997,26(8):563-570.
[4]Wardle D A.Communities and Ecosystems:Linking the Aboveground and Bbelowground Components[M].New Jersey:Princeton University Press,2002.
[5]Liu G H,Ye Z F,Wu W Z.Culture-dependent and culture-independent approaches to studying soil microbial diversity.Acta Ecologica Sinica,2012,32(14):4421-4433.
[6]Du G Z,Li Z Z,Hui C.Protection of alpine meadow resources in Gannan and the research of its optimal utility pattern.Journal of Lanzhou University,2001,37(5):82-87.
[7]Dong Z B,Hu G Y,Yan C,et al.Aeolian desertification and its causes in the Zoige Plateau of China’s Qinghai-Tibetan Plateau.Environmental Earth Sciences,2010,59(8):1731-1740.
[8]Wang H,Ren J Z,Yuan H B.A study on the changes of soil physical properties in the desertification process of source regions of the Yellow River using Maqu as an example.Acta Prataculturae Sinica,2007,16(1):30-33.
[9]Lu J F,Dong Z B,Hu G Y,et al.Aeolian desertification development and its causes in Maqu County of Gansu Province,China.Journal of Desert Research,2012,32(3):604-609.
[10]Chen W Y,Zhang J,Qi D C,et al.Desertification dynamic change trend and quantitative analysis of driving factors of alpine meadow in Maqu County in the First Meander of the Yellow River.Acta Prataculturae Sinica,2015,22(3):11-21.
[11]Wei X H,Li S,Yang P,et al.Changes of vegetation and diversity of Alpine Kobresia(Kobresia pygmaea)Steppe Meadow in desertification process in northern Tibet Plateau.Journal of Desert Research,2007,27(5):750-757.
[12]Bao S D.Agricultural Soil Analysis[M].Beijing:Chinese Agricultural Press,1981.
[13]Xu G H,Zheng H Y.Manual of Soil Microbial Analysis Method[M].Beijing:Agricultural Press,1986.
[14]Yao H Y,Huang C Y.Soil Microbial Ecology and Experimental Technology[M].Beijing:Science Press,2006:55-93.
[15]Dong Y X.Driving mechanism and status of sandy desertification in the northern Tibet Plateau.Journal of Mountain Science,2001,19(5):385-391.
[16]Wei T T,Yang Z W,Li X M,et al.Changes of plant community features during sandy desertification process in Gonghe basin of Qinghai.Ecology and Environmental Sciences,2011,20(12):1788-1793.
[17]Li C L,Xu X Y,Jin H X,et al.Community structures and plant diversities in the desertification process of Maqu Alpine Meadow in Gansu.Acta Ecologica Sinica,2014,34(14):3953-3961.
[18]Peng Y L,Cai X B,Xue H Y,et al.Study on the variation characteristics of soil microbial biomass in the degraded alpine steppes.Acta Agriculturae Boreali-Occidentalis Sinica,2007,16(4):112-115.
[19]Spehn E M,Scherer-Lorenzen M,Schmid B,et al.The role of legumes as a component of biodiversity in a cross-European study of grassland biomass nitrogen.Oikos,2002,98(2):205-218.
[20]Schnitzer S A,Klironomos J N,Hillerislambers J,et al.Soil microbes drive the classic plant diversity-productivity pattern.Ecology,2011,92(2):296-303.
[21]van der Heijden M G A,Bardgett R D,van Straalen N M.The unseen majority:soil microbes as drivers of plant diversity and productivity in terrestrial ecosystems.Ecology Letters,2008,11(3):296-310.
[22]Wagg C,Jansa J,Schmid B,et al.Belowground biodiversity effects of plant symbionts support aboveground productivity.E-cology Letters,2011,14:1001-1009.
[23]Koch A M,Antunes P M,Klironomos J N.Diversity effects on productivity are stronger within than between trophic groups in the arbuscular mycorrhizal symbiosis.PLoS ONE,2012,7:e36950.
[24]Hiiesalu I,P-rtel M,Davison J,et al.Species richness of arbuscular mycorrhizal fungi:associations with grassland plant richness and biomass.New Phytologist,2014,203(1):233-244.
[25]Liu Y,Shi G,Mao L,et al.Direct and indirect influences of 8yr of nitrogen and phosphorus fertilization on Glomeromycota in an alpine meadow ecosystem.New Phytologist,2012,194(2):523-535.
[26]Liu Y,Mao L,Li J,et al.Resource availability differentially drives community assemblages of plants and their root-associated arbuscular mycorrhizal fungi.Plant and Soil,2015,386(1-2):341-355.
[27]Smith S E,Jakobsen I,Gronlund M,et al.Roles of arbuscular mycorrhizas in plant phosphorus nutrition:interactions between pathways of phosphorus uptake in arbuscular mycorrhizal roots have important implications for understanding and manipulating plant phosphorus acquisition.Plant Physiology,2011,156:1050-1057.
参考文献:
[5]刘国华,叶正芳,吴为中.土壤微生物群落多样性解析法:从培养到非培养.生态学报,2012,32(14):4421-4433.
[6]杜国祯,李自珍,惠苍.甘南高寒草地资源保护及优化利用模式.兰州大学学报:自然科学版,2001,37(5):82-87.
[8]王辉,任继周,袁宏波.黄河源区高寒草地沙化进程中土壤物理性质的变化 (简报)——以玛曲为例.草业学报,2007,16(1):30-33.
[9]逯军峰,董治宝,胡光印,等.甘肃省玛曲县土地沙漠化发展及其成因分析.中国沙漠,2012,32(3):604-609.
[10]陈文业,张瑾,戚登臣,等.黄河首曲-玛曲县高寒草甸沙化动态演变趋势及其驱动因子定量分析.草业学报,2015,22(3):11-21.
[11]魏兴琥,李森,杨萍,等.藏北高山嵩草草甸植被和多样性在沙漠化过程中的变化.中国沙漠,2007,27(5):750-757.
[12]鲍士旦.土壤农化分析[M].北京:中国农业出版社,1981.
[13]许光辉,郑洪元.土壤微生物分析方法手册[M].北京:农业出版社,1986.
[14]姚槐应,黄昌勇.土壤微生物生态学及其实验技术[M].北京:科学出版社,2006:55-93.
[15]董玉祥.藏北高原土地沙漠化现状及其驱动机制.山地学报,2001,19(5):385-391.
[16]魏婷婷,杨占武,李秀梅,等.共和盆地沙质荒漠化过程植被群落特征变化.生态环境学报,2011,20(12):1788-1793.
[17]李昌龙,徐先英,金红喜,等.玛曲高寒草甸沙化过程中群落结构与植物多样性.生态学报,2014,34(14):3953-3961.
[18]彭岳林,蔡晓布,薛会英,等.退化高寒草原土壤微生物变化特性研究.西北农业学报,2007,16(4):112-115.

