柳枝稷和坚尼草的耐镉性初步研究
刘长浩,娄来清,郭涛,骆天鹏,蔡庆生
(南京农业大学生命科学学院,江苏 南京210095)
镉(Cd)是动植物非必需的重金属元素,它会通过土壤-作物系统被植物吸收并积累,不仅严重影响作物产量和品质,还会通过食物链富集危害人体健康[1]。随着工业化、城市化的进程,Cd污染的土壤越来越多。以我国为例,2014年最新公布的《全国土壤污染状况调查公报》表明,我国耕地土壤环境质量堪忧,耕地点位污染超标率高达19.4%,其中Cd污染最为严重。
柳枝稷(Panicum virgatum)是一种暖季型多年生草本C4植物,自然状况下,多生长于北美地区。它根系发达,对边际土地适应能力强,并且生物量大,纤维素含量丰富,是一种理想的草本能源植物[2-4]。当前对于柳枝稷的研究多集中在种质资源的探索与开发[5-6],品种改良[7],栽培管理技术[8-14],能源转化[15-16],生态与经济效益评估[17],转化工艺[18]等方面,而柳枝稷对于Cd胁迫的响应报道甚少。与柳枝稷同属于黍属的坚尼草(P.maximum)是一种多年生热带牧草,在亚热带、温带地区种植广泛。其根系发达,可种植于梯田边、水渠边或斜坡地,防止水土流失和抑制杂草蔓延[19]。由于坚尼草生物量大,生长速率快,近年被视为具有潜在生物质能源转化价值的能源植物[20]。
本研究试图通过苗期水培试验,分别从形态和生长生理角度,观测坚尼草、柳枝稷的Cd胁迫响应特征,分析柳枝稷的根系形态与Cd吸收积累和转运之间的关系,旨在明确坚尼草和柳枝稷哪种草的耐镉性更强,从而为在Cd污染条件下开发高生物质量能源草提供可靠依据。
1 材料与方法
1.1 试验材料
供试草种柳枝稷和坚尼草种子分别由山东东营职业学院提供和购自雪印种苗公司。重金属Cd以CdCl2的形式添加到营养液中。
1.2 试验设计
选取均匀饱满坚尼草种子浸入0.1%HgCl2溶液中消毒5min,柳枝稷种子于50%的硫酸中浸泡20min,去离子水冲洗干净,然后坚尼草种子浸泡在10%KNO3溶液中12h,柳枝稷种子用70%的乙醇浸泡20min,均用去离子水冲洗干净。最后将种子播于干净的沙床上,置于培养室中萌发,温度为25~30℃,湿度50%~70%,光照为12h[21-22]。待两种草长至1叶1心时,移入装有2L1/4Hoagland营养液的塑料盆(22cm×16cm×7.5 cm)中,适应生长一周后换为1/2Hoagland营养液培养。当两种草长至5叶1心时进行CdCl2处理,对坚尼草和柳枝稷的镉浓度分别设为0(对照),2,5,7.5,10μmol/L和0(对照),0.5,5,10,20,50,100μmol/L。每个处理3次重复,一周更换两次营养液,每天调换两次盆钵的位置降低边缘效应的影响。镉处理两周后取样。将苗分为根和地上部分,分别称取鲜重,之后放入70℃烘箱至恒重,称取干重。本实验从2013年10月至2014年5月在南京农业大学生科院植物环境生理实验室内温室中进行。
1.3 测定方法
1.3.1 根系形态测定 取样时将根和地上部分离,完整的根系立即放入装有去离子水的透明方形盘中,充分分散开,使根系之间无交叉、重叠,用EPSON扫描仪扫描根系,形成电子图像,用 WinRHIZO软件分析根系图片,得到根系形态和根系构型数据。为了更深入的了解镉对柳枝稷根系的影响,将根直径分为5个数量级,间隔为0.5mm。
1.3.2 生物量和Cd含量测定 根系扫描完后,立即将根放入含有20mmol/L EDTA-Na2溶液的烧杯中浸泡15min,除去附在根表面的镉离子。然后用纸吸干水分,称鲜重。所有的植株样品皆放入烘箱中,70℃下烘干至恒重,称干重。将根和地上部分所有植物样品按不同处理组、不同重复组分别放入消煮管中,加入10mL混合酸[HNO3∶HClO4(17∶3,v/v)]冷消煮12h,之后放在消煮炉中消煮,依次在80,100和110℃下各30min,120,140和160℃下各1h,180℃直到完全结晶、消煮完成。消煮后的样品用2.5%的硝酸回溶,定容至10mL。之后用电感耦合等离子体发射光谱仪(ICP-AES)测定植物组织中的Cd含量。按照以下公式分别计算含水量和迁移指数(TFs,由根向地上部分转运的镉比值)[23]:

式中,Cd地上部、Cd根分别为地上部和根的Cd浓度。
1.4 数据分析
用Excel整理原始数据,SPSS 19统计分析数据,同时运用Duncan检验进行单因素方差分析,揭示不同浓度镉处理对植物各项指标的影响。然后用Origin 8.1作图软件进行作图。
2 结果与分析
2.1 Cd对柳枝稷和坚尼草生物量、根冠比和根伸长的影响
Cd对柳枝稷和坚尼草的生长产生了显著影响。由表1可知,与对照相比,除了柳枝稷的根鲜重和根冠比外,其他指标在Cd处理下均显著降低。在0~20μmol/L间的Cd处理下,柳枝稷根的鲜重和总鲜重均维持在一个稳定水平,在Cd浓度为50μmol/L时根的鲜重才显著降低。而坚尼草在Cd浓度为2μmol/L时,根、地上部分和总鲜重就分别下降了86.1%,83.5%和84.1%。相比于对照,Cd处理组中柳枝稷的根冠比显著增加,而坚尼草却有下降的趋势,但差异不显著。
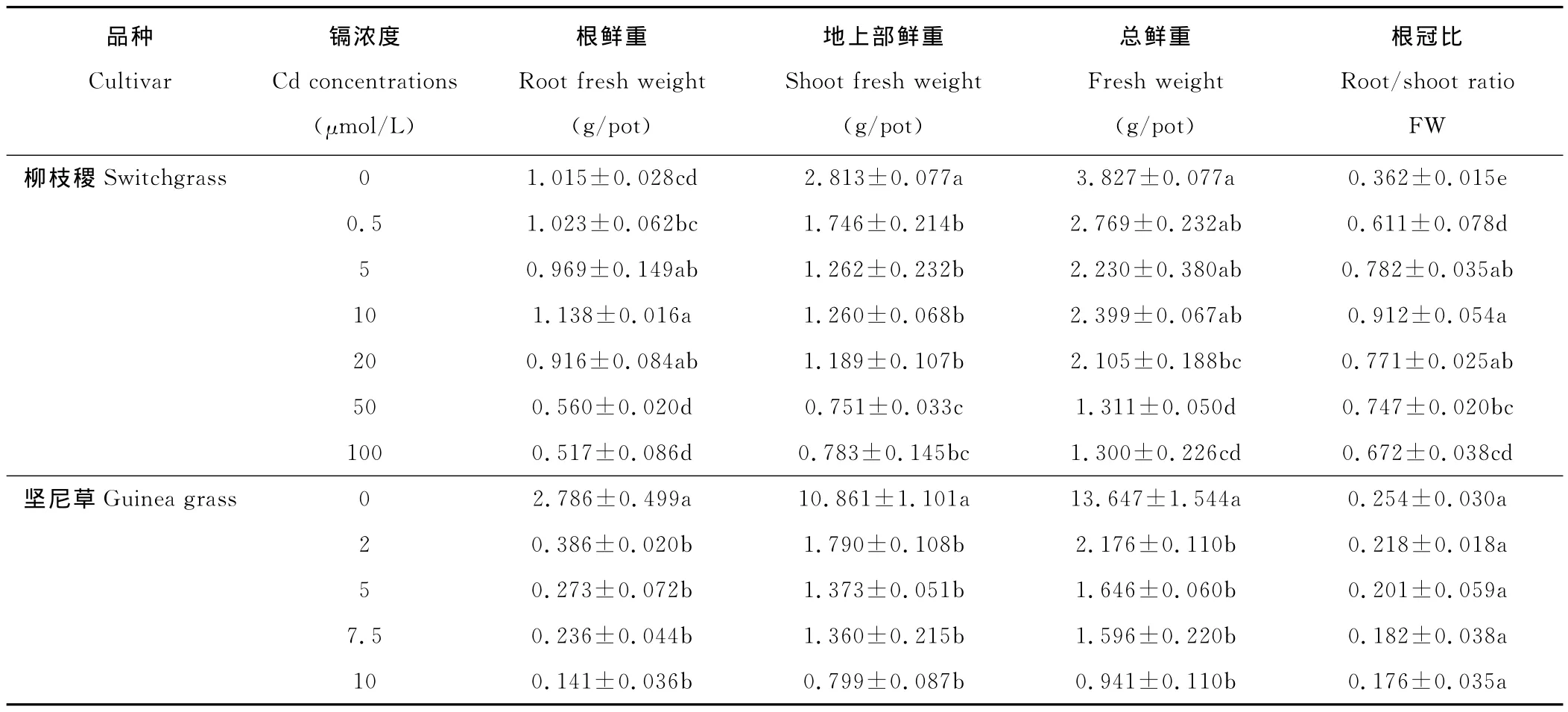
表1 Cd对柳枝稷和坚尼草生物量和根冠比的影响Table 1 Effects of Cd on biomass and root/shoot ratio of switchgrass and guinea grass
Cd对两种草的根伸长量产生了显著的影响(图1)。相比于对照,Cd浓度为2μmol/L时,坚尼草的根伸长量被抑制了96.3%,而柳枝稷的根伸长在5μmol/L的Cd溶液处理下才被抑制55.0%,且在Cd浓度为0.5 μmol/L时有促进生长的趋势,但差异不显著。
2.2 Cd处理下柳枝稷的根和地上部分Cd积累量和迁移指数
由图2可知,随着处理液中Cd浓度的逐渐增加,柳枝稷根和地上部分的Cd浓度和含量均显著增加,尤以根部最为显著(图2a,b)。在Cd浓度为50和100μmol/L时,根中Cd浓度是地上部分的10.0和6.7倍。就迁移指数而言,Cd处理下其无显著差异(图2c)。
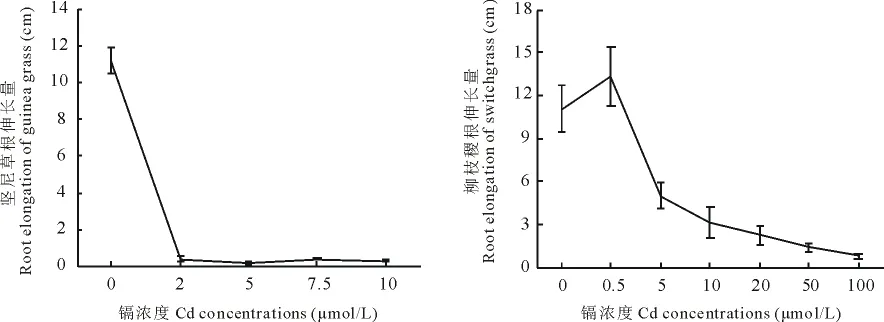
图1 Cd对柳枝稷和坚尼草的根伸长量的影响(平均值±标准误,n=9)Fig.1 Effects of Cd on root elongation of switchgrass and guinea grass(Values are mean±SE,n=9)
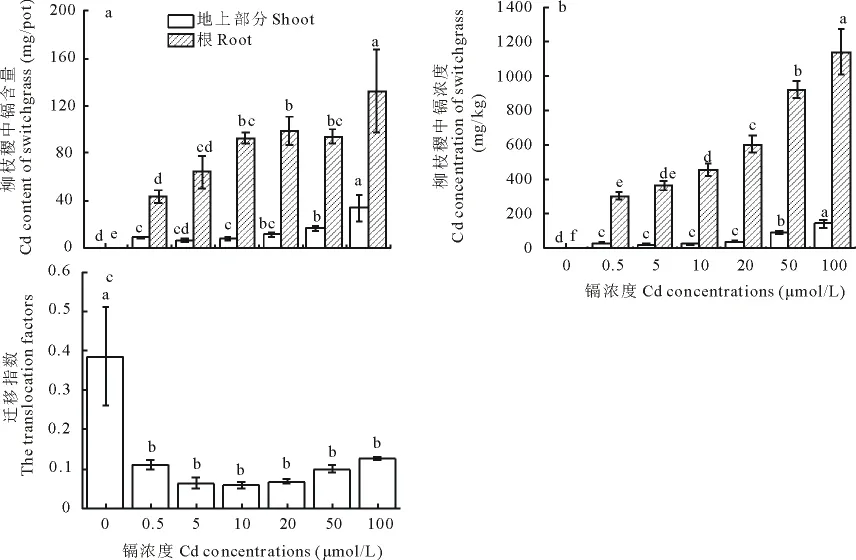
图2 柳枝稷根系和地上部分的Cd积累量(平均值±标准误,n=3)Fig.2 Cd accumulations in root and shoot of switchgrass exposed to Cd(mean±SE,n=3)
2.3 Cd对柳枝稷根系形态的影响
随着营养液中Cd浓度逐渐增加,柳枝稷的总根长、根表面积和根尖数显著降低 (P<0.05)(图3a,c)。根平均直径在Cd浓度为0~10μmol/L时逐渐增加,10~50μmol/L时保持稳定,100μmol/L时有下降的趋势,根体积在20μmol/L的Cd溶液中时才显著下降(图3b)。
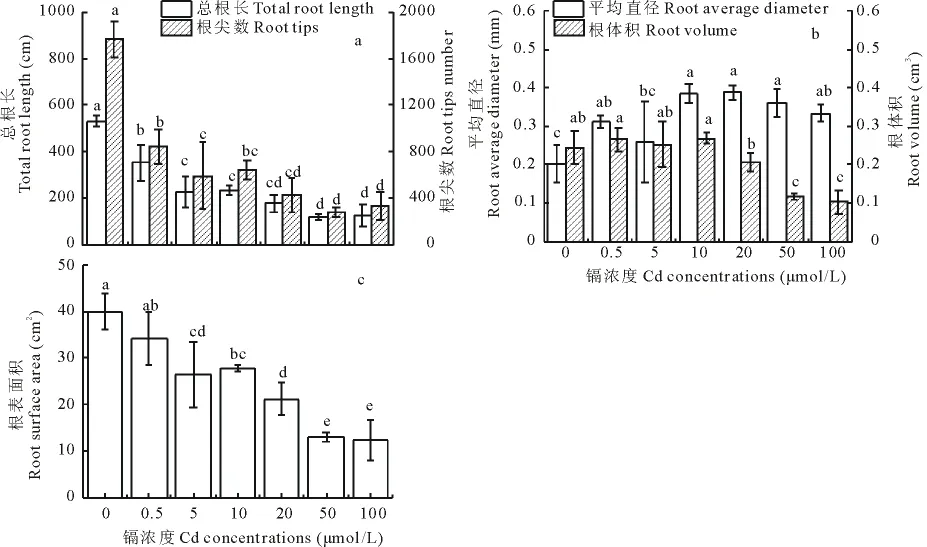
图3 Cd对柳枝稷根系形态的影响(平均值±标准误,n=9)Fig.3 Effect of Cd on root morphology of switchgrass(mean±SE,n=9)
2.4 Cd对柳枝稷根系构型的影响
用0.5mm的根平均直径间隔来描述根系形态的分布,对柳枝稷幼苗的根系构型进行分析。由表2可知,侧根在0~0.5mm和0.5~1.0mm两个直径区间的比例较高,这表明根系在此区间内拥有的根系最长,表面积最大,根尖数最多。从表中可以看出,柳枝稷的根长、根表面积、根体积和根尖数对Cd的响应因不同级别根系平均直径而不同。随着培养液中Cd浓度的增加,在0~0.5mm内,这4个参数均显著下降。而在0.5~1.0mm根平均直径范围内,20μmol/L的Cd溶液才显著降低根长和根表面积,根尖数在100μmol/L的Cd处理下才显著下降。对于平均直径大于1mm的根系,Cd的处理对4个参数基本无显著性影响。
2.5 根系形态参数和各指标间的相关性
为了深入了解不同数量级根系平均直径范围内,根系形态指标与其他生长指标和Cd积累之间的关系,进行了相关性分析。由表3可知,在根平均直径为0~0.5mm范围内,根长、根表面积、根体积和根尖数与根冠比、地上部Cd浓度、根中Cd浓度、地上部Cd含量和根中Cd含量均呈极显著负相关,而与地上部生物量、总生物量、根伸长量和TFs呈显著正相关。在0.5~1.0mm内,根长、根表面积和根体积与地上部Cd浓度、根中Cd浓度、地上部Cd含量和根中Cd含量呈负相关,而与根生物量、地上部生物量、总生物量和根伸长量呈显著正相关。大于1mm的根系各形态指标与其他指标间相关性达到显著的数量很少。
3 讨论
3.1 Cd对柳枝稷和坚尼草生物量、根冠比和根伸长的影响
Cd对植物生长的影响主要表现出“低促高抑”的现象[24],即Cd浓度较低时对植物的生长有促进作用,但植物体Cd含量积累到一定程度,则会直接或间接伤害植物,从而抑制植物生长甚至导致其死亡,主要表现为植物生长迟缓,植株矮小,根伸长受到抑制等[25]。前人研究表明,过量的Cd积累会抑制根的伸长和降低植株生物量[26-27]。本研究表明:在0~20μmol/L间的镉处理下,除了柳枝稷的地上部分生物量Cd浓度为0.5μmol/L时就显著降低外,其根的鲜重和总鲜重均维持在一个稳定水平,在Cd浓度为50μmol/L时根的鲜重才显著降低。而坚尼草在Cd浓度为2μmol/L时,根、地上部分和总鲜重就分别下降了86.1%,83.5%和84.1%。这说明Cd对两种草的生长产生了显著抑制作用,且柳枝稷根系比地上部对Cd的敏感性更强。从生物量来看,柳枝稷的耐镉性高于坚尼草。
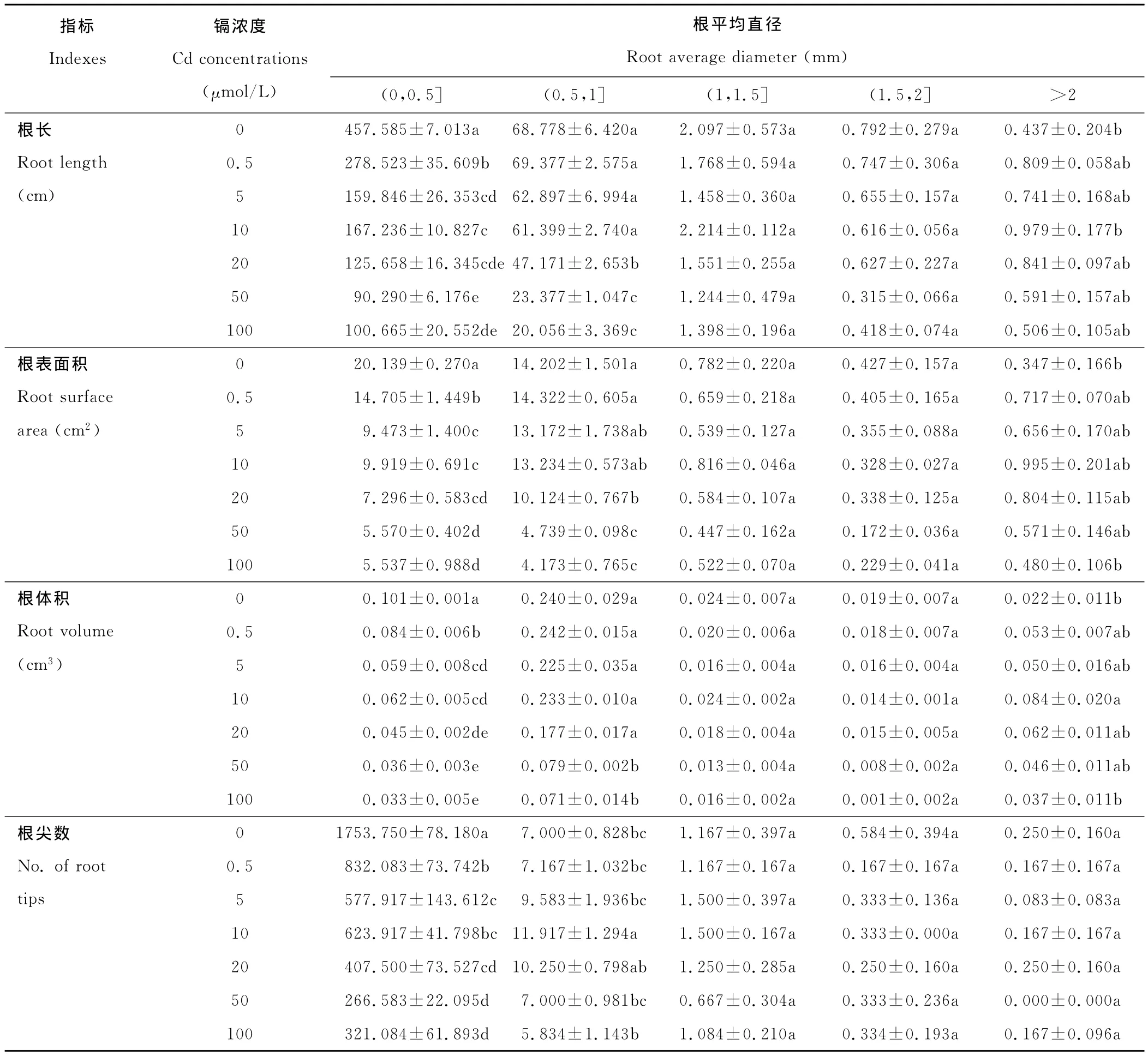
表2 Cd对柳枝稷根系构型的影响Table 2 Effect of Cd on root architecture of switchgrass
根冠比可以反映出植物在受到环境影响时物质的分配情况。结果表明:相比对照,Cd处理组中柳枝稷的根冠比显著增加,而坚尼草的根冠比却有下降的趋势,但差异不显著。这表明Cd处理下,由于镉对柳枝稷根系产生了影响,可能进而影响到植物对营养元素的吸收,其为了能够吸收正常的养分,通过增加地下部物质分配,将生长中心向根部转移,尽力维持正常生长,同样的结果Zhang等[28]也有报道。而对坚尼草,在2μmol/L的Cd处理下可能已经严重破坏了根系的细胞结构和物质代谢,导致根系生物量降低,进而影响地上部生长,这也验证了上述结论。
根系是植物吸收营养元素的主要器官,它直接与Cd溶液接触,因此根系伸长量能够最直接反映出植物的耐性。结果表明:相比于对照,Cd浓度为2μmol/L时,坚尼草的根伸长量被抑制96.3%,而柳枝稷的根伸长在5 μmol/L的Cd溶液处理下才被抑制55.0%,且在Cd浓度为0.5μmol/L时有促进生长的趋势,但差异不显著,这也印证了“低促高抑”的现象。结果再次说明坚尼草的耐镉性低于柳枝稷,坚尼草可能不适合在Cd污染的条件下被开发为一种能源草。
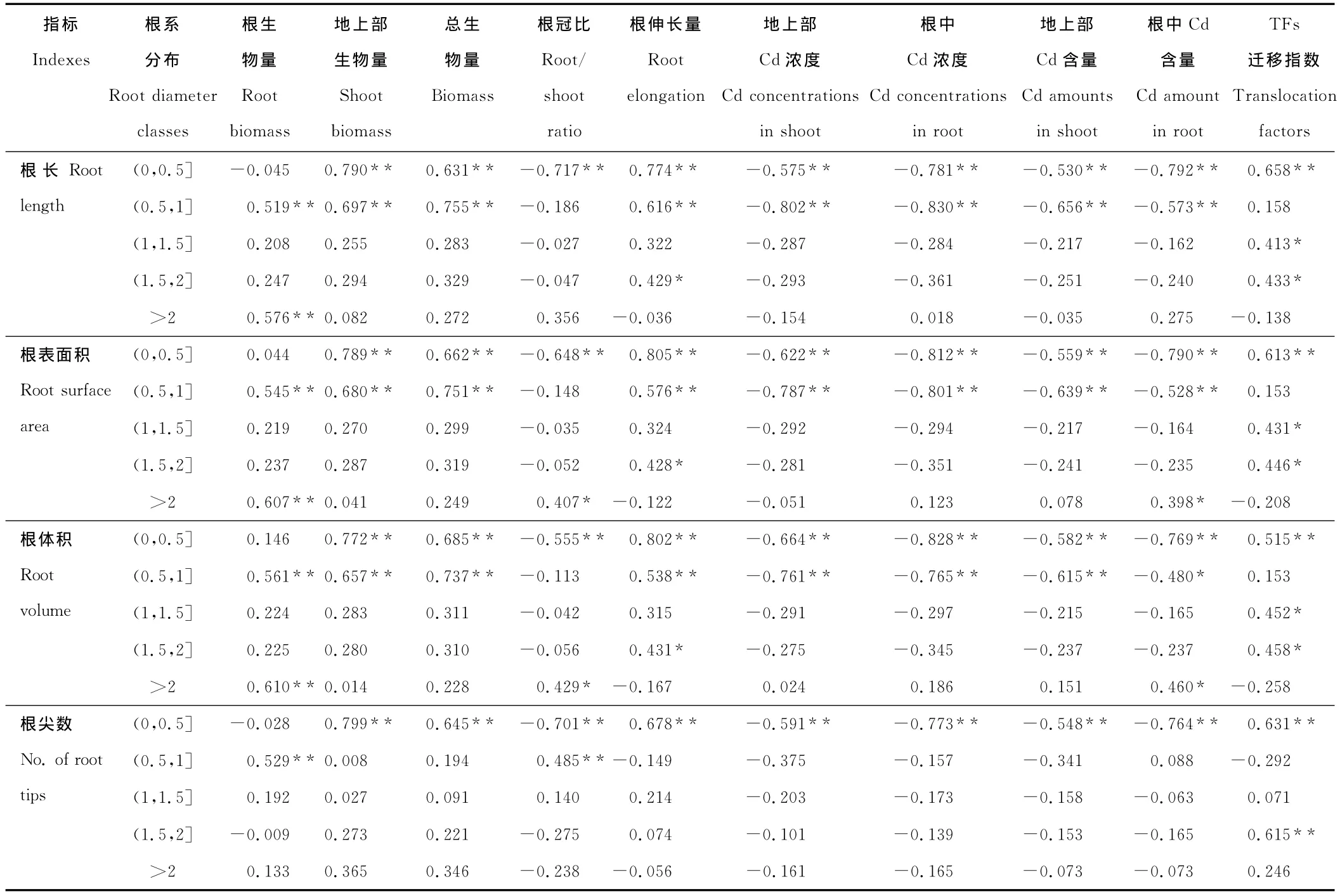
表3 根系形态参数和各指标间的相关性Table 3 Correlations between root morphologies and growth indicators as well as Cd accumulation
3.2 Cd对柳枝稷的Cd积累量和迁移指数的影响
根据植物吸收重金属的策略,可将植物分为3类:排斥型(excluder)、指示型(indicator)和富集型(accumulator),其中排斥和富集是植物适应重金属胁迫的两种主要机制[29]。由图2可知,随着处理液中Cd浓度的逐渐增加,柳枝稷根和地上部分的Cd浓度和含量均显著增加,尤以根最为显著(图2a,b)。镉浓度为20μmol/L时,柳枝稷的地上部分Cd浓度为40mg/kg,而生物量下降了45%,说明柳枝稷有一定的耐镉性。在镉浓度为50和100μmol/L时,根中Cd浓度是地上部分的10.0和6.7倍。就迁移指数而言,Cd处理下迁移指数为5.9%~14.2%,远小于通常认为的超积累植物的临界标准(TF>1.0)[29](图2c),说明植物吸收的Cd被大量截留在根部。因此,可以认为柳枝稷是通过排斥策略减轻重金属对植物体的毒害作用,即为排斥型植物。
3.3 Cd对柳枝稷根系形态的影响
在不良环境中,根系具有表型可塑性,使其可以获得更多的资源供自身生存[30]。在不同的植物中,Cd对植物根系形态的影响不同。Ding等[31]发现水培条件下,水稻(Oryza sativa)在Cd浓度为1mg/kg的处理时,其根长、根表面积、根体积和根尖数显著增加;而Chen等[32]对高羊茅草(Festuca elata)的研究中发现:1mg/kg的Cd溶液处理下,其总根长、根分叉数和根尖数显著降低。我们的研究结果表明:随着Cd浓度的逐渐增加,柳枝稷的根长、根表面积和根尖数显著降低。相比于对照,Cd处理组的根平均直径均显著增加,此结果与Huang等[33]报道一致。尽管柳枝稷根的生物量受Cd的影响较小,但是总根长、根表面积、根尖数都是显著降低的。这些现象表明重金属Cd抑制了侧根的形成,与以往多数人持有的观点不同,他们认为Cd会刺激植物侧根的形成[34]。根系形态与生长指标间的相关性分析表明:在根平均直径为0~1.0mm范围内,根长、根表面积和根体积与生物量、根伸长量和根冠比呈极显著相关,这说明根系形态也可作为一种判断植物耐镉性的重要指标。
目前有一些研究表明,根系形态与植物的Cd积累有很大关系。如Berkelaar和Hale[35]研究表明,在硬质小麦(Triticum aestivum)的根中,Arcola的Cd含量高于Kyle,他们将原因归于Arcola拥有较高的根表面积和根尖数。Li等[36]研究也发现,在Zn和Cd+Zn处理下,超积累型东南景天(Sedum alfredii)的根长、根表面积和根体积会增加,而非超积累型品种的上述指标会显著降低。我们的结果表明:在根平均直径为0~1.0mm范围内,柳枝稷的根长、根表面积和根体积与Cd积累量呈显著负相关,与迁移指数呈显著正相关,这些结果表明细根在植物的Cd积累中可能起着重要的作用,且发育较好的根可能有助于植物积累较高的Cd。
就根系构型来看,不同浓度镉对柳枝稷的影响主要集中于根平均直径为0~1.0mm的范围内。在0~0.5 mm范围内,总根长、根表面积、根体积和根尖数随着Cd浓度的增加会显著降低;在0.5~1.0mm范围内四者的变化也有相似的趋势,而在根平均直径大于1.0mm时,它们几乎没有显著变化。此结果表明根尖对Cd的敏感性很强,结合相关性分析结果,更加说明细根在植物的Cd积累中占据着重要的作用。
4 结论
Cd处理下,坚尼草和柳枝稷的生长均会受到不同程度的影响,尤以坚尼草更为显著。因此,在Cd污染的条件下,坚尼草可能不适合被开发为一种能源草,而柳枝稷则可生长在中重度Cd污染的环境中。本研究还表明根系形态也可以作为评判植物耐镉性的重要指标,且细根在植物的镉积累中可能起着重要的作用,发育较好的根可能有助于植物积累较高的镉。
[1]Johnson P G,Riordan T P,Johnson-Cicalese J.Low-mowing tolerance in buffalograss.Crop Science,2000,40(5):1339-1343.
[2]Sun G,Stewart C N J,Xiao P,et al.MicroRNA expression analysis in the cellulosic biofuel crop switchgrass(Panicum virgatum)under abiotic stress.Plos One,2012,7(3):e32017.
[3]Liu J L,Zhu W B,Xie G H,et al.The development of Panicum virgatumas an energy crop.Acta Prataculturae Sinica,2009,18(3):232-240.
[4]Calles Torrez V,Johnson P J,Boe A.Infestation rates and tiller morphology effects by the switchgrass moth on six cultivars of switchgrass.BioEnergy Research,2013,6(2):808-812.
[5]Lemus R,Brummer E C,Moore K J,et al.Biomass yield and quality of 20switchgrass populations in southern Iowa,USA.Biomass and Bioenergy,2002,23(6):433-442.
[6]Gunter L E,Tuskan G A,Wullschleger S D.Diversity among populations of switchgrass based on RAPD markers.Crop Science,1996,36(4):1017-1022.
[7]Xu B,Sathitsuksanoh N,Tang Y,et al.Overexpression of AtLOV1in switchgrass alters plant architecture,lignin content,and flowering time.Plos one,2012,7(12):e47399.
[8]Berti M T,Johnson B L.Switchgrass establishment as affected by seeding depth and soil type.Industrial Crops and Products,2013,41:289-293.doi:10.1016/j.indcrop.2012.04.023
[9]Foster J L,Guretzky J A,Huo C,et al.Effects of row spacing,seeding rate,and planting date on establishment of switchgrass.Crop Science,2012,53(1):309-314.
[10]Yang J,Worley E,Wang M,et al.Natural variation for nutrient use and remobilization efficiencies in switchgrass.BioEnergy Research,2009,2(4):257-266.
[11]Parrish D J,Fike J H.Selecting,establishing,and managing switchgrass(Panicum virgatum)for biofuels.Methods in Molecular Biology,2009,581:27-40.doi:10.1007/978-1-60761-214-8_2.
[12]Missaoui A M,Fasoula V A,Bouton J H.The effect of low plant density on response to selection for biomass production in switchgrass.Euphytica,2005,142(1-2):1-12.
[13]Burris Jason N,Mann David G J,Joyce Blake L,et al.An improved tissue culture system for embryogenic callus production and plant regeneration in switchgrass(Panicum virgatumL.).BioEnergy Research,2009,2(4):267-274.
[14]Ghimire S R,Charlton N D,Craven K D.The mycorrhizal fungus,Sebacina vermifera,enhances seed germination and biomass production in switchgrass(Panicum virgatumL).BioEnergy Research,2009,2(1-2):51-58.
[15]Samuel R,Pu Y,Raman B,et al.Structural characterization and comparison of switchgrass ball-milled lignin before and after dilute acid pretreatment.Applied Biochemistry and Biotechnology,2010,162(1):62-74.
[16]Hong C O,Owens V N,Lee D K,et al.Switchgrass,big bluestem,and indiangrass monocultures and their two-and three-way mixtures for bioenergy in the northern great plains.BioEnergy Research,2012,6(1):229-239.
[17]Lewandowski I,Scurlock J M O,Lindvall E,et al.The development and current status of perennial rhizomatous grasses as energy crops in the US and Europe.Biomass and Bioenergy,2003,25(4):335-361.
[18]Hu Z H,Wang Y C,Wen Z Y.Alkali(NaOH)pretreatment of switchgrass by radio frequency-based dielectric heating.Applied Biochemistry and Biotechnology,2008,148(1-3):71-81.
[19]Liu G D.Forage Floras of Hainan[M].Beijing:Chinese Agricultural Press,2000.
[20]Huo W,Zhuang C H,Cao Y,et al.Paclobutrazol and plant-growth promoting bacterial endophyte Pantoeasp.enhance copper tolerance of guinea grass(Panicum maximum)in hydroponic culture.Acta Physiologiae Plantarum,2012,34(1):139-150.
[21]Xu K.Effects of light and temperature on the seed germination of Panicum maximumJacq.and Paspalum plicatulum.Seed,1989,(3):43-47.
[22]Du F,Chen X,Yang C H,et al.Effect of NaCl stress on seed germination and seedling growth of different switchgrass materials.Acta Agrestia Sinica,2011,19(6):1018-1024.
[23]Su Y,Liu J,Lu Z,et al.Effects of iron deficiency on subcellular distribution and chemical forms of cadmium in peanut roots in relation to its translocation.Environmental and Experimental Botany,2014,97:40-48.doi:10.1016/j.envexpbot.2013.10.001
[24]Ren A Z,Gao Y B.Effects of single and combinative pollutions of lead,cadmium,chromium on the germination of Brassica chinensis L.Chinese Journal of Ecology,2000,19(1):19-22.
[25]Wang K R,Gong H Q.Effects of cadmium exposures in different stages on plant growth,Cd uptake and Cd concentrations in brown rice of a hybrid and conventional rice variety.Ecology and Environment,2006,15(6):1197-1203.
[26]Lux A,Martinka M,Vaculik M,et al.Root responses to cadmium in the rhizosphere:a review.Journal of Experimental Botany,2011,62(1):21-37.
[27]Xiong J,Lu H,Lu K,et al.Cadmium decreases crown root number by decreasing endogenous nitric oxide,which is indispensable for crown root primordia initiation in rice seedlings.Planta,2009,230(4):599-610.
[28]Zhang Z,Liu C,Wang X,et al.Cadmium-induced alterations in morpho-physiology of two peanut cultivars differing in cadmium accumulation.Acta Physiologiae Plantarum,2013,35(7):2105-2112.
[29]Shi G R.Screening of Heavy Metal-tolerant Energy Plants and Their Adaptability to Metal Stress[D].Nanjing:Nanjing Agricultural University,2009.
[30]Malamy J E.Intrinsic and environmental response pathways that regulate root system architecture.Plant,Cell & Environment,2005,28(1):67-77.
[31]Ding Y,Feng R,Wang R,et al.A dual effect of Se on Cd toxicity:evidence from plant growth,root morphology and responses of the antioxidative systems of paddy rice.Plant and Soil,2014,375(1-2):289-301.
[32]Chen W,Zhang M M,Song Y Y,et al.Impacts of heavy metals on the fluorescence characteristics and root morphology of 2turfgrass species.Acta Prataculturae Sinica,2014,23(3):333-342.
[33]Huang B,Xin J,Dai H,et al.Root morphological responses of three hot pepper cultivars to Cd exposure and their correlations with Cd accumulation.Environmental Science and Pollution Research,2014:1-9.doi:10.1007/s11356-014-3405-7
[34]Potters G,Pasternak T P,Guisez Y,et al.Different stresses,similar morphogenic responses:integrating aplethora of pathways.Plant,Cell &Environment,2009,32(2):158-169.
[35]Berkelaar E,Hale B.The relationship between root morphology and cadmium accumulation in seedlings of two durum wheat cultivars.Canadian Journal of Botany,2000,78(3):381-387.
[36]Li T,Yang X,Lu L,et al.Effects of zinc and cadmium interactions on root morphology and metal translocation in a hyperaccumulating species under hydroponic conditions.Journal of Hazardous Materials,2009,169(1-3):734-741.
参考文献:
[3]刘吉利,朱万斌,谢光辉,等.能源作物柳枝稷研究进展.草业学报,2009,18(3):232-240.
[19]刘国道.海南饲用植物志[M].北京:中国农业大学出版社,2000.
[21]许堃.光温对坚尼草、棕籽雀稗种子发芽的影响.种子,1989,(3):43-47.
[22]杜菲,陈新,杨春华,等.NaCl胁迫对不同柳枝稷材料种子萌发与幼苗生长的影响.草地学报,2011,19(6):1018-1024.
[24]任安芝,高玉葆.铅、镉、铬单一和复合污染对青菜种子萌发的生物学效应.生态学杂志,2000,19(1):19-22.
[25]王凯荣,龚惠群.不同生育期镉胁迫对两种水稻的生长、镉吸收及糙米镉含量的影响.生态环境,2006,15(6):1197-1203.
[29]史刚荣.耐重金属胁迫的能源植物筛选及其适应性研究[D].南京:南京农业大学,2009.
[32]陈伟,张苗苗,宋阳阳,等.重金属离子对2种草坪草荧光特性及根系形态的影响.草业学报,2014,23(3):333-342.
——现代牙刷的由来

