猪粪高效除臭微生物菌株筛选及发酵条件优化
张生伟,姚拓,黄旺洲,杨巧丽,滚双宝*
(1.甘肃农业大学动物科学技术学院,甘肃 兰州730070;2.甘肃农业大学草业学院,甘肃 兰州730070)
随着人民生活水平的不断提高,对肉类食品的需求不断增加。据联合国粮农组织(FAO)资料显示[1],到2050年全世界对肉类的需求量将增加73%,畜牧业将向集约化、规模化方向快速发展。随之而来的是产生的大量畜禽粪便成为重要的环境污染源。有关数据统计[2],2010年全国畜禽粪便产生量约为40亿t,无害化处理仅占总排放量的不足10%。畜禽粪便产生的恶臭气体在污染环境、影响畜禽正常生长发育和潜在生产性能发挥的同时也危害人类健康,因此加强恶臭气体控制,减少对环境污染成为亟待解决的问题[3]。
目前畜禽粪便臭气处理方法很多,包括物理方法、化学方法和生物方法[4],而微生物除臭法是利用微生物的生理代谢作用降解恶臭物,具有脱臭率高、无二次污染等优点,已成为当前治理臭气的一个重要途径[5]。微生物除臭过程中主要是微生物的氧化硫化物、异养硝化和好氧反硝化及还原等功能方面起作用[6],因此微生物除臭的关键在于筛选高效除臭微生物。长期以来人们不断试图改进优化筛选除臭微生物的新方法和途径,因筛选方法的局限性和微生物的特异性等原因,筛选到的微生物除臭效果不理想。如Elmrini等[7]筛选的除臭菌只在发酵前期对氨气去除率较高,对硫化氢去除作用不明显。李彪和熊焰[8]筛选的除臭菌对氨气和硫化氢的去除率达47.70%和62.50%。李珊珊等[9]筛选的除臭菌只有单一抑制氨气释放的作用,达不到高效除臭。Ransbeeck等[10]研究表明,臭气成分复杂,每一种臭气都需要特定的微生物来降解,单一菌株除臭效果低于多种微生物共同作用的效果。Meinen等[11]利用筛选的除臭菌株混合培养后得到的除臭剂对畜禽粪便有较强的除臭能力,除臭效果优于任一单个菌株,因而除臭菌群的筛选成为研究的热点。当前日本和欧美国家在应用于微生物除臭制剂的微生物筛选及基础研究、产品开发等方面处于领先地位,而我国的研究主要在国外商品化除臭制剂试验方面[12],对具有自主知识产权的除臭制剂的研究与开发很少。因此本研究首先筛选除臭菌株,再以微生物协同作用为出发点,通过菌株构建菌群的方法筛选高效除臭菌群。
控制和优化除臭发酵条件可更好的发挥除臭菌的除臭性能[13]。Yin等[14]通过感官法结合复筛法筛选出鸡粪除臭微生物,通过优化发酵条件,更好的发挥了除臭菌的除臭性能。高红梅等[15]对除臭微生物7NC的培养基和培养条件优化后得到了适合除臭微生物7NC生长的培养基和最佳培养条件。除臭发酵条件对提高除臭菌的除臭性能具有重要的意义,不同微生物有适合其发酵的最佳发酵条件,并且当前在反刍动物和禽类粪便发酵条件方面的研究较多,而在猪粪方面的研究鲜有报道,因此优化猪粪发酵条件具有重要的意义。
本研究应用选择性培养基简易、快速初选和复选相结合的方法,拟筛选出高效除臭微生物并对其除臭机理和发酵条件进行研究,旨在减轻畜禽粪便产生的恶臭气体对环境的污染,为进一步研制和推广应用微生物除臭剂提供理论依据和技术支持。
1 材料与方法
1.1 试验材料
新鲜猪粪、堆肥猪粪源于兰州市宝鑫养殖场;活性污泥、垃圾堆样、秸秆腐败样源于武威市黄羊镇牧草试验站。试验时间于2014年3月-10月,在草业生态系统教育部重点实验室进行。
培养基:牛肉膏蛋白胨培养基、高氏改良一号培养基、马丁氏培养基分别用于分离细菌、放线菌、真菌;马铃薯培养基用于真菌增殖培养;NH3选择性培养基和H2S选择性培养基用于除臭菌株的初选[16]。
1.2 试验方法
1.2.1 菌株的分离纯化 取新鲜猪粪、堆肥猪粪、活性污泥、秸秆腐败样、垃圾堆样各10g置装有90mL灭菌生理盐水的三角瓶中。用无菌水稀释成不同浓度梯度(10-1~10-6),取100μL不同浓度稀释液涂布于不同培养基平板上置于30℃恒温培养箱培养5d[17],参照Terence等[18]平板稀释分离法进一步分离纯化,纯化后的单一菌株在显微镜下根据形态特征分类编号后于4℃斜面保存备用。
1.2.2 除臭菌初选 1)除NH3菌株初选:参照Liu等[19]筛选方法,取10mL NH3选择性培养基分装于摇菌瓶中,高压灭菌后,注入10μL氨水(25%),将分离得到的菌株接种至相应的液体培养基,置于180r/min摇床上30℃恒温培养3~7d,按5%(V/V)接种至摇菌瓶密封后置于30℃、180r/min摇床上恒温培养5d后观察菌液变化,若浑浊表明菌株具有降解NH3能力。
2)除H2S菌株初选:将分离得到的菌株接种至相应的液体培养基,置于180r/min摇床上30℃恒温培养3~7d,按5%(V/V)接种至装有200mL H2S选择性培养基的烧杯中,在烧杯中放置一个50mL无菌小烧杯,内装有12mL 25%(V/V)H2SO4,向小烧杯中加入4g硫化铁(FeS)后密封,于30℃、180r/min摇床上恒温培养5d后,观察菌液浑浊变化,若浑浊表明菌株具有降解H2S能力[20]。
1.2.3 除臭菌复选 1)除NH3菌株复选:取200g新鲜猪粪加至2.5L的塑料桶中,将初选菌株在相应的液体培养基培养活化后,按猪粪质量的10%接种至猪粪,桶中放入50mL无菌小烧杯,内装有20mL 2%硼酸溶液用于吸收NH3,用保鲜膜密封桶后盖上桶盖,置于30℃恒温室中发酵培养。对照组加入等量灭活的菌液,每个处理3个重复。间隔5d参照Bernardo等[21]测定方法用硼酸吸收凯氏法测定NH3的释放量,测定周期为30d。
2)除H2S菌株复选:取200g新鲜猪粪加至2.5L的塑料桶中,将初选菌株在相应的液体培养基培养活化后,按猪粪质量的10%接种至猪粪,桶中放入50mL无菌小烧杯,内装有20mL锌胺络盐吸收液用于吸收H2S,用保鲜膜密封桶后盖上桶盖,置于30℃恒温室中发酵培养。对照组加入等量灭活的菌液,每个处理3个重复。间隔5d参照Yan等[22]测定方法用锌胺络盐吸收比色法测定H2S的释放量,测定周期为30d。
1.2.4 除臭组合菌群优化 取筛选出具有抑制氨气和硫化氢释放效果好的菌株分别于相应的培养基进行振荡培养至对数生长后期,按照等比例混合制成组合菌群。参考L8(27)设计7因素2水平正交试验,正交试验的7个因素为筛选的不同菌株,水平为接菌和不接菌。正交试验设计见表1,以等量灭活的菌液为对照,每个处理设3个重复。间隔5d测定NH3和H2S的释放量,测定周期为30d。
1.2.5 除臭发酵条件优化 将培养活化后的除臭组合菌群按不同的接种量接种至新鲜猪粪,测定接种量对除臭发酵的影响。在最佳接种量的条件下,测定猪粪不同含水率对除臭发酵的影响[23]。在最佳接种量和含水率条件下测定麸皮添加量对除臭发酵的影响。对除臭发酵的影响以氨气和硫化氢的释放量为指标,测定方法同1.2.3。
1.3 数据处理与统计分析
采用Microsoft Excel 2003软件进行数据处理和绘图,采用SPSS 19.0统计分析软件对数据进行统计分析。

表1 除臭组合菌群优化正交试验因素水平Table 1 Orthogonal factor level of optimizing deodorant combination flora
2 结果与分析
2.1 菌株的分离
将5种样品在3种分离培养基上培养,分离出的纯菌落根据形态特征分类编号,各样品分离出的各类微生物结果见表2。由表2可知,不同样品中分离出的菌株总数和种类不同。从菌株总数看,新鲜猪粪样、堆肥猪粪样和活性污泥样中分离出的菌株数明显多于垃圾堆样和秸秆腐败堆样,新鲜猪粪中分离的菌株最多,垃圾堆中分离的最少。分离出的细菌和真菌数量基本相同,占分离菌株总数的36.15%和38.46%,放线菌占25.39%。
2.2 除臭菌株筛选
2.2.1 除臭菌的初筛 采用氨气和硫化氢选择性培养基对分离得到的130个菌株进行除臭性能的初步定性筛选(表3)。从表中可以看出,能利用NH3的除臭菌株共30株,其中细菌、放线菌、真菌的分离效率分别是19.15%,24.24%和26.00%。能利用H2S的除臭菌株共23株,其中细菌、放线菌、真菌的分离效率分别是21.28%,12.12%和18.00%。能利用NH3的除臭菌株分离效率是23.08%,高于能利用H2S的除臭菌株分离效率(17.69%)。
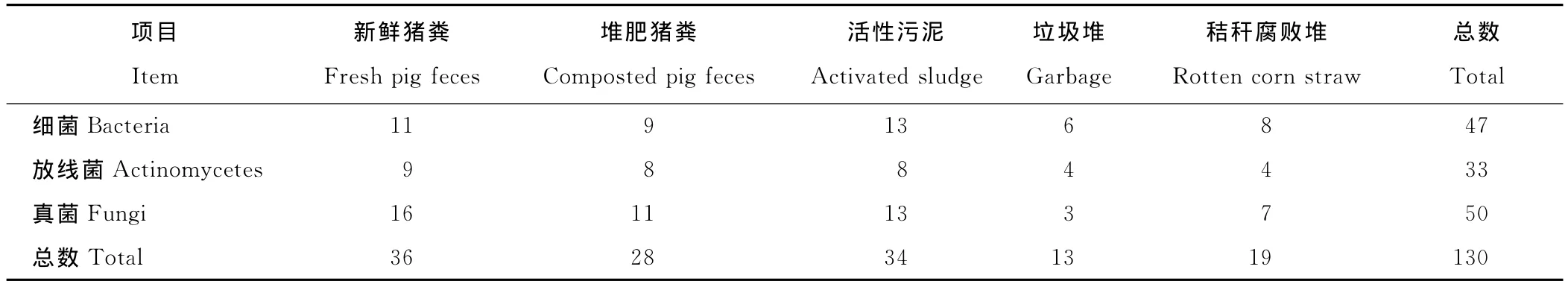
表2 不同样品分离的菌株种类及数量Table 2 The species and number of strains isolated from different samples 株Strains
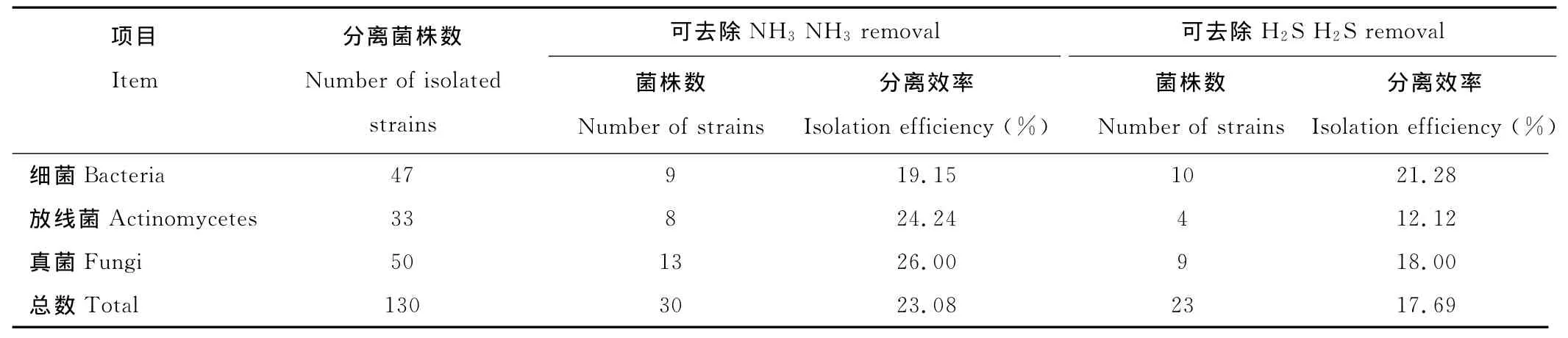
表3 不同来源样品中可去除NH3和H2S的真菌、放线菌和细菌菌株数Table 3 Number of NH3and H2S removal fungi,actinomycetes and bacteria strains isolated from different sources samples
2.2.2 除臭菌复选 将初选定性试验中筛选出的菌株以氨气和硫化氢为指标进行复选试验,各菌株在猪粪发酵过程中抑制氨气和硫化氢释放作用有差异,其中命名为DZ1、BX3、DZ3、BZ1、EZ3的5株菌株抑制氨气释放作用明显,DZ1、DZ3、BZ1、EZ3是真菌,BX3是细菌。不同时间NH3的释放量见图1,BX3菌株在整个发酵过程中抑制作用明显。总体来看,各菌株作用猪粪后在发酵前25d氨气的释放量呈依次下降趋势,25d之后氨气释放趋于稳定;CX4菌株作用于猪粪后,发酵前10d氨气的释放量显著高于其他菌株及对照组,表明CX4菌株对氨气的释放不但没有抑制作用,反而促进释放。
不同菌株在不同时间对氨气的去除率见图2,命名为DZ1、BZ1、EZ3的菌株主要在发酵前20d发挥作用,20 d后去除率不及其他菌株;DZ3菌株在发酵前期的去除率不及其他菌株,在发酵后期具有较稳定的抑制作用。BX3菌株在整个发酵过程中对氨气的去除率都较高,尤其在20d之后去除率高于其他菌株。CX4菌株对氨气的释放具有促进作用,在发酵的15~20d对氨气的去除率为正值,其他时间去除率为负值。与初选结果类同,抑制氨气释放效果好的5株菌中4株是真菌,只有BX3菌株是细菌,真菌数量占优势。表明真菌较细菌和放线菌相比更有利于抑制氨气的释放。
在复选试验中命名为AF2、BX3、AX4的菌株抑制硫化氢释放作用明显,其中BX3和AX4是细菌,AF2是放线菌。整个发酵周期中硫化氢的释放量见图3。AF2、BX3、AX4菌株作用猪粪后硫化氢的释放量在发酵前15d呈快速下降趋势,15d之后趋于稳定;CZ3菌株在发酵前15d硫化氢的释放量呈下降趋势,15~25d呈升高趋势,25d之后呈下降趋势,在15d之后的释放量高于对照组和其他处理,促进了H2S的释放。
不同菌株作用于猪粪在不同时间硫化氢的减少率见图4,各菌株对H2S的去除率在发酵的前15d呈逐渐下降趋势,在20d最低,20d之后又呈现上升趋势。AX4菌株在整个发酵周期对H2S的去除率均为正值,0~5d和25~30d的除臭率高于75%;AF2菌株在发酵的20~25d硫化氢的去除率呈负值,其他时间去除率高于40%;BX3菌株除臭效果较稳定,在发酵前10d除臭率高于60%。
在抑制H2S释放效果好的3株菌中,有2株细菌和1株放线菌,表明细菌在抑制H2S释放过程中发挥主要作用。BX3菌株在整个发酵周期中对氨气和硫化氢的释放均有很显著的抑制作用。
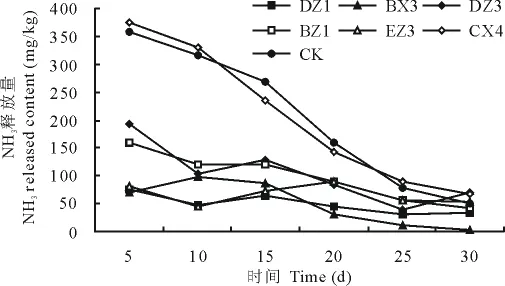
图1 不同菌株作用下NH3的释放量Fig.1 Result of the release amount of NH3 in different strains
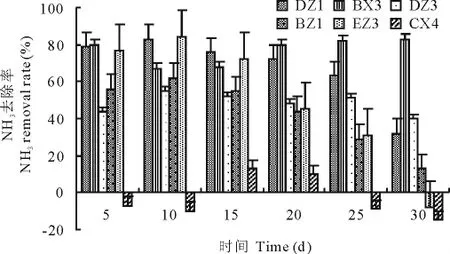
图2 不同菌株处理后猪粪样品NH3的去除率Fig.2 NH3removal rate of the swine manure samples under the treatments of different strains
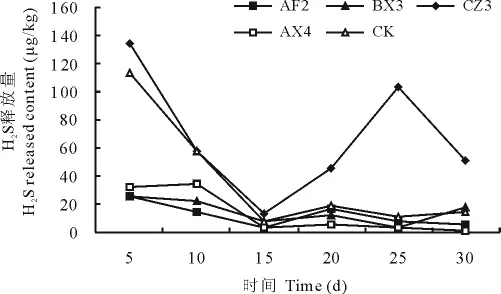
图3 不同菌株作用下H2S的释放量Fig.3 Result of the release amount of H2S in different strains
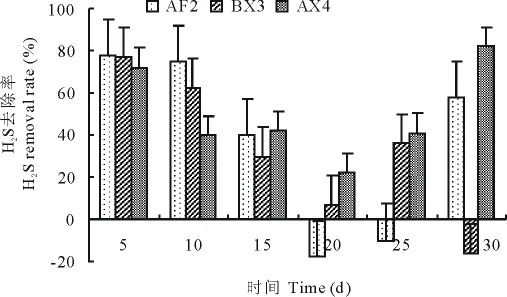
图4 不同菌株处理后猪粪样品H2S的去除率Fig.4 H2S removal rate of the pig feces samples under the treatments of different strains
2.3 除臭组合菌群优化
经F检测各组合菌群在不同时间对NH3释放量的影响均显著或极显著,进一步用SSR法检测,结果见表4,不同组合菌群在不同时间对氨气的释放均有抑制作用,但抑制的程度不同。所有组合在发酵前20d氨气的释放量均极显著低于对照,A组合在发酵5~25d氨气的释放量均显著或极显著低于其他组合,表明所有组合菌群对氨气释放均有抑制作用,而A组合抑制效果最好。
不同时间各组合对氨气的释放抑制作用不同,前20d各组合菌群对氨气释放抑制效果明显,20d之后除A组合以外的其他组合氨气释放量均高于对照组,表明组合菌群有效抑制时间为发酵前20d,超过20d失去抑制作用。
经F检测各组合菌群在不同时间里对H2S释放量的影响显著或极显著,进一步用SSR法检测,结果见表5,不同组合菌群在不同时间对硫化氢的释放均有抑制作用但程度不同,所有组合菌群在发酵5~20d硫化氢的释放量均极显著的低于对照组,表明组合菌群对硫化氢的释放均有明显的抑制作用,A组合在发酵前25d硫化氢的释放量显著或极显著低于其他组合,抑制作用最明显。B组合在发酵前15d硫化氢的释放量显著或极显著高于其他组合,可能因菌株间的拮抗作用导致抑制作用不明显。
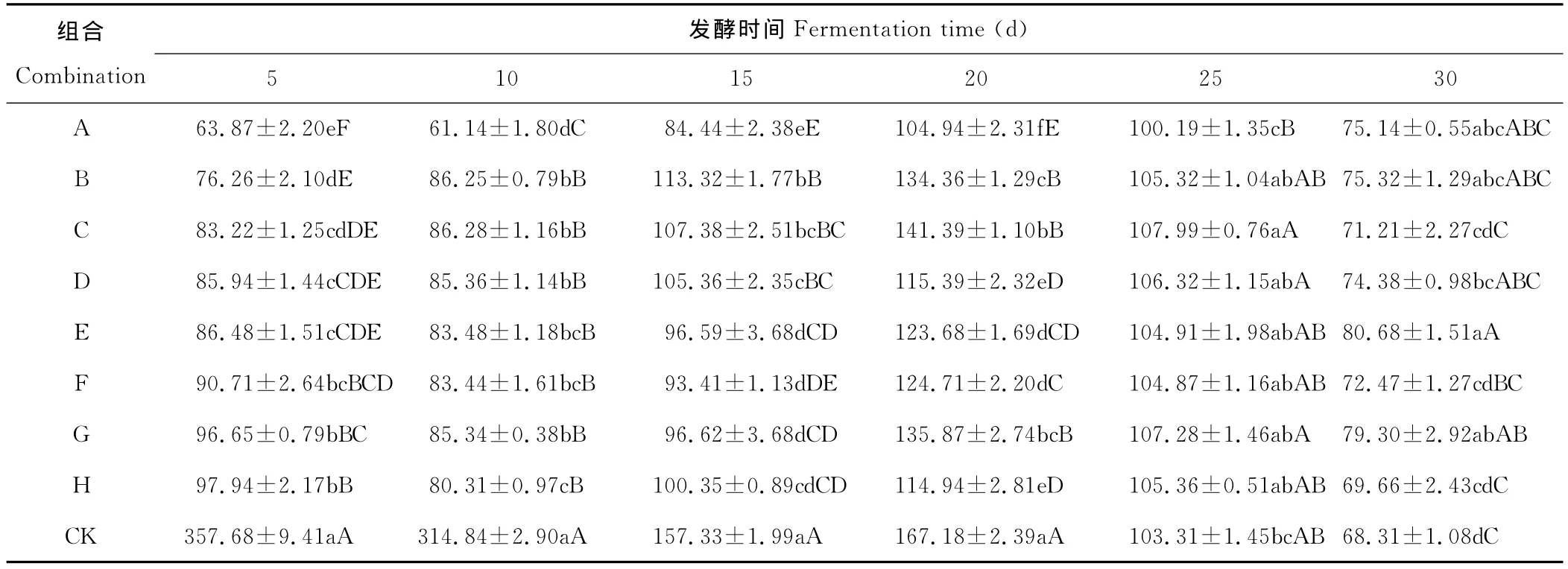
表4 不同菌种组合菌群对NH3释放量的影响Table 4 The effect on NH3release amount of different strain combination flora mg/kg
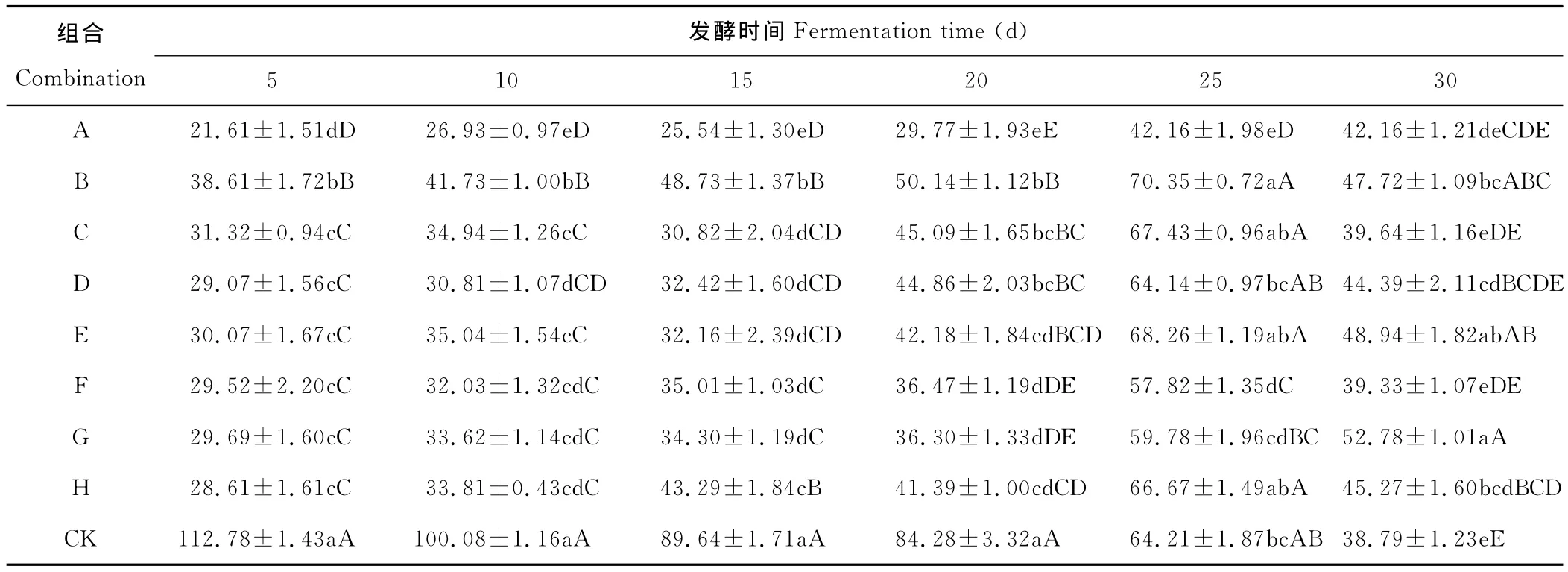
表5 不同菌种组合菌群对H2S释放量的影响Table 5 The effect on H2S release amount of different strain combination flora μg/kg
2.4 除臭发酵条件优化
2.4.1 不同接种量对NH3及H2S释放的影响 将最佳组合菌群按不同接种量接种于新鲜猪粪,结果见图5,接种量分别是10%和15%时,氨气和硫化氢的释放最低,为60.32mg/kg和21.13μg/kg,组合菌群抑制氨气和硫化氢的释放效果最好。
2.4.2 不同含水率对NH3及H2S释放的影响 调节新鲜猪粪的含水率,按最佳接种量接种组合菌群,测定不同含水率对氨气和硫化氢释放的影响,由图6可见,含水量分别是40%和30%时氨气和硫化氢的释放量最低,为59.87mg/kg和20.89μg/kg。
2.4.3 不同麸皮添加量对NH3及H2S释放的影响 在最佳接种量和含水率条件下,按新鲜猪粪质量比添加麸皮,氨气和硫化氢的释放量如图7所示,当麸皮添加量为10%,氨气和硫化氢的释放量最小为57.85mg/kg和19.64μg/kg,更好地发挥了组合菌群的除臭性能。
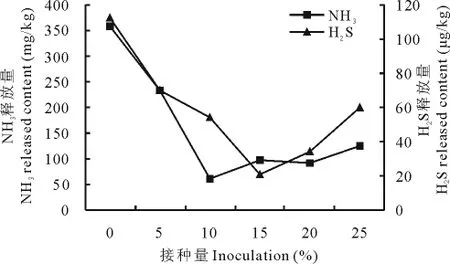
图5 不同接种量对NH3和H2S释放的影响Fig.5 The effect on NH3and H2S release amount in different inoculation
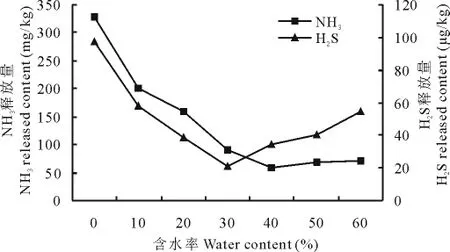
图6 不同含水率对NH3及H2S释放的影响Fig.6 The effect on NH3and H2S release amount in different water content
3 讨论
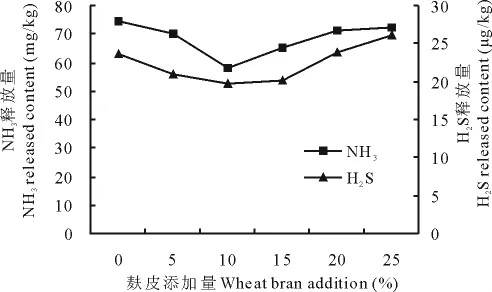
图7 不同麸皮添加量对NH3及H2S释放的影响Fig.7 The effect on NH3and H2S release amount in different wheat bran addition
3.1 除臭菌株的筛选
本研究筛选出7株高效除臭菌,有4株分离自新鲜猪粪和堆肥猪粪,3株分离自活性污泥、垃圾堆样、秸秆腐败样。原因可能是新鲜猪粪和堆肥猪粪中微生物所需的营养物质及磷、钾、锌、铜等元素含量丰富[24],除臭菌富集,且除臭环境的营养状况与菌源环境营养条件较为相近,更有利于除臭菌的筛选。而活性污泥、垃圾堆样、秸秆腐败样等材料中含有大量的除臭菌,由于其菌源采集环境与除臭环境中营养条件差异太大,部分除臭菌在猪粪除臭环境中因适应性差而难以发挥除臭性能。7株菌中有4株真菌,2株细菌,1株放线菌,真菌的数量占优势,这与Terence等[18]和Yan等[22]筛选的除臭菌株真菌数量占优势的结果一致。筛选的BX3菌株除臭性能最优,对氨气和硫化氢的去除率达80.07%和76.92%,可同时高效抑制氨气和硫化氢的释放。陈丽园等[25]在除臭菌株筛选方面做了相关研究,筛选的菌株使氨气和硫化氢的释放量降低67.95%和26.6%,抑制氨气释放效果较明显,但对硫化氢作用不明显,而本研究筛选的BX3菌株同时抑制氨气和硫化氢的效果优于之前的研究报道。除臭过程中氨气减少的趋势与高颖等[26]筛选的菌株一致,而硫化氢的减少趋势不一致,说明去除氨气的机理一致,只是菌株之间除臭性能有差异[5]。硫化氢在发酵前15d呈快速减少趋势,15~20d出现增长趋势,20~30d又趋于平稳,15~20d出现增长的变化趋势不同于其他研究,分析其原因可能是除臭菌大量繁衍,其数量达到最大,因菌间竞争营养物质而数量下降,从而硫化氢的释放量出现增长趋势,20d之后微生物的数量趋于稳定,硫化氢的释放量也较为稳定。5株抑制氨气释放的菌在发酵的前25d作用明显,氨气的释放量低于对照,超过25d后氨气释放量趋于平稳,与对照组无差异。原因可能是在发酵除臭的微环境中,25d之后氨气浓度降低,菌间因营养物质减少竞争加剧,除臭菌的数量剧减导致氨气释放趋于平稳。分离的菌株CX4和CZ3,在发酵部分阶段反而促进了氨气和硫化氢的释放导致释放量高于对照,这可能是菌株生理代谢的差异使氨气和硫化氢的释放量增加。除臭菌降解臭气的生理代谢过程及物质间的转化机理还有待研究。影响筛选除臭菌结果的因素很多,但筛选方法是主要因素,至今没有特定的培养基和筛选方法进行除臭微生物的直接筛选,很多研究都以感官定性法进行筛选,考虑到感官定性法存在一定的局限性,即在初选时有除臭能力,在复选时没有除臭能力[27]。本试验首先利用氨气和硫化氢选择性培养基进行简易广泛初选,再通过硼酸吸收法和锌铵络盐吸收比色法复选,初选复选相结合的筛选方法避免了感官定性法筛选的局限性。筛选的除臭微生物可为畜禽粪便微生物除臭产品制备提供种质资源,其生理生化特性、菌株鉴定和除臭机理有待进一步研究。
3.2 除臭组合菌群的优化
自然界中,多种菌株构成的菌群可以抑制粪便堆肥等过程中复杂恶臭气体的产生,这些菌株在一起才具备抑制复杂恶臭气体的能力,当生存环境发生改变或缺少其中某一种或某几种微生物后,整个微生物群的除臭能力会下降,甚至功能丧失[6,9]。本研究通过正交试验将筛选的除臭菌株构建组合菌群,结果表明单个菌株的除臭效果均不及组合菌群,得到一组高效除臭菌群在猪粪发酵第5天氨气和硫化氢的释放减少率达到82.14%和80.84%,在发酵前25d都有显著的抑制作用,组合菌群除臭效果优于菌株,这与赵晨曦等[28]在鸡粪除臭菌群的研究结果一致,符合Yin等[14]提出的群体回归自然的学术思想。优化得到的组合菌群的除臭效果明显是由于畜禽粪便产生的臭气污染是一个复杂的过程,成分复杂的恶臭气体被去除需多种微生物互营共生作用、菌株间的加性效应等,形成的优势混合菌群改变原菌群才能更好的抑制恶臭物质的产生[29]。优势组合菌群有较好的除臭能力,菌群中各菌株发挥的作用也不尽一致,有的起除臭关键作用,有的为除臭菌的伴生菌,虽然不能起到除臭的作用,但能利用除臭过程中产生的中间产物作为营养物质,减小中间产物对后续反应的抑制,对臭气分解起促进作用[13-14,30]。组合菌群的除臭效果明显,其作用机理及其菌间关系还待进一步的研究。
3.3 除臭发酵条件优化
发酵条件是影响发酵水平的重要因素,在除臭发酵过程中发酵条件对微生物的生长和性能发挥具有重要的意义[4,13]。本研究测定猪粪含水率对发酵的影响,当含水率小于30%时,氨气和硫化氢的释放量随着猪粪含水率的增加而下降,当含水率达到30%,硫化氢的释放量最低,达到40%时氨气的释放量最低,之后随着含水率的增加,氨气和硫化氢的释放量呈现增加趋势,而氨气的增加比硫化氢增加较为缓慢,这个变化趋势与Frauke等[31]研究结果一致,但与Bernardo等[21]筛选的菌株变化趋势不一致,原因可能是菌种间的差异性和猪粪成分的不同。猪粪含水率在30%和40%时硫化氢和氨气的释放量最低是由于氨气易溶于水,增加适当的水分,可减少氨气的释放,并且为除臭菌的快速繁衍生长提供适合的微环境,随着水分的增加改变了除臭菌的微环境,不能更好的发挥除臭菌的除臭性能[14,19]。
适宜的接种量可以缩短发酵阶段菌体生长的延滞期,从而缩短发酵周期,最终提高除臭菌的除臭性能。而在短的发酵时间内获得除臭所需的除臭菌数量,接种一定的除臭菌是必要的[12,23]。本研究在接种量为10%和15%时,除臭菌快速形成最佳优势菌群,氨气和硫化氢的释放量最低,为除臭发酵的最佳接种量。低于最佳接种量时,除臭菌需要一个繁衍生长期,因此抑制效果不明显。高于最佳接种量时菌体密度增大,不利于单个菌体的生长,导致菌体间发生竞争性抑制作用,同时高密度的除臭菌产生大量的初反应产物,后续反应不能及时进行而产生反应抑制,从而影响除臭效率[24,31]。在麸皮添加量为10%时,氨气及硫化氢释放量最低。麸皮添加量低于10%时,因除臭菌均是好气性的,随着麸皮添加量的增加,新鲜猪粪的透气性增加,除臭菌的代谢活动和繁殖力加快,除臭功能增强。当麸皮的添加量高于10%时,氨气和硫化氢的释放量增加,其原因可能是过量的麸皮在微生物的作用下发酵分解形成一定的产物[5,7,9,15]对除臭反应有抑制作用。氨气和硫化氢的减少机理及发酵后续产物还待进一步研究,优化得到的最佳除臭发酵条件可为除臭制剂的研发和生产提供依据和参考。
4 结论
1)本研究通过改进优化筛选方法后,筛选出可高效抑制猪粪中氨气和硫化氢释放的菌株5株和3株,其中命名为BX3的菌株,对氨气和硫化氢的去除率达80.07%和76.92%。2)优化得到的高效除臭组合菌群对氨气和硫化氢的去除率达82.14%和80.84%。3)研究优化发酵条件,在接种量分别为10%和15%,含水率40%和30%,麸皮添加量为10%时氨气和硫化氢的释放量最小,除臭微生物更好的发挥除臭性能。
[1]FAO.World Livestock 2011-Livestock in Food Security[M].Rome:Food and Agriculture Organization of the United Na-tions,2011:93-94.
[2]Zhang T,Bu M D,Geng W,et al.Pollution status and biogas-producing potential of livestock and poultry excrements in China.Chinese Journal of Ecology,2012,31(5):1241-1249.
[3]Xu M Y.A review of grassland carrying capacity:perspective and dilemma for research in China on“forage-livestock balance”.Acta Prataculturae Sinica,2014,23(5):321-329.
[4]Gwyther C L,Williams A P,Golyshin P N,et al.The environmental and biosecurity characteristics of livestock carcass disposal methods:a review.Waste Management,2011,31:767-778.
[5]Chen X G,Geng A L,Yan R,et al.Isolation and characterization of sulphur-oxidizing Thiomonas sp.and its potential application in biological deodorization.Letters in Applied Microbiology,2004,39:495-503.
[6]Wang D W,Yao T,Yang Q L,et al.Screening and degradation characterization of efficient and stable cellulose degrading microbial communities.Acta Prataculturae Sinica,2014,23(2):253-259.
[7]Elmrini H,Bredin N,Shareefdeen Z,et al.Biofiltration of xylene emissions:bioreactor response to variations in the pollutant inlet concentration and gas flow rate.Chemical Engineering Journal,2004,100:149-158.
[8]Li B,Xiong Y.Isolation and identification deoder microorganism to the swine manure.Acta Ecologiae Animalis Domastici,2008,29(1):74-76.
[9]Li S S,Guo X J,Zhang A M,et al.Isolation of deodorization microorganism for fermentation bed identification of strain Z-22.Journal of Agricultural University of Hebei,2012,35(4):65-69.
[10]Ransbeeck N V,Langenhove H V,Demeyer P.Indoor concentrations and emissions factors of particulate matter,ammonia and greenhouse gases for pig fattening facilities.Biosystems Engineering,2013,116:518-528.
[11]Meinen R J,Kephart K B,Graves R E.Economic feasibility and evaluation of a novel manure collection and anaerobic digestion system at a commercial swine finisher enterprise.Biomass and Bioenergy,2014,63:10-21.
[12]Ni J Q,Heber A J,Sutton A L,et al.Effect of swine manure dilution on ammonia,hydrogen sulfide,carbon dioxide,and sulfur dioxide releases.Science of the Total Environment,2010,408:5917-5923.
[13]Nanda S,Sarangi P K,Abraham J.Microbial biofiltration technology for odour abatement.International Research Journal of Microbiology,2011,2(11):415-422.
[14]Yin D X,Liu W,Zhai N N,et al.Anaerobic digestion of pig and dairy manure under photo-dark fermentation condition.Bioresource Technology,2014,166:373-380.
[15]Gao H M,Wu D,Liu C L.The optimization of medium and condition for the deodorization microorganism 7NC.Acta Ecologiae Animalis Domastici,2011,32(1):54-57.
[16]Zhao B,He S J.Microbiology Experiment[M].Beijing:Science Press,2002:30-33.
[17]Ma W B,Yao T,Wang G J,et al.Assessment of rhizobacteria strains for Vicia sativa.Acta Prataculturae Sinica,2014,23(5):241-248.
[18]Terence R,Whitehead,Michael A,et al.Isolation and identification of hyper-ammonia producing bacteria from swine manure storage pits.Current Microbiology,2004,48:20-26.
[19]Liu Z,Powers W,Murphy J,et al.Ammonia and hydrogen sulfide emissions from swine production facilities in North A-merica:a meta-analysis.American Society of Animal Science,2014,92:1656-1665.
[20]Jiang C.Studies on Screening,Characterization and Identification of Efficient Deodorizing Microorganism[D].Shantou:Shantou University,2012.
[21]Bernardo P,Mehdi N,Sarah S,et al.Control of H2S emission from swine manure using Na-nitrite and Na-molybdate.Journal of Hazardous Materials,2008,154:300-309.
[22]Yan Z Y,Liu X F,Yuan Y X,et al.Deodorization study of the swine manure with two yeast strains.Biotechnology and Bioprocess Engineering,2013,18:135-143.
[23]Li J L,Zhang X Q,Yu Z.Effects of moisture content and lactic acid bacteria additive on the quality of Italian ryegrass silage.Acta Prataculturae Sinica,2014,23(6):342-348.
[24]Shen P,Chen X D.Microbiology Experiment[M].Beijing:Higher Education Press,2007.
[25]Chen L Y,Wu D,Xia L Z,et al.Isolating and screening of deodorant microbial of pig livestock and poultry manure.Animal Husbandry and Veterinary Medicine,2008,40(12):59-61.
[26]Gao Y,Chu W W,Zhang X,et al.Isolation and determination of growth curve of deoderizing microorganism from swine manure.Journal of Mountain Agriculture and Biology,2011,30(1):47-51.
[27]Jiang X,Luo Y Q,Yan R,et al.Impact of substrates acclimation strategy on simultaneous biodegradation of hydrogen sulfide and ammonia.Bioresource Technology,2009,100:5707-5713.
[28]Zhao C X,Lan S L,Yu Y J,et al.Microorganisms screened from chicken manure and their application.Hunan Agricultural Sciences,2005,(1):68-70.
[29]Yu H C,Zhang Q M,Hou S Y,et al.Optimized cultivation of highly-efficient deodorizing bacterial consortia and their degradation ability towards pyrene.Journal of Agro-Environment Science,2004,23(2):300-303.
[30]Wang X H,Zhang Y,Peng X R,et al.Isolation and characteristics of a bacterial strain for deodorization of dimethyl sulfide.Procedia Environmental Sciences,2011,11:1189-1196.
[31]Frauke H K,Angelika H,Eberhard H,et al.Reduction of ammonia emissions from dairy manure using novel urease inhibitor formulations under laboratory conditions.Biosystems Engineering,2015,130:43-51.
参考文献:
[2]张田,卜美东,耿维,等.中国畜禽粪便污染现状及产沼气潜力.生态学杂志,2012,31(5):1241-1249.
[3]徐敏云.草地载畜量研究进展:中国草畜平衡研究困境与展望.草业学报,2014,23(5):321-329.
[6]王得武,姚拓,杨巧丽,等.高效稳定纤维素分解菌群筛选及其分解特性研究.草业学报,2014,23(2):253-259.
[8]李彪,熊焰.猪粪中除臭微生物的筛选和鉴定.家畜生态学报,2008,29(1):74-76.
[9]李珊珊,郭晓军,张爱民,等.发酵床除臭微生物的筛选与Z-22菌株的鉴定.河北农业大学学报,2012,35(4):65-69.
[15]高红梅,吴东,刘朝良.除臭微生物7NC培养基和培养条件的优化.家畜生态学报,2011,32(1):54-57.
[16]赵斌,何绍江.微生物学实验[M].北京:科学出版社,2002:30-33.
[17]马文彬,姚拓,王国基,等.根际促生菌筛选及其接种剂对箭筈豌豆生长影响的研究.草业学报,2014,23(5):241-248.
[20]江晨.高效除臭微生物的筛选、特性研究及其鉴定[D].汕头:汕头大学,2012.
[23]李君临,张新全,玉柱.含水量和乳酸菌添加剂对多花黑麦草青贮品质的影响.草业学报,2014,23(6):342-348.
[24]沈萍,陈向东.微生物学实验[M].北京:高等教育出版社,2007.
[25]陈丽园,吴东,夏伦志,等.畜禽粪便除臭微生物的分离与筛选.畜牧与兽医,2008,40(12):59-61.
[26]高颖,褚维伟,张霞,等.猪粪除臭微生物筛选及其生长曲线测定.山地农业生物学报,2011,30(1):47-51.
[28]赵晨曦,兰时乐,禹逸君,等.鸡粪除臭微生物菌群的筛选和应用.湖南农业科学,2005,(1):68-70.
[29]余海晨,张清敏,侯树宇,等.高效除臭菌的筛选及其降解特性研究.农业环境科学学报,2004,23(2):300-303.

