树突状细胞在抗肿瘤免疫治疗中的研究进展
李 帅,马建波
·综 述·
树突状细胞在抗肿瘤免疫治疗中的研究进展
李 帅,马建波
树突状细胞(dendritic cell,DC)是机体内强大的抗原提呈细胞,在机体特异性免疫应答过程中发挥着重要的作用。DC在机体抗肿瘤中的作用,尤其是2010年第1个以DC为基础的DC疫苗产品(Sipuleucel-T或Provenge)获得美国食品和药品管理局批准用于治疗前列腺癌以来,以DC为基础的肿瘤免疫治疗正成为国内外研究的热点之一。作者对DC疫苗在抗肿瘤免疫治疗中的应用进展作一综述。
树突状细胞疫苗;肿瘤;免疫治疗
当今肿瘤已经成为人类健康的第一杀手,据不完全统计,全世界每年新发肿瘤约1 270万例,因肿瘤死亡超过670万例[1]。在我国,恶性肿瘤发病率已经超过心脑血管疾病,高居我国居民病死原因首位[2]。传统治疗恶性肿瘤的三大方式即手术治疗、化疗和放疗,对于多种肿瘤的治疗已经取得巨大的进展和成就,但在肿瘤的复发和转移、放化疗的不良反应方面仍存在挑战。随着对肿瘤学和免疫学研究的深入,肿瘤的免疫治疗逐渐成为继三大治疗方式之后的又一大新治疗方式,其中肿瘤疫苗成为免疫治疗的新星。
树突状细胞(dendritic cell,DC)起源于造血干细胞,是目前发现的一类功能最强大的并可以激活未致敏初始型T细胞抗原提呈细胞[3],因此DC也被称为是免疫系统的“哨兵”。大量的研究已经证明了DC在肿瘤形成、进展以及机体抗肿瘤中的作用[4-8],尤其是2010年第1个以DC为基础的DC疫苗产品(Sipuleucel-T或Provenge)获得美国食品和药品管理局批准用于治疗前列腺癌以来,以DC为基础的肿瘤免疫治疗正成为国内外研究的热点之一,目前已经有大量的研究处于不同阶段的临床试验中。作者就DC疫苗在抗肿瘤免疫治疗中的应用进展作一综述。
1 肿瘤DC疫苗的研究和应用
自从20世纪90年代中期第1例以DC为基础的肿瘤临床试验以来,大量的临床研究聚焦以DC为基础肿瘤治疗。目前,在全球范围内已经获得批准上市的DC肿瘤疫苗有Hybricell(巴西Genoa Biotechnologia公司)、Crea VaxRCC(韩国CreaGene公司)和Sipuleucel-T(美国Dendreon公司)。而在www.clinicaltrials.gov官网上登记注册的以DC为基础的临床试验数量多达数百项,其中仅Ⅱ期、Ⅲ期临床试验就有数十项之多。涉及的肿瘤包括黑色素瘤、前列腺癌、乳腺癌、恶性胶质瘤、肺癌、肾细胞癌、淋巴瘤、白血病等,涉及的DC疫苗制备方法有肿瘤裂解物或合成肿瘤相关抗原体外共培养法、肿瘤相关抗原或免疫分子体外转染法、体外肿瘤细胞融合DC法等,抗原有前列腺酸性磷酸酶、纽约食管鳞癌、C型凝集素结构域家族9的A成员、肿瘤蛋白p185、CD133、黑色素瘤相关抗原-A3、黑色素瘤相关抗原-C1、肾母细胞瘤蛋白-1、叶酸受体-1以及自体肿瘤裂解物、自体肿瘤RNA等,有采用单一肿瘤抗原的,也有联合采用多种肿瘤抗原的。近几年DC疫苗部分Ⅲ期临床试验见表1。
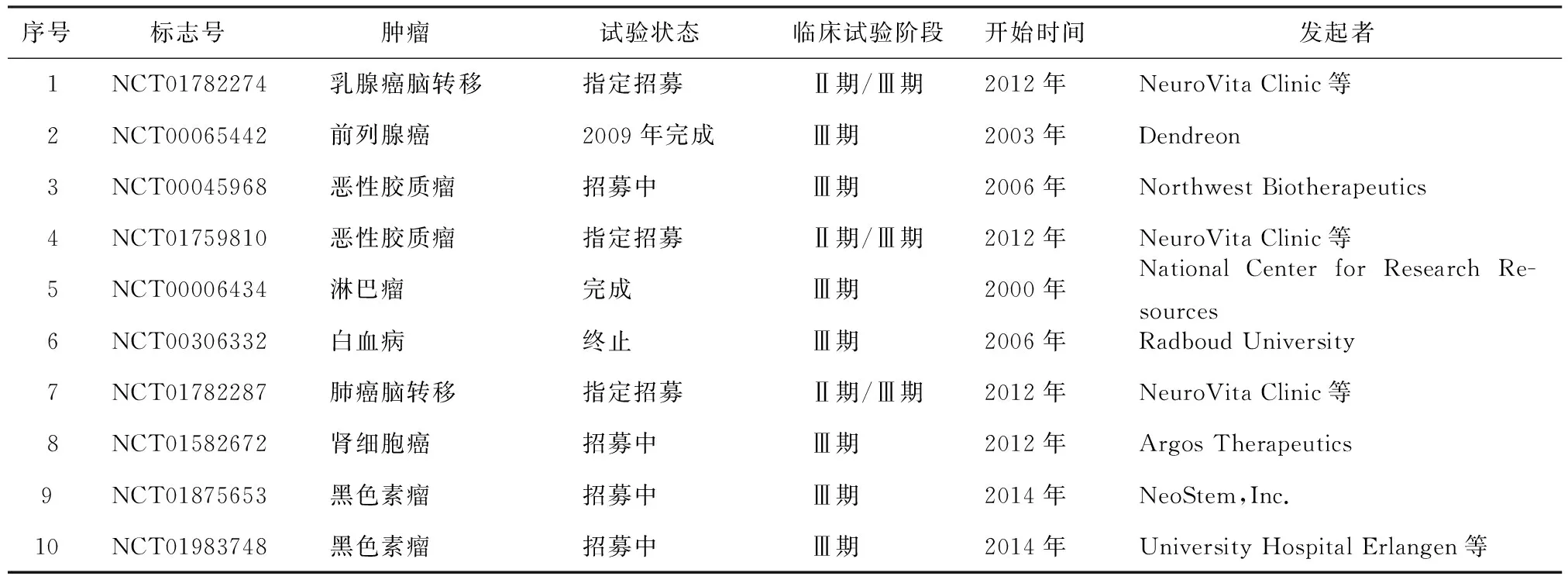
表1 部分进入Ⅲ期临床试验的肿瘤DC疫苗项目
2 肿瘤DC疫苗的安全性
Draube等[9]通过对相关试验的系统性回顾性研究表明,基于DC疫苗肿瘤治疗的最常见不良反应是注射部位的红肿、疼痛和瘙痒等局部反应,这些常见的反应一般都比较轻微、温和并可以自限性,但有些患者也会发生发热、身体不适的感冒样全身症状。与传统的放化疗不良反应以及其他诸如免疫检查点抑制剂药物治疗、嵌合抗原受体修饰T细胞治疗的免疫治疗方法相比较,重度免疫性肠炎、胸腹水、移植物抗宿主反应、细胞因子风暴、甚至致死等不良反应在肿瘤DC疫苗治疗中极为罕见。DC疫苗单独应用具有良好的安全性和耐受性。
3 肿瘤DC疫苗的有效性及评估方法
评估肿瘤DC疫苗的另一个重要指标就是其有效性,而肿瘤的疗效评价体系是评估临床肿瘤治疗方法是否有效的参考依据。常用的肿瘤疗效评价方法有生活质量、免疫状态、客观反应率、生存期等,其中生存期是肿瘤临床研究中常用的疗效评估标准。
3.1 生活质量 生活质量是评估抗肿瘤治疗药物和治疗方法有效性的重要指标之一,这一指标对于晚期的、无适当治疗方法的肿瘤患者尤为重要。Klechevsky等[10]通过对接受DC疫苗治疗的肾细胞癌患者研究表明,与现有的其他治疗方法明显的不良反应不同,基于DC的免疫治疗不会损害患者的生活质量。国内学者研究也证实DC治疗单独应用或联合细胞因子诱导杀伤细胞治疗时可以有效改善肿瘤患者的生活质量[11]。
3.2 免疫状态 DC疫苗的基本治疗原理和目标是通过DC细胞激活相应的肿瘤抗原特异性T淋巴细胞,后者在体内发挥识别并抗肿瘤作用,所以机体的免疫学指标理论上是评估DC疫苗等免疫治疗方法的可靠指标。这类指标常包括肿瘤相关抗原、外周血淋巴细胞分群、机体体液免疫和细胞免疫应答等。有关DC疫苗治疗三阴性乳腺癌的多中心临床研究表明,DC疫苗可以有效诱导机体的免疫应答,Ⅰ~Ⅲ期三阴性乳腺癌患者DC免疫治疗1个疗程后,白介素-2、γ-干扰素(interferon-gamma,IFN-γ)和肿瘤坏死因子-α水平较治疗前显著升高,且随着疗程增加其水平不断升高,但该现象在Ⅳ期患者中并未出现;同时,Ⅰ~Ⅲ期三阴性乳腺癌患者外周血中CD8+IFN-γ+T细胞比例的提升幅度和速度较慢,但在治疗3个疗程后显示出统计学意义[12]。Tada等[13]有关DC疫苗治疗肝癌的临床研究表明,患者显示出强的抗原特异性T细胞应答,抗原特异性IFN-γ分泌性细胞在第1个疗程后最早10周达峰值。但越来越多的研究支持新观点,即基于外周血淋巴细胞分群的检测并不能最准确地反应患者机体对肿瘤的免疫状态,这在早期肿瘤患者中尤为重要,而肿瘤组织内部微环境中免疫状态则是更好的指标。
3.3 客观反应率 客观反应率是肿瘤疗效评价的重要标准。常用的肿瘤治疗客观反应率标准有世界卫生组织(World Health Organization,WHO)制定的实体瘤疗效评价统一标准即WHO标准(1981年发表)、欧洲癌症研究与治疗组织和美国国立癌症研究所联合制定并于2000年发表的实体肿瘤的疗效评价标准(response evaluation criteria in solid tumors,RECIST)、很多基于RECIST的演进版本、专为免疫治疗制定的免疫相关的疗效评价标准。其中RECIST目前使用最为广泛,2009年RECIST更新为1.1版。肿瘤大小是这类标准的重要参数,根据肿瘤大小和进展情况可以将疗效分为完全缓解、部分缓解、稳定和进展。
尽管以DC为基础的免疫治疗具有良好的安全性,并且证明可以诱导体内免疫应答,但以客观反应率为疗效评估标准,临床研究的结果却表现不一,研究的治疗客观反应率并不如预期的理想14-15]。Anguille等[16]对一些已经发表的基于DC疫苗的肿瘤临床试验进行研究得出结论,基于DC的免疫治疗的客观反应率是真实存在的,但反应率很小,在黑色素瘤患者中为8.5%、前列腺癌为7.1%、肾细胞癌为11.5%、神经胶质瘤为15.6%。尽管客观反应率标准具有相对快速和直接的优点,但其可能并不能真实反应肿瘤免疫治疗的客观疗效。Anguille等发现的以DC为基础的肿瘤免疫治疗的反应率小则可能与评估指标自身的局限性有关,也可能与进入其研究的临床试验项目有关,此外也可能提示整体上目前的这些DC治疗方法在单独使用时其效果本身就比较温和。另一方面,对于结论为治疗客观反应率高的临床免疫治疗研究,也可能需要再综合生存期等其他指标进行更科学的评估。
3.4 生存期 即患者的生存时间,根据评估的具体方法不同又可分为总生存期、平均生存期、中位生存期、无进展生存期、无复发生存期等。生存期,尤其是总生存期仍然是评估肿瘤治疗疗效的金标准,大多DC疫苗的临床研究[17-22]采用了生存期作为疗效评估方法。如已经通过美国食品和药品管理局批准的Sipuleucel-T[20],其治疗的中位生存期为25.8个月,优于对照组的21.7个月(P<0.05)。
总之,这些肿瘤疗效评估方法各有优势和局限性,同一个DC疫苗的临床研究采用不同的评估方法可能会得出不同的疗效结论,所以在实际应用中需要将这些不同方法结合使用。例如基于肿瘤大小的WHO标准或RECIST除了不太合适用于评价非外周生长型肿瘤和空腔脏器肿瘤的研究外,对一些基于分子靶向药物、免疫治疗的治疗方案效果评价也具有明显的局限性,常常难以客观真实评价疗效[23-24],需要结合生存期指标和新的针对免疫治疗的评估指标。
4 肿瘤DC疫苗的研究新趋势
尽管肿瘤DC疫苗具有良好的安全性、可以诱导良好的体内免疫应答,但人体免疫系统的中枢性耐受机制及肿瘤微环境内部特殊的免疫抑制状态,使得多种试验的肿瘤DC疫苗实际治疗效果并不如预期的理想。因此,一些国际大型制药企业终止了一些DC疫苗项目,比如2014年默克公司停止了对于应用于非小细胞肺癌的黏蛋白-1抗原特异性的疫苗Tecemotide的开发、葛兰素史克公司取消在非小细胞肺癌中使用肽段疫苗黑色素瘤相关抗原-A3的计划。而研发新型的高效肿瘤DC疫苗,采用联合免疫治疗方法、通过建立科学的预后评估方法来筛选更为合适接受肿瘤DC疫苗治疗的患者以及建立科学的疗效测评体系可能是有效提高肿瘤DC疫苗治疗效果的途径。
4.1 研发新型DC疫苗 传统肿瘤DC疫苗使用的肿瘤抗原大多是肿瘤相关抗原,即表达于肿瘤组织、也表达于机体正常组织的一类抗原,由于免疫系统的先天耐受机制,尤其是中枢性耐受,致使人体内缺乏(或极其微弱)针对这类共表达于自身组织抗原的特异性免疫能力,尽管联合使用一些免疫佐剂可以在一定程度上改善这微弱免疫能力,如Mitchell等[25]研究证明利用破伤风加强剂来刺激免疫系统可以增强疫苗疗效,显著改善了患者的生活质量。将来,根据肿瘤细胞基因突变而设计的新型个性化肿瘤DC疫苗有望可以克服这类免疫反应低下状况,成为一类潜力巨大的新型肿瘤DC疫苗。
4.2 联合免疫治疗方法 人体免疫系统的中枢性耐受机制及肿瘤微环境内部特殊的免疫抑制状态,使得单独应用肿瘤DC疫苗的疗效可能不如预期的理想,而联合免疫治疗可能是有效的方法。这不仅仅是传统的放疗、化疗与DC疫苗间的联合应用,还包括多种肿瘤抗原的联合应用以及不同种类免疫治疗方法的联合应用,如免疫检查点抑制剂和DC疫苗的联合应用将成为DC疫苗应用研究的一个热点。
4.3 建立科学的预后评估和疗效测评体系 由于免疫治疗不同于传统治疗方法的独特作用机制,传统的临床肿瘤分期方法不能很好地适用于肿瘤免疫治疗方法;同样,传统的WHO标准、RECIST也并不能完全真实地反应免疫治疗的客观疗效。所以,研究建立适用于肿瘤免疫治疗的科学高效预后评估体系和疗效测评体系可以直接或间接地提高肿瘤患者的治疗效果,也正成为肿瘤免疫治疗领域研究的另一热点。
5 展望
肿瘤免疫治疗已经逐渐成为肿瘤治疗的新方向,并有望成为攻克一些肿瘤复发和转移难题的方法。尽管肿瘤DC疫苗现在仍存在一些亟待改进的问题,但随着肿瘤免疫学基础研究的进展,尤其是对实体瘤内部肿瘤微环境的深入研究,新型DC疫苗的研发、多种联合免疫治疗方案的优化以及科学高效的适合肿瘤免疫治疗的预后评估体系和疗效测评体系的建立,肿瘤DC疫苗以及其他的免疫治疗方法将会使肿瘤免疫治疗取得新的突破,让广大肿瘤患者获益。
[1]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2]国家卫生和计划生育委员会.2013中国卫生和计划生育统计提要[M].中国协和医科大学出版社,2013.
[3]Banchereau J,Steinman RM.Dendritic cells and the control of immunity[J].Nature,1998,392(6673):245-252.
[4]Kroemer G,Galluzzi L,Kepp O,et al.Immunogenic cell death in cancer therapy[J].Annu Rev Immunol,2013,31:51-72.
[5]Zitvogel L,Tesniere A,Kroemer G.Cancer despite immunosurveillance:immunoselection and immunosubversion[J].Nat Rev Immuno,2006,6(10):715-727.
[6]Schreiber RD,Old LJ,Smyth MJ.Cancer immunoediting:integrating immunity′s roles in cancer suppression and promotion[J].Science,2011,331(6024):1565-1570.
[7]Galluzzi L,Senovilla L,Zitvogel L,et al.The secret ally:immunostimulation by anticancer drugs[J].Nat Rev Drug Discov,2012,11(3):215-233.
[8]Zitvogel L,Galluzzi L,Smyth MJ,et al.Mechanism of action of conventional and targeted anticancer therapies:reinstating immunosurveillance[J].Immunity,2013,39(1):74-88.
[9]Draube A,Klein-González N,Mattheus S,et al.Dendritic cell based tumor vaccination in prostate and renal cell cancer:a systematic review and meta-analysis[J].PLoS One,2011,6(4):e18801.
[10]Klechevsky E,Flamar AL,Cao Y,et al.Cross-priming CD8+ T cells by targeting antigens to human dendritic cells through DCIR[J].Blood,2010,116(10):1685-1697.
[11]徐杰,陆华,吴卫江,等.人脑胶质瘤树突状细胞疫苗的临床应用[J].江苏医药,2012,38(10):1193-1196.
[12]时伟峰,唐金海,孟东,等.负载自体热休克凋亡癌细胞抗原的DC治疗三阴性乳腺癌的随机对照多中心临床试验[J].中国肿瘤生物治疗杂志,2014,21(3):237-243.
[13]Tada F,Abe M,Hirooka M,et al.Phase Ⅰ/Ⅱ study of immunotherapy using tumor antigen-pulsed dendritic cells in patients with hepatocellular carcinoma[J].Int J Oncol,2012,41(5):1601-1609.
[14]Rosenberg SA,Yang JC,Restifo NP.Cancer immunotherapy:moving beyond current vaccines[J].Nat Med,2004,10(9):909-915.
[15]Huber ML,Haynes L,Parker C,et al.Interdisciplinary critique of sipuleucel-T as immunotherapy in castration-resistant prostate cancer[J].J Natl Cancer Inst,2012,104(4):273-279.
[16]Anguille S,Smits EL,Lion E,et al.Clinical use of dendritic cells for cancer therapy[J].Lancet Oncol,2014,15(7):e257-e267.
[17]Tjoa BA,Erickson SJ,Bowes VA,et al.Follow-up evaluation of prostate cancer patients infused with autologous dendritic cells pulsed with PSMA peptides[J].Prostate,1997,32(4):272-278.
[18]Dillman R,Selvan S,Schiltz P,et al.Phase Ⅰ/Ⅱ trial of melanoma patient-specific vaccine of proliferating autologous tumor cells,dendritic cells,and GM-CSF:planned interim analysis[J].Cancer Biother Radiopharm,2004,19(5):658-665.
[19]Kyte JA,Mu L,Aamdal S,et al.Phase Ⅰ/Ⅱ trial of melanoma therapy with dendritic cells transfected with autologous tumor-mRNA[J].Cancer Gene Ther,2006,13(10):905-918.
[20]Kantoff PW,Higano CS,Shore ND,et al.Sipuleucel-T immunotherapy for castration-resistant prostate cancer[J].N Engl J Med,2010,363(5):411-422.
[21]Ellebaek E,Engell-Noerregaard L,Iversen TZ,et al.Metastatic melanoma patients treated with dendritic cell vaccination,Interleukin-2 and metronomic cyclophosphamide:results from a phase Ⅱ trial[J].Cancer Immunol Immunother,2012,61(10):1791-1804.
[22]Vik-Mo EO,Nyakas M,Mikkelsen BV,et al.Therapeutic vaccination against autologous cancer stem cells with mRNA-transfected dendritic cells in patients with glioblastoma[J].Cancer Immunol Immunother,2013,62(9):1499-1509.
[23]Erasmus JJ,Gladish GW,Broemeling L,et al.Interobserver and intraobserver variability in measurement of non-small-cell carcinoma lung lesions:implications for assessment of tumor response[J].J Clin Oncol,2003,21(13):2574-2582.
[24]Zhao B,Schwartz LH,Moskowitz CS,et al.Lung cancer:computerized quantification of tumor response - - initial results[J].Radiology,2006,241(3):892-898.
[25]Mitchell DA,Batich KA,Gunn MD,et al.Tetanus toxoid and CCL3 improve dendritic cell vaccines in mice and glioblastoma patients[J].Nature,2015,519(7543):366-369.
Advances of dendritic cell in cancer immunotherapy
LIShuai1,MAJianbo2
(1.Zhongzhengdaohe (Bejing) Bio-Technology Co., Beijing 100176, China;2.Beijing Initiative Biological Technology Co., Beijing 101111, China)
Dendritic cell(DC) is a kind of powerful professional antigen presenting cells in human, which plays a key role in the antigen specific immune response. Plenty of researches have proved the important role of DC in anti-cancer activity. Since the first DC-based product named Sipu-teucel-T or Provenge was licensed for treating the prostate cancer in 2010, especially the DC-based immunotherapy has been the one of the "hotspots" of anticancer research. We here summarize recent advances in the clinical research of DC-based anticancer immunotherapy.
Dendritic cell vaccine; Tumors; Immunotherapy
100176 北京,中政道和(北京)生物科技有限公司(李帅);101111 北京,北京先机生物科技有限公司(马建波)
马建波,E-mail:1020850105@qq.com
R329.2+4;R73
A
2095-3097(2015)03-0178-04
10.3969/j.issn.2095-3097.2015.03.014
2015-04-18 本文编辑:徐海琴)

