大鼠原位气管移植模型的建立
段鸿涛,黄 勋,刘宏刚,闫小龙,李小飞
大鼠原位气管移植模型的建立
段鸿涛,黄 勋,刘宏刚,闫小龙,李小飞
目的建立同种异体大鼠原位气管移植模型,为研究者提供可参考的建立模型的步骤。方法将10只SD大鼠气管作为供体,质量匹配后原位移植入20只SD大鼠体内。于移植后第10天取移植气管样本做苏木素和伊红染色及马松染色,观察上皮覆盖、纤维化程度。结果大鼠气管移植模型手术存活19例,从样本采集到手术成功用时(65±15) min。10 d后取材,苏木素和伊红染色可见上皮覆盖杂乱,但上皮覆盖完整;马松染色可见上皮下纤维沉积。结论新建的大鼠气管移植模型可以用于气管移植相关领域的研究,可避免操作繁复、不能模拟呼吸运动引起的气管活动及气流的影响,避免异位移植容易出现的移植气管机化。
气管移植;动物模型;大鼠
通用的大鼠气管移植模型可以分为气管原位移植模型和异位移植模型[1]。异位移植模型术式主要为将气管埋藏于大鼠腹腔大网膜以及大鼠背部皮下[2]。研究表明,原位移植和异位移植产生不同的病理结果,异位移植模型病理变化可作为闭塞性细支气管炎研究的动物模型[3]。但异位移植模型不能模拟呼吸运动引起的气管活动及气流的影响,同时异位移植容易出现移植气管机化,对于实验研究有诸多限制[4]。原位移植因为技术问题,显微外科器械的限制等原因,国内开展相关研究较少。本实验目的是为我国研究者提供一种可以在非显微外科器械条件下进行的大鼠气管原位移植手术方法。
1 材料与方法
1.1 实验动物 健康SD大鼠30只,8周龄,购自第四军医大学动物实验中心[SCXK-(军)2007-007],随机挑取10只作为供体,另20只作为受体。
1.2 实验设备和材料 眼科剪、眼科直镊、眼科弯镊、眼科持针器、6-0和5-0的带线手术缝合针(山东蓝矾新材料有限公司),5-0和3-0的手术缝线(山东蓝矾新材料有限公司)。地塞米松磷酸钠注射液(阿斯利康制药有限公司)、盐酸东莨菪碱注射液(阿斯利康制药有限公司)、青霉素钠注射液(阿斯利康制药有限公司),胎牛血清(fetal borine serum,FBS,美国Hyclone公司),达尔伯克改良伊格尔培养基(Dulbecco′s modification Eagle′s medium,DMEM,美国Hyclone公司)。
1.3 获取供体气管 SD大鼠用0.3%戊巴比妥钠2 mL/kg腹腔注射麻醉。在甲状骨上方到纵隔入口处做颈正中切口,切口延至胸骨柄和胸骨,进而完成胸骨切开术。分离气管周围组织,取下完整供体气管,用生理盐水冲洗后,暂存于10% FBS的DMEM中。供体气管切制成长度为5~6软骨环,每一部分移植入一受体大鼠。
1.4 同种原位气管移植动物模型 ①将SD大鼠用0.3%戊巴比妥钠2 mL/kg腹腔注射麻醉,并给予地塞米松磷酸钠注射液、盐酸东莨菪碱注射液腹腔注射。②在甲状软骨上方约0.5 cm处做颈前正中切口(图1A)。③解剖颈前筋膜,保护颌下腺,暴露胸骨舌骨肌(图1B)。④正中钝性分离胸骨舌骨肌,并用3-0的缝线将胸骨舌骨肌固定于颈前筋膜(图1C);将胸骨乳突肌正中向下和气管软骨环用5-0的缝线缝合,用以固定气管,防止气管离断后气管挛缩引起大鼠窒息(图1D)。⑤分离气管包膜,暴露气管,保护气管食管沟的动脉血管。在气管甲状软骨以下3~4个环处离断气管,确保离断切口平整(图1E)。⑥取供体气管,缝合远端。在气管“U”型环肌膜部5点方向用6-0缝线做断端缝合,打结以确保两断端气管紧贴为宜。同样方法缝合7点,然后依次从气管3点、12点、9点各缝合1针(图1F)。⑦近端气管缝合。在气管5点、7点做间断缝合,逆行性插入小鼠12号灌胃针做引导针(图1G),从口腔放入气管插管,注意保护气管,防止机械损伤(图1H)。依次从气管3点、12点、9点各缝合1针(图1I)。⑧间断缝合胸骨舌骨肌(图1J)。⑨间断缝合颈前筋膜(图1K)。⑩间断缝合皮肤,75%乙醇消毒(图1L)。术后2 h,大鼠清醒前保持头低脚高位,清醒后,拔出气管插管。术后3 d青霉素钠注射液30×104U/kg腹腔注射[5]。

图1手术操作
1.5 评价方法 苏木素和伊红(hematoxylin and eosin,HE)染色及马松染色评价上皮生长、纤维化程度。
2 结果
2.1 生存率 受体大鼠手术后存活率为95%,模型从样本采集到手术成功用时(65±15) min;1只大鼠术中因窒息死亡,气管内和口鼻中可见大量的粉红色泡沫痰。大鼠1只于术后9 d死于气管内大量的脓性分泌物,同时肺部有大量肺脓肿;另1只于术后10 d死于大量的呼吸道黏液性分泌物。移植模型中,大鼠最长存活时间为6个月,生命体征平稳,但有轻度的吸气性呼吸困难。
2.2 HE染色 术后10 d,与正常大鼠气管相比(图2A),气管移植体可见大量炎性细胞浸润(图2B);上皮覆盖杂乱,但上皮覆盖完整;气管纤毛明显脱落,上皮层变薄,黏膜固有层变厚(图2C);同时可见团块状纤毛形成,上皮发生聚集现象,气管上皮层杂乱(图2B)。术后90 d,可见气管黏膜上皮脱落,甚至消失,大量纤维沉积,气管管腔发生严重堵塞(图2D)。
2.3 马松染色 术后10 d,与正常大鼠气管相比(图2E)移植段气管纤维沉积,黏膜固有层明显变厚(图2F)。
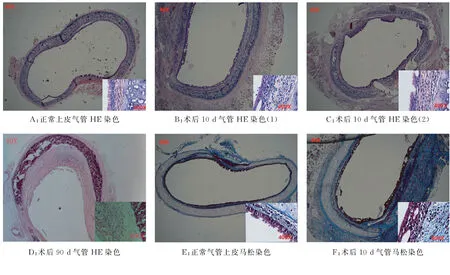
A:正常上皮气管HE染色B:术后10d气管HE染色(1)C:术后10d气管HE染色(2)D:术后90d气管HE染色E:正常气管上皮马松染色F:术后10d气管马松染色图2 气管HE染色和马松染色
图2 气管HE染色和马松染色
3 讨论
本实验成功实施了20只大鼠原位气管移植手术,术后总体存活率为95%。移植后大鼠最长存活时间为6个月。与异位气管移植模型相比,原位气管移植避免了异位气管移植不能通气、没有活动度不能完全模拟气管呼吸运动与环境的缺点[6]。
在建模过程中,首先建立的是同系移植模型(SD-SD大鼠),避免了免疫排斥反应;之后,又采用胸骨舌骨肌间断缝合包绕气管的方法,可以使得胸骨舌骨肌间接给予气管血供,这样很好地解决了气管移植后血供不足的问题[7]。
在本实验过程中,19只大鼠术后生命体征平稳,生存状态良好,仅有2只在术后死亡。1只于移植术后9 d死于气管脓肿及肺脓肿,可能是因为在移植后,破坏了气管内正常的解剖结构,破坏了气管内黏膜上皮,使其失去了黏膜屏障保护功能;同时,气管黏膜损伤后,黏液性分泌物增多[8],增加了呼吸道微生物滋生的可能性,最后形成气管脓肿及肺脓肿。另1只于移植术后10 d死于气管内黏液性分泌物,分泌物的来源可能是来自头颈部的大腺体,也可能因为呼吸道的正常结构破坏后,增加了呼吸道黏膜的分泌功能[9]。在实验中观察到,当受体大鼠出现明显的吸气性呼吸困难时,给予盐酸氨溴索注射液后,大鼠相应的症状就有明显的减轻,由此推测分泌物来自于呼吸道分泌物增多的可能性大。另外,因为手术,大鼠咳嗽反射抑制,无法正常将分泌物咳出,最终形成窒息。HE染色示大鼠气管黏膜上皮杂乱,在术后10 d HE染色可见团块状纤毛形成,可能是因为大鼠上皮在移植后再生形成不规则结构[10],术后10 d大鼠气管黏膜固有层变厚。术后90 d可见大鼠气管管腔大量纤维沉积,气管管腔堵塞。术后10 d,马松染色也显示气管黏膜下纤维沉积,证实大鼠发生了呼吸道梗阻。在组织染色中,没有见到气管外周以及周围组织出现机化现象。
通过本实验研究,建立了一种良好的用于气管原位移植的大鼠模型,它可以完全模拟气管呼吸引起的作用,在研究气管原位移植后的相关病理机制中将会发挥重要作用。
[1]赵晋波,李小飞,刘锟,等.同种异体近交系小鼠原位气管移植模型的建立[J].第四军医大学学报,2007,28(6):540-543.
[2]Fernández FG,McKane B,Marshbank S,et al.Inhibition of obliterative airway disease development following heterotopic murine tracheal transplantation by costimulatory mole-cule blockade using anti-CD40 ligand alone or in combination with donor bone marrow[J].J Heart Lung Transplant,2005,24(7 Suppl):S232-S238.
[3]何建行,梁兆煜,杨运有,等.同种异体气管移植一例[J].中华外科杂志,2000,38(8):595-597.
[4]Zhao Y,Steidle JF,Upchurch GR,et al.Prevention of the second stage of epithelial loss is a potential novel treatment for bronchiolitis obliterans[J].J Thorac Cardiovasc Surg,2013,145(4):940-947.
[5]Schrepfer S,Deuse T,Hoyt G,et al.Experimental orthotopic tracheal transplantation: the Stanford technique[J].Microsurgery,2007,27(3):187-189.
[6]Fan K,Qiao XW,Nie J,et al.Orthotopic and heterotopic tracheal transplantation model in studying obliterative bronchiolitis[J].Transpl Immunol,2013,28(4):170-175.
[7]Hysi I,Kipnis E,Fayoux P,et al.Successful orthotopic transplantation of short tracheal segments without immunosuppressive therapy[J].Eur J Cardiothorac Surg,2015,47(2):e54-e61.
[8]Kuo E,Bharat A,Shih J,et al.Role of airway epithelial injury in murine orthotopic tracheal allograft rejection[J].Ann Thorac Surg,2006,82(4):1226-1233.
[9]Okazaki M,Gelman AE,Tietjens JR,et al.Maintenance of airway epithelium in acutely rejected orthotopic vascularized mouse lung transplants[J].Am J Respir Cell Mol Biol,2007,37(6):625-630.
[10]Gillen JR,Zhao Y,Harris DA,et al.Short-course rapamycin treatment preserves airway epithelium and protects against bronchiolitis obliterans[J].Ann Thorac Surg,2013,96(2):464-472.
Establishment of rat orthotopic tracheal transplant mode
DUANHongtao,HUANGXun,LIUHonggang,YANXiaolong,LIXiaofei
(Department of Thoracic Surgery, Tangdu Hospital, the Fourth Military Medical University,Xi’an Shanxi 710038, China)
Objective To establish the rat orthotopic tracheal transplant model. Methods After weight-matched,10 rats were choosen as donators, then we transplanted the tracheal to the receptors to establish orthotopic tracheal transplant model. Tracheal grafts were harvested after 10 days, histological examination using hematoxylin and eosin stain (HE) staining and masson′s staining to observe the epithelium and fibrin deposition. Results Nineteen rats were living until they were sacrificed. All surgerys were finished in (65±15) min from the collection of specimens. After ten days, the rats were killed, histological examination included HE staining and Masson′s staining. HE staining shown the epithelium were messy, but the epithelium completed; Masson′s staining showed fibers were subepithelial deposition. Conclusion The new model of rat tracheal grafts could be used to study of the tracheal transplantation. It could avoid the complicated operation and avoid to appear the organization in heterotopic transplantation. At the same time, it could simulate the effect of tracheal breathing motion and airflow.
Tracheal transplantation; Animal model; Rats
国家自然科学基金(81370115)
710038 陕西 西安,第四军医大学唐都医院胸外科(段鸿涛,黄 勋,刘宏刚,闫小龙,李小飞)
R655.3-332
A
2095-3097(2015)03-0137-04
10.3969/j.issn.2095-3097.2015.03.003
2015-03-21 本文编辑:徐海琴)

