人脂肪来源间充质干细胞的制备及其质量检验方法
陈 冲,闫俊灵,李 梁,徐 潇,丁 红,汤苏阳
人脂肪来源间充质干细胞的制备及其质量检验方法
陈 冲,闫俊灵,李 梁,徐 潇,丁 红,汤苏阳
目的 研究人脂肪来源间充质干细胞(human adipose-derived stem cells, hADSCs)的制备及其质量检验方法,为临床研究提供安全合格的干细胞。方法 取50例人吸脂术抽取的脂肪,剪碎,用胰酶和胶原酶消化、分离、培养,并按照《干细胞制剂质量控制及临床前研究指导原则》对其进行细胞形态、数量、活率、无菌、支原体、人源特定病毒及猪源病毒、内毒素、免疫抑制活性、分化能力、免疫表型等检测及染色体核型。结果 50例hADSCs;细菌、内毒素检测阴性,无内外源致病菌;干细胞免疫表型检测CD90、CD105表达阳性,阳性率>95%,CD34 、CD45和HLA-DR表达阴性,阳性率<2%;具有成骨、成脂分化潜能;能抑制异体淋巴细胞的增殖。间充质干细胞活性冻存前≥92%,冻存复苏后≥82%。结论 按照本工艺及标准制备的hADSCs符合质量控制标准,为同类干细胞制备及其检定过程标准化提供了试验依据。
脂肪干细胞;间充质干细胞;质量控制;免疫表型;分化潜能;染色体核型分析
人脂肪来源间充质干细胞(human adipose-derived stem cells, hADSCs),是从脂肪组织中分离获得的一种具有自我更新及多向分化潜能的干细胞[1],是极具前景的组织工程和基因治疗的种子细胞。由于获取人体干细胞的来源、制备条件、检测手段的差异,临床转化产生的治疗效果参差不齐,甚至带来不安全隐患,因此干细胞质量规范管理尤为重要。笔者按照国家《干细胞制剂质量控制及临床前研究指导原则》,建立hADSCs制备流程及质量安全检验系统,为临床应用研究hADSCs提供了安全的保障,同时为同类干细胞制备及检验提供标准化流程。我科自2011年9月开展hADSCs提取、分离、培养、鉴定、保存,共计50例,并将其运用慢性创面的治疗、软组织的修复重建、周围神经组织的功能恢复、黏膜组织的再生,取得较好的临床效果[2]。
1 材料与方法
1.1 组织来源、主要试剂 脂肪组织来自要求进行慢性创面的治疗、软组织的修复重建、周围神经组织、黏膜组织损伤的患者,共50例,年龄25~45岁,无系统性疾病、传染病和性病。术前均签订知情同意书。20 ml注射器建立负压,用2 mm(外径)×60 mm的不锈钢吸脂针抽取脂肪。吸取脂肪15 ml,经过纱布过滤后,把已经破坏的脂肪细胞、残留较粗血丝和较大组织块冲洗掉后,将过滤好的脂肪用无菌容器保存好以制备脂肪干细胞。α-MEM培养液, 间充质干细胞原代培养液、Ⅰ型胶原酶、0.25%胰酶、胎牛血清、PBS缓冲液、内毒素工作标准品等均购自中国食品药品检定研究院;梅毒螺旋体抗体诊断试剂盒、丙型肝炎病毒抗体诊断试剂盒、乙型肝炎病毒抗体诊断试剂盒、人免疫缺陷病毒抗体诊断试剂盒均购自英国新创科技有限公司。
1.2 仪器 Heal Force二氧化碳培养箱2个购自上海力申科学仪器有限公司,倒置生物显微镜及镜头相机各1个均购自重庆奥特光学仪器有限责任公司, thermo scientific 2个、全套量程移液器一套、海尔冰箱、SHA-C水浴振荡器1个均购自金坛市天竟实验仪器厂,Heal Force生物安全柜1个购自上海力申科学仪器有限公司。
1.3 方法
1.3.1 hADSCs制备 脂肪颗粒15 ml,离心1 000 r/min,5 min。取上层脂肪组织及下层细胞。向脂肪组织中加入终浓度0.1%的胰蛋白酶和胶原酶。放入37 ℃的水浴摇床中消化30 min。离心700 g/min,5 min。留取下层细胞,将两细胞混匀,加PBS缓冲液重悬细胞,再次离心700 g/min,5 min。原代培养液重悬细胞后接种至培养瓶,37 ℃、5%的二氧化碳培养箱中培养。记为P0代。观察细胞生长情况。首次第3天半量换液,以后每3 d换液一次,细胞达90%融合时传代培养,用0.05%胰蛋白酶消化,按照1∶4的比例传代。传至第3代做鉴定及移植。
1.3.2 细胞形态及活性 通过光学倒置显微镜观测细胞形态,通过胎盘蓝染色确定细胞数及细胞活率。
1.3.3 细胞倍增时间测定 分别取第1、3、5代细胞,消化计数,接种于24孔板内,每天细胞计数,绘制生长曲线。
1.3.4 无菌试验 按《中华人民共和国药典》2010年版三部附录ⅫA无菌检测法进行;利用全自动微生物培养检测系统:取样本分别加入至需氧培养瓶(BPA)和厌氧培养瓶(BPN)中。将BPA和BPN置入全自动微生物培养检测系统,37 ℃培养7 d。
1.3.5 支原体检测 按《中华人民共和国药典》[3]2010年版三部附录ⅫB支原体检测法进行。
1.3.6 人源特定病毒检测 采用ELISA法和实时定量PCR法检测HCV、HBV、HIV、EBV、CMV、HTLV等人源特定病毒的表达。
1.3.7 猪源病毒检测 采用ELISA法检测胰酶中猪细小病毒。
1.3.8 内毒素检测 按《中华人民共和国药典》[3]2010年版三部附录ⅫE 细菌内毒素检测法中的方法Ⅰ凝胶法进行。
1.3.9 hADSCs免疫表型鉴定 通过流式细胞仪测定hADSCs表面标记物CD13、CD29、CD31、CD34、CD45、CD44、CD73、CD90、CD105和HLA-DR的表达情况。
1.3.10 染色体核型分析 取传代后3~4 d处于增值指数期的细胞(P3代),更换新鲜培养液,加入20 μg/ml的秋水仙素125 μl,作用4 h,吸取含秋水仙素的培养液,加入胰酶消化细胞,细胞沉淀用低渗液处理5 min,然后加入固定液固定细胞。进行G带染色,显微镜观测。
1.3.11 hADSC分化能力检测 (1)成骨诱导分化。配制成骨诱导培养液(10 mmol/L β-甘油磷酸钠、10 nmol/L地塞米松、50 mg/L维生素C、1, 25-维生素D3);P3代细胞以2×103个/cm2的浓度接种于6孔板中,等细胞生长至80%融合后,更换为成骨诱导培养液,于诱导2、3周后,进行茜素红染色,去培养液,PBS洗2次;70%乙醇固定,4 ℃,1 h;PBS洗2次,40 mmol/L茜素红溶液室温染色1~10 min。镜下观测,照像。(2)成脂诱导分化。除常规细胞培养的基础培养液以外,加0.5 mmol/L异丁基-甲基黄嘌呤、60 μmol/l吲哚美辛、0.5 μmol/L氢化可的松和10 μg/L的胰岛素,细胞在此种培养液诱导4周后检测,去培养液,用PBS洗2次,甲醛-钙室温固定15 min;PBS洗2次,60%异丙醇染1 min;去异丙醇,油红O工作液室温染色30 min。60%异丙醇浸洗1次,PBS洗2次,镜下观测,照相。
1.3.12 异常免疫学反应 在体外淋巴细胞及树突状细胞培养中加入异体hADSCs,作用6 d后,未见淋巴细胞和树突状出现明显的增殖。对照组细胞生长良好。
2 结 果
2.1 细胞形态及活性 原代培养48 h后80%细胞已贴壁,成梭形(图1A)。未贴壁的圆形淋巴细胞,经过换液、传代,淋巴细胞基本消失,7 d后细胞基本融合成单层,呈长梭形漩涡状排列(图1B);细胞传至第2代,未见形态上有任何差异(图1C)。锥虫蓝染色结果显示细胞活率≥92%,冻存复苏后≥82%。

图1 原代人来源脂肪干细胞形态观察(×40)
A. 接种后48 h倒置显微镜下,大部分细胞已经贴壁,成梭形,同时混有少量未贴壁的圆形淋巴细胞; B. 接种7 d后倒置显微镜下,细胞基本融合成单层,呈长梭形漩涡状排列; C. 第三代形态上与接种48 h后相近,细胞呈现旋涡状生长
2.2 细胞生长情况 CAD软件显示,细胞生长曲线第1~2天细胞生长缓慢,第3~5天处于快速增殖期,第7天以后细胞生长缓慢,处于相对停止期,第1、3、5代细胞生长曲线无明显差异(图2)。
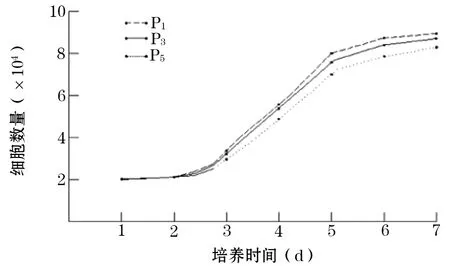
图2 人来源脂肪干细胞生长曲线
2.3 无菌试验 取第3代自体脂肪干细胞,依据《中华人民共和国药典》无菌试验检测50例,均无细菌生长,全自动微生物培养检测均为阴性。
2.4 支原体检测 取第3代自体脂肪干细胞依据《中华人民共和国药典》支原体检测规程进行,不同时间对同一标本进行检测,结果均为阴性。50例结果同样。
2.5 细胞内外源致病因子的检测 50例均取第3代自体脂肪干细胞结合ELISA 和实时定量PCR的方法,对人源特定病毒包括HIV、HBV、HCV、EBV、CMV、HTLV、TP进行检测,检测结果均为阴性,因细胞穿代过程中要使用胰酶,因此,利用ELISA的方法检测猪源细小病毒,结果显示病毒为阴性。
2.6 内毒素检测结果 50例取第3代自体脂肪干细胞通过凝胶法检测细胞培养上清中内毒素含量为(2.37±1.03)EU/ml。
2.7 hADSCs免疫表型检测 CD90、CD105表达呈阳性,阳性率>95%;CD34 、CD45和HLA-DR表达阴性,阳性率<2%(图3)。
2.8 hADSCs染色体核型分析 细胞染色体核型为46XY或46XX,正常率达到100%(图4)。
2.9 hADSCs的分化能力 hADSCs 经成骨诱导后,细胞由长梭形逐渐变为多边形、不规则形,1周后细胞开始呈簇状生长,聚集成团;2周时细胞团逐渐增大,4周时可见明显的钙结节形成;行茜红素染色,镜下见红色钙结节(图5A)。hADSCs经成脂诱导后,细胞生长缓慢,逐渐由长梭形变为多边形、圆形、椭圆形,细胞体积减小。1周后细胞胞浆内出现脂滴并逐渐聚集,2周时可见大量脂滴形成,随着诱导时间的延长,脂滴逐渐增多增大,4周时多数细胞被诱导成脂肪样细胞,油红O染色阳性,可见明显的脂肪形成(图5B)。
2.10 异常免疫学反应 hADSCs对人淋巴细胞及树突状细胞的增殖具有抑制作用。
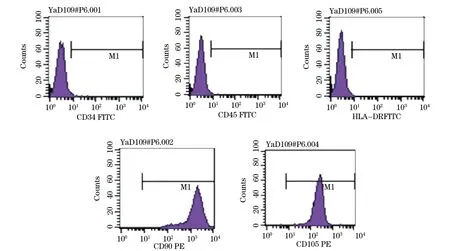
图3 人脂肪来源间充质干细胞免疫表型

图4 人脂肪来源间充质干细胞染色体核型分析
细胞染色体的形态、结构和数目均未见异常,呈二倍体结构,显示其核型是稳定的
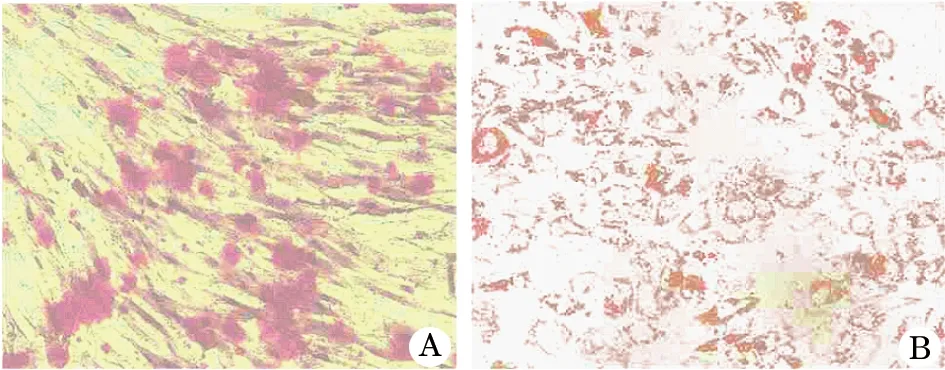
图5 第2代人脂肪干细胞成骨和成脂诱导培养
3 讨 论
hADSCs是来源于脂肪组织的一类具有增殖能力强和多项分化潜能的成体干细胞,在特定条件下可以向肌肉、软骨、脂肪、表皮,造血、神经等中胚层来源的组织细胞分化,具有取材容易、创伤小、细胞增殖快、不会引起伦理学争议等优点。国内外已开展多项hADSCs临床应用研究,主要包括骨关节疾病、创面修复、组织填充、心血管疾病等多个方面[ 4-7]。
目前,间充质干细胞分离方法主要包括胶原酶消化法或组织块贴壁分离等方法[8]。胶原酶消化法获去脂肪干细胞,操作复杂,药品用量不易控制,难于规范,直接影响细胞的产出及质量安全。单纯酶消化法虽然一次可获得较大的细胞量,但组织需要经过中性蛋白酶和胰酶、蛋白酶两次消化处理,而后者对细胞的损伤作用已被证实。尤其对于贴壁依赖性细胞来说,细胞膜表面分泌形成的黏蛋白膜,使细胞易于黏附支持物表面。细胞消化时,如果当胰酶将细胞分泌的黏蛋白膜水解后未能及时终止其作用,胰酶有可能对细胞内某些蛋白质发动进攻,造成其解离,进而诱导细胞发生凋亡。组织块贴壁分离法在实际操作中得到的仍是一种混合细胞,其中混杂有部分前体细胞,如何纯化获得单纯脂肪干细胞,是该方法主要的问题。本研究联合酶消化法和组织块法的优点,采用低转速离心细化脂肪组织,减少对脂肪细胞的破坏,减少胶原酶用量,酶消化时间短,减少了细胞损伤、污染的概率,提高细胞的活性,降低诱导细胞凋亡的因素,细胞产率高,传代后细胞形态及增殖活性最稳定,操作更加简单,更节约了成本。
本研究根据国家2014年《干细胞制剂质量控制及临床前研究指导原则》对hADSCs进行细胞形态、数量、活率的检定。锥虫蓝染色结果显示细胞活率≥92%,冻存复苏后≥82%。并按《中华人民共和国药典》对hADSCs进行无菌、支原体、人源特定病毒、猪源病毒、细菌内毒素等一系列检测;确保hADSCs无菌、无内毒素、无内外源致病因子;行茜红素染色,镜下见红色钙结节。油红O染色阳性,可见明显的脂肪形成。结果显示,hADSCs具有成骨和成脂等多向分化的潜能。
流式细胞学检测证实,实验产出的hADSCs具有与其他来源问充质干细胞相似的性质,包括细胞形态、免疫表型、增殖活性[9]。流式细胞学检测发现,与骨髓问充质干细胞相似,hADSCs免疫标志物表达水平会随着传代发生变化,CD90、CD105表达呈阳性,阳性率>95%;CD34、CD45和HLA-DR表达阴性,阳性率<2%。CD13、CD29、CD44、CD73、CD90、CD105等随着传代次数增多表达会明显增强,而标志物CD44一直持续高表达。证实本研究分离培养的hADSCs可能更均一,在本培养体系中性质更稳定。细胞表型的研究对于干细胞的检定及干细胞诱导分化条件、过程、及结果的研究都具有指导作用[10]。
hADSCs与干细胞有相近的低免疫源性,同时具有一定的免疫调节能力,可以抑制淋巴细胞、树突状细胞的增殖和降低其功能[11]。为了防止出现异常免疫反应,本实验用对照比较测定了对淋巴细胞的抑制作用。
本研究按照国家《干细胞制剂质量控制及临床前研究指导原则》和《中华人民共和国药典》分离培养检定hADSCs,并结合hADSCs的特点,进行制备和检定,可以取得细胞数量可观、增殖活性稳定、质量可靠的、安全应用临床的间充质干细胞。
[1] 李 辉,李 巧,左振宇,等. 人、大鼠和猪诱导多能干细胞染色体制备方法的建立和关键影响因素的分析[J]. 细胞生物学杂志,2009, 31(3):443-447.
[2] 汤苏阳,李 彦,闫俊灵,等. 体外扩增的自体脂肪干细胞介导自体脂肪移植的临床研究[J]. 中国生物医药技术, 2013, 8(6): 433-438.
[3] 国家药典委员会.中华人民共和国药典(2010年版) 三部[M]. 北京: 中国医药科技出版社,2010: 附录95-98.
[4] 李 梁,贾德进,闫俊灵,等. 体外扩增自体脂肪干细胞对空鼻综合征患者粘膜功能重建的临床研究[J]. 解放军医学杂志, 2014,51(10):1577-1580.
[5] 吴 瑜, 冯建平, 林 林, 等. STR 图谱分析法鉴别人源细胞交叉污染.中国生物制品学杂志, 2010,23(1):74-86.
[6] 闫俊灵, 狄国虎, 丁 红, 等. 脂肪干细胞介导的自体脂肪移植隆胸[J]. 中国组织工程研究, 2013,17(5):878-885.
[7] Zuk P A, Zhu M, Mizuno H,etal. Multilineage cells from human adipose tissue: implications for cell-based therapies[J]. Tissue Eng, 2001,7(2):211-226.
[8] Salem H K, Thiemermann C. Mesenchymal stromal cells: current understanding and clinical status [J]. Stem Cells, 2010, 28(3): 585-596.
[9] Chamberlain G, Fox J, Ashton B,etal. Concise review: mesenchymal stem cells: their phenotype, differentiation capacity, immunological features, and potential for homing [J]. Stem Cells, 2007, 25(11): 2739-2749.
[10] Zavan B, Michelotto L, Lancerotto L,et al. Neural potential of a stem cell population in the adiposeand cutaneous tissues[J]. Neurol Res, 2010,32(1):47-54.
[11] Lobna A. Aly. Efficiencyof systemic versus intralesional bone marrow-derived stem cells in regenerationof oral mucosa after induction of formocresol induced ulcers in Dogs[J]. DentRes J (Isfahan), 2014,11(2):212-221.
(2014-11-20收稿 2014-12-16修回)
(责任编辑 武建虎)
Human adipose derived mesenchymal stem cells and its quality test preparation
CHEN Chong, YAN Junling, LI Liang, XU Xiao, DING Hong, and TANG Suyang.
Department of Skin Regeneration Medicine, General Hospital of Chinese People’s Armed Police Forces, Beijing 100039, China
Objective To study the human adipose derived mesenchymal stem cellsinvitroamplification and quality inspection methods and provide safe and qualified stem cells for clinical research. Methods Fifty human source liposuctioned fat, sheared, underwent trypsin and collagenase digestion, separation, culture, and according to the “stem cell-based medicinal product quality control of pre clinical research guiding principle” to detect the cell morphology, quantity, live rate, sterilization, mycoplasma, human source specific virus and swine virus, endotoxin, immunosuppressive activity, differentiation ability, immunophenotype detection and chromosome karyotype. Results Human adipose derived mesenchymal stem cell activity before cryopreservation is ≥92%, after revival≥82%; bacteria and endotoxin test negative, no internal and external source pathogenic bacteria; stem cell immunophenotype detection of CD90, CD105 positive, the positive rate>95%, CD34, CD45 and HLA-DR negative expression, the positive rate<2%; with osteogenic and adipogenic differentiation proficiency ,it can inhibit the proliferation of allogeneic lymphocytes. Conclusions The preparation process and the standard of human adipose derived mesenchymal stem cell line according to the quality control standard of “stem cell-based medicinal product quality control of pre clinical research guiding principle”, it provides the experimental basis for the similar stem cell preparation and standardizing verification process.
adipose derived stem cells; mesenchymal stem cells; quality control; immunophenotype; differentiation; karyotype analysis
陈 冲,大专学历,护士,E-mail: 53193228@qq.com
100039北京,武警总医院皮肤再生医学科
汤苏阳,E-mail: 2278645614@qq.com
R329.2

