使君子多糖的超声波提取及体外抗氧化
卢善善,张照平,李芸达,颜祖弟,黄 涛,程世嘉,黄锁义
(右江民族医学院1. 护理学院;2. 临床学院;3.药学院,广西 百色 533000)
使君子多糖的超声波提取及体外抗氧化
卢善善1,张照平2,李芸达2,颜祖弟2,黄 涛2,程世嘉2,黄锁义3*
(右江民族医学院1. 护理学院;2. 临床学院;3.药学院,广西 百色 533000)
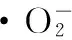
使君子多糖 ;超声波提取法 ;体外抗氧化;正交设计
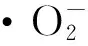
1 实验部分
1.1 材料与试剂
1.1.1 仪器
KQ5200DB型数控超声波清洗器(昆山市超声仪器有限公司)、植物粉碎机FZ102(上海锐丰仪器仪表有限公司)、电热恒温鼓风干燥箱(上海精宏实验设备有限公司)、电热式恒温水浴锅HHS-21-4(江苏金坛宏凯仪器厂)、SHB-III循环水式多用真空泵(郑州长城科工贸有限公司)、电子分析天平FA1104(上海天平仪器厂)、755B紫外可见分光光度计(上海精密科学仪器有限公司)。
1.1.2 试剂与药材
葡萄糖、双氧水溶液、苯酚、水杨酸、无水乙醇、邻苯三酚,95%浓硫酸等,所用试剂均为分析纯试剂,使君子果实采购自百色药店。
1.2 使君子的多糖提取方法
1.2.1 使君子多糖的提取
将干燥使君子果实在植物粉碎机上磨碎,制成使君子果实粉末备用,称取1.000 g的使君子果实粉末若干份,分别在不同料液比、作用时间、提取温度、超声功率等单因素条件下进行提取实验。冷却后,将提取液过滤后定容,取上液适量稀释一定的倍数,待测。根据单因素实验结果,以多糖提取率为实验指标,进行L9(34)正交实验。
1.2.2 使君子多糖提取率的测定
本实验对多糖的测定采用的是硫酸-苯酚法[9]。取待测液0.5 mL置于10.0 mL的试管中,加入5%的苯酚溶液1.0 mL,混匀,迅速加入5.0 mL的浓硫酸,摇匀,40 ℃水浴中反应30 min,然后置于冷水中冷却10 min,以葡萄糖为标样,于波长490 nm处测定吸光度值。由一元线性回归方程推算出使君子多糖的质量。
1.2.3 标准曲线的绘制
精密称取干燥(105℃)至恒重的葡萄糖50 mg,加蒸馏水定容至100 mL,得标准葡萄糖溶液。取标准葡萄糖溶液0.0 mL、2.0 mL、4.0 mL、6.0 mL、8.0 mL、10.0 mL,分别定容至50 mL,得不同浓度的稀释液。分别精密吸取上述稀释液0.5 mL按“1.2.2”中方法显色,测定吸光度值,以吸光度值(A)对质量浓度C(mg/mL)进行回归,得回归方程为:A=5.163 3C-0.030 2,r=0.999 2,表明对照品葡萄糖含量在0.010~0.100 mg/mL范围内与对应吸光度值有良好线性关系。
1.2.4 优化工艺条件的正交实验
由单因素实验可知,料液比、提取时间、超声温度、作用功率等因素均可影响使君子多糖的提取率,为了探究这4种因素的综合影响,以多糖提取率为指标,按L9(34)正交表进行正交实验确定最佳提取工艺条件。因素水平见于表1,正交实验见于表2,方差分析见于表3。根据实验数据对比可知,影响使君子多糖提取的因素由主到次的顺序为:(A)料比液>(C)提取温度>(D)超声功率>(B)超声时间。通过方差分析可知,料比液在超声波提取使君子多糖中有显著意义,因此,最佳提取工艺为A2B2C3D1即料比液1 ∶30(g/mL)、提取时间40 min、提取温度70 ℃、超声波功率140 W。

表1 正交因素水平试验
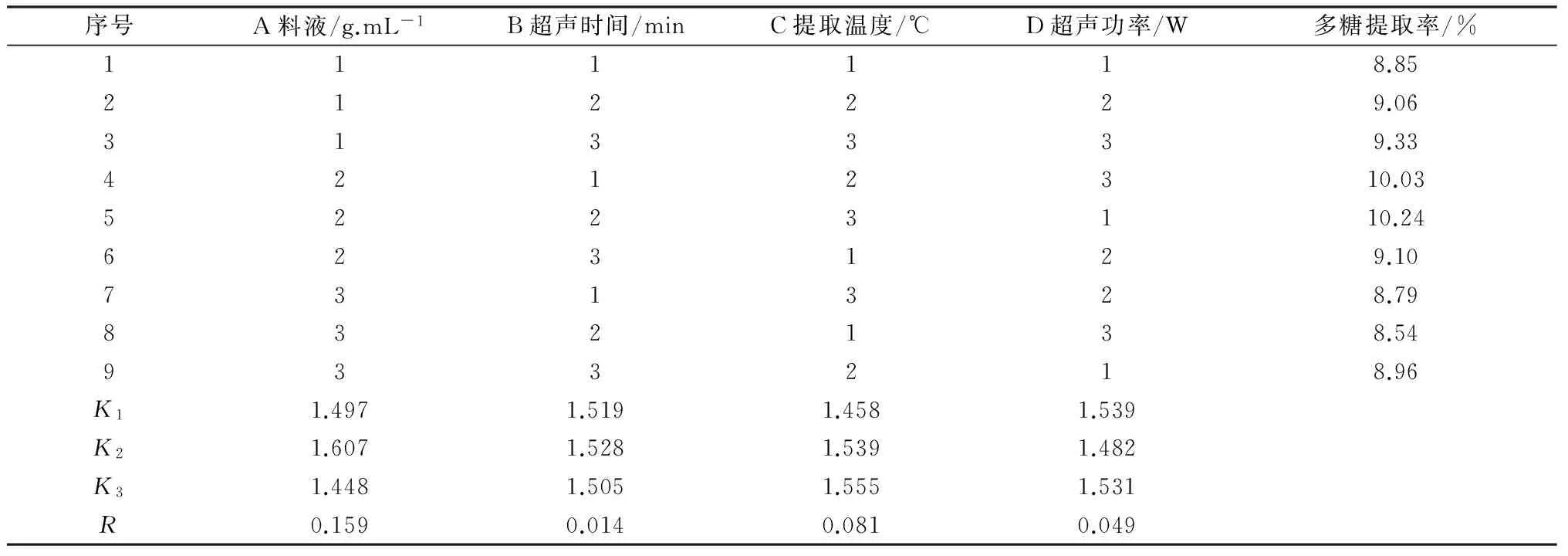
表2 L9(34)正交试验及结果

表3 方差分析
注:F0.05(2,2)=19;F0.01(2,2)=99
1.2.5 验证试验
取使君子果实干粉3份,每份1.000 g,按最佳提取条件A2B2C3D1进行提取,即按1 ∶30(g/mL)料液比,以140 W的超声功率在70 ℃下进行提取40 min将提取液过滤后定容,取上液适量稀释一定的倍数,测定吸光度,计算使君子多糖的提取率。验证试验结果见表4,按最佳提取条件进行提取,多糖提取率平均为10.36%,RSD为0.51%,结果与正交试验中的5号试验的多糖提取率相近,因此我们认为正交试验得出的结果是可靠的且工艺稳定可行。
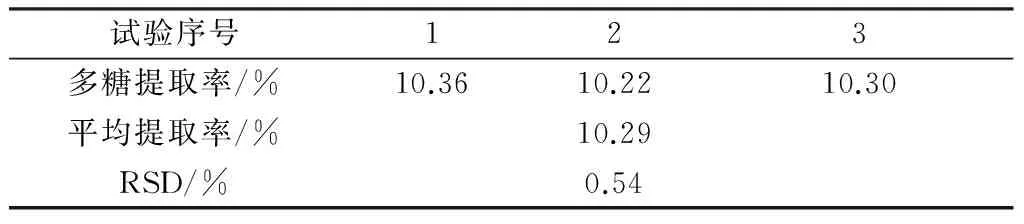
表4 验证试验结果
1.2.6 羟基自由基的清除
用Fenton反应法[7]产生羟基自由基(·OH)。H2O2/Fe2+体系可以通过Fenton反应产生经自由基化学反应式如下:
H2O2+ Fe2+→·OH+OH-+Fe3+
以· OH有色物质氧化水杨酸产生有色物质,该产物在510 nm处有强吸收峰,若体系中加入清除·OH的物质,则会减少有色物质生成,吸光度降低,吸光度越低,清除率·OH效果越好。
方法:取5支试管,依次编号,每支试管各加入9 mmol/L FeSO41 mL, 9 mmol/L水杨酸-乙醇溶液2.0 mL,按试管编号依次加入不同浓度的多糖溶液2.0 mL,最后加入8.8 mmol/L H2O22.0 mL启动反应,于室温下反应1.0 h。以蒸馏水代替多糖溶液作空白调零,在510 nm处测定样品的吸光度,记录数据,清除率可用公式表示:
清除率=(A0-As)/A0×100%
式中A0为空白对照液的吸光度,As为加入提取液后的吸光度
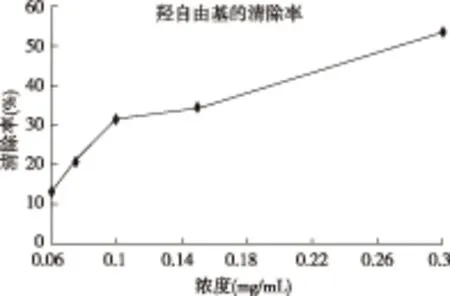
图1 羟自由基清除率
由图1可以看出,不同浓度的使君子多糖对H2O2/Fe2+通过Fenton反应产生的·OH具有清除作用,并且在一定范围内,随多糖浓度的增加,·OH清除率有明显的上升趋势,说明使君子多糖对·OH的清除效果明显。
1.2.7 超氧阴离子的清除
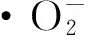
清除率(%)=[1-(A1-A2)/A0]×100%
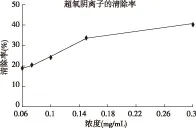
图2 超氧自由基清除率
2 结 论
超声波辅助提取多糖的过程是一种物理破碎过程,它利用空化和机械振动作用瞬间使细胞壁结构破裂,不仅缩短提取时间,并且还可避免高温对提取成分的影响,提高了多糖的提取率,同时还能产生乳化、热效应等,加速了植物有效成分的扩散[10]。与传统提取工艺相比,超声提取使君子多糖具有省时、高效、节能的优点。因此,超声波新技术应用于中药类有效成分提取是一种高效、便捷、值得推广的新方法。
使君子多糖对羟自由基及超氧阴离子均表现为较强的清除能力,且在一定浓度范围内,随着浓度的增加清除能力在增强。因此,从整体上来说,使君子多糖抗氧化性显著,这预示着使君子在对人类医学、保健事业及食品开发上有潜在的利用价值。
[1] 陈加红. 使君子规模化栽培关键技术研究[J]. 河南农业科学,2013,42(6):123-125.
[2] 李均. 使君子的传说[J]. 东方药膳,2008(1):42.
[3] 沈宇峰, 沈晓霞,王志安,等. 药用植物使君子的研究综述[J]. 时珍国医国药,2008,19(7):1702- 1704.
[4] 金迪,梁英,孙工兵,等. 植物多糖提取技术的研究进展[J]. 黑龙江八一农垦大学学报,2011,23(5):76-79.
[5] 谭静,姜子涛,李荣,等. 微波萃取和超声波提取法提取柚皮中黄酮类化合物的对比[J]. 食品研究与开发,2010,31(2):42-45.
[6] 官建明.福建邵武特色药材—使君子[J].海峡药学,2012, 24(12):37-38.
[7] 谢燕飞,覃冬,潘廷啟,等. 广西壮药薏苡茎多糖的提取及抗氧化性研究[J]. 中国处方药,2012,10(2):43-45,48.
[8] 刘长建, 姜波, 刘亮, 等. 枸杞子多糖提取工艺优化及体外抗氧化活性研究[J]. 时珍国医国药, 2009, 20(3):661-663.
[9] 郭晓蕾,朱思潮,翟旭峰,等. 硫酸蒽酮法与硫酸苯酚法测定灵芝多糖含量比较[J].中华中医药学刊,2010,28(9):2000-2002.
[10] 徐怀德,秦盛华. 超声波辅助提取光皮木瓜多糖及其体外抗氧化性研究[J]. 食品科学,2010,31(10):106-111.
Ultrasonic Extraction and Antioxidant Activity of Polysaccharides from Fructus Quisqualis
Lu Shanshan1, Zhang Zhaoping2, Li Yunda2,Yan Zudi2,Huang Tao2,Cheng Shijia2,Huang Suoyi3
(1.School of Nursing; 2.School of Clinical Medicine; 3.School of Pharmacy,Youjiang Medical University for Nationalities,Baise 533000, China)
polysaccharide ofQuisqualpindica; ultrasonic extracting;antioxidant activity; orthogonal experimental design
2014-08-12
国家中医药管理局“十二五”中医药重点学科中药化学建设项目(国中医药人教发[2012]32号);广西重点学科药物化学建设项目(桂教科研[2013]16号);2014年国家级大学生创新训练计划立项项目(201410599006);2014年广西自治区级大学生创新训练计划立项项目(201410599035);右江民族医学院民族医药协会资助项目(20131103)。
卢善善(1991-),女,本科在读。研究方向:中药有效成分提取。E-mail:18777615250@163.com
*通讯作者:黄锁义,男,教授,硕士研究生导师。研究方向:天然产物化学、药物化学、食品卫生、中草药与植物化学。E-mail:huangsuoyi@163.com
10.3969/j.issn.1006-9690.2015.02.003
R284.2
A
1006-9690(2015)02-0009-04

