短期干旱胁迫对黄瓜幼苗叶片抗氧化系统的影响
丁 玲,吴 雪,杜长霞,2,徐艳丽,樊怀福,2
短期干旱胁迫对黄瓜幼苗叶片抗氧化系统的影响
丁 玲1,吴 雪1,杜长霞1,2,徐艳丽1,樊怀福1,2
(1.浙江农林大学 农业与食品科学学院,浙江 临安 311300;2.浙江农林大学 浙江省农产品品质改良技术研究重点实验室,浙江临安311300)
以黄瓜‘津优1号’Cucumis sativus‘Jinyou No.1’为试材,采用水培法,通过在营养液中添加不同比例聚乙二醇PEG 6000模拟干旱胁迫,研究短期干旱胁迫对黄瓜幼苗叶片抗氧化系统的影响。结果显示:在不同程度干旱胁迫下处理24 h后,超氧化物歧化酶(SOD),谷胱甘肽还原酶(GR),脱氢抗坏血酸还原酶(DHAR)和单脱氢抗坏血酸还原酶(MDHAR)活性以及抗坏血酸(ASA)和还原型谷胱甘肽(GSH)质量摩尔浓度均下降,其中超氧化物歧化酶和谷胱甘肽还原酶活性、抗坏血酸和还原性谷胱甘肽GSH质量摩尔浓度与对照比较有显著差异(P<0.05);而过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)活性、可溶性蛋白质量分数和丙二醛(MDA)质量摩尔浓度在胁迫条件下升高,其中可溶性蛋白和丙二醛质量摩尔浓度增加明显(P<0.05);过氧化物酶(POD)活性则呈现出中度胁迫下显著升高(P<0.05)和重度胁迫下略有下降的趋势。以上表明:短期干旱胁迫引起了黄瓜叶片膜脂过氧化加剧,酶促抗氧化系统比非酶促系统在抗氧化过程中起到了更积极的作用。图3参21
园艺学;黄瓜;干旱胁迫;抗氧化系统
干旱胁迫是世界性的主要自然灾害之一,仅次于生物胁迫。在所有非生物危害中占首位,干旱胁迫是限制植物生长发育和产量的重要生态环境因素[1]。全球有1/3以上的土地处于干旱和半干旱状态。中国华北、西北、内蒙古和青藏高原绝大部分地区属于干旱和半干旱地区,约占全国土地面积的45%[2]。此外,不均匀降水、季节性的干旱还经常侵袭中国非干旱的主要农业区。如何提高作物的耐旱性或者抗旱性一直是人们研究的热点[3],探讨干旱胁迫下作物生理机制对于作物抗旱栽培具有重要意义。黄瓜Cucumis sativus是世界性的重要蔬菜作物,也是中国设施栽培的主要蔬菜种类之一,生育期需水量较大且对水分亏缺特别敏感。当土壤相对含水量低于70%时,黄瓜便会生长缓慢,最终导致植株矮小,发育不良,产量降低[4]。植物对干旱胁迫的响应包含极其复杂的生理生化变化,并形成了受遗传性制约的适应机制[5]。对活性氧(ROS)的响应是植物适应干旱胁迫非常重要的生理生化机制。大量的研究表明:植物在长期的进化过程中形成了酶促和非酶促两大类保护系统以清除活性氧,减轻或避免活性氧对细胞的伤害,从而表现出对氧化胁迫的抗性[6]。前人对于干旱胁迫的研究主要集中于长时间胁迫后的生理反应,短时间内的生理响应机制尚不清楚,然而植株在短时间胁迫下的逆境应激响应对植物的耐性具有十分重要的意义。因此,本试验采用水培法,采用聚乙二醇(PEG)6000模拟干旱胁迫,研究了干旱胁迫24 h后对黄瓜幼苗叶片抗氧化系统的影响,以期为黄瓜的抗旱机制研究和抗旱栽培提供理论依据。
1 材料与方法
1.1 试材与处理
以黄瓜品种‘津优1号’‘Jinyou No.1’为材料。种子在培养箱28℃恒温箱催芽,露白后播种于盛有V(泥炭)∶V(蛭石)=1∶1的50孔穴盘中,置于人工气候室中育苗,昼温25℃,夜温20℃。待幼苗长至2叶1心后,选择整齐一致、长势良好的的幼苗洗净根部移入10 L水培箱中水培。营养液为山崎黄瓜专用配方。用气泵间歇性通气(40 min·h-1),待幼苗第3片真叶完全展开时,开始处理。用PEG 6000模拟根际干旱胁迫,设对照(正常营养液栽培,用ck表示)、中度干旱胁迫(含5%PEG 6000的营养液栽培,相当于水势ψw=-0.05 MPa,用5%表示)、重度干旱胁迫(含10%PEG 6000的营养液栽培,相当于水势ψw=-0.15 MPa,用10%表示)。处理24 h后取叶片样品测定相关生理指标。试验设重复3 次·处理-1。
1.2 测定指标及方法
超氧化物歧化酶(SOD)活性的测定参照Giannopolitis等[7]的方法。过氧化物酶(POD)活性的测定参照Egley等[8]的方法测定。过氧化氢酶(CAT)活性的测定参照Cakmak&Marschner[9]的方法。抗坏血酸过氧化物酶(APX)活性和脱氢抗坏血酸还原酶(DHAR)的活性的测定参照Nakano等[10]的方法。单脱氢抗坏血酸还原酶(MDHAR)的活性测定参考Hossain等[11]的方法。谷胱甘肽还原酶(GR)的活性测定参照Foyer等[12]的方法。抗坏血酸(ASA)的质量摩尔浓度测定参照Jiang等[13]的方法。还原型谷胱甘肽(GSH)的测定参照Griffith[14]的方法。丙二醛(MDA)的测定参照Heath等[15]的方法。可溶性蛋白参考Bradford[16]的方法测定。
1.3 数据分析方法
所有数据采用SAS软件进行单因素方差分析,并对平均数用Duncan’s新复极差法进行多重比较。
2 结果与分析
2.1 干旱胁迫对黄瓜幼苗叶片抗氧化系统酶活性的影响
由图1A可以看出:在干旱胁迫下24 h后超氧化物歧化酶活性显著下降(P<0.05),5%和10%PEG 6000处理分别为对照的83.03%和82.09%。过氧化物酶活性在5%PEG 6000胁迫条件下显著高于对照(P<0.05),10%PEG 6000胁迫略低于对照但差异不明显(图1B)。胁迫条件下过氧化氢酶活性与超氧化物歧化酶活性表现出相反的变化趋势,5%和10%PEG 6000处理均显著高于对照(P<0.05),分别为对照的1.22和1.19倍(图1C)。抗坏血酸过氧化物酶活性在5%PEG 6000处理条件下与对照比较无显著变化,而在10%PEG 6000处理下显著高于对照(P<0.05),较对照提高了21.69%(图1D)。谷胱甘肽还原酶活性与超氧化物歧化酶活性表现出相似的变化趋势(图1E),各处理谷胱甘肽还原酶活性显著低于对照(P<0.05),5%和10%PEG 6000等2处理无显著差异。
如图1F所示,脱氢抗坏血酸还原酶活性在5%PEG 6000处理条件下变化不明显,而10%PEG 6000处理下显著抑制了其活性(P<0.05),仅为对照的45.01%。单脱氢抗坏血酸还原酶活性在胁迫条件下均下降,其中5%PEG 6000处理下降明显(P<0.05),10%PEG 6000与对照无显著差异。

图1 干旱胁迫对黄瓜幼苗叶片抗氧化系统酶活性的影响Figure 1 Effects of drought stress on enzyme activities of antioxidant system in leaves of cucumber seedlings
2.2 干旱胁迫对黄瓜幼苗叶片抗氧化物质抗坏血酸和还原型谷胱甘肽质量分数的影响
如图2所示:在干旱胁迫24 h后,幼苗叶片抗坏血酸(ASA)和还原型谷胱甘肽(GSH)质量分数均显著下降(P<0.05),抗坏血酸和还原型谷胱甘肽质量分数在5%和10%PEG 6000处理条件下分别为对照的74.71%,75.47%和68.74%,68.51%,而5%和10%PEG 6000等2处理无显著差异。
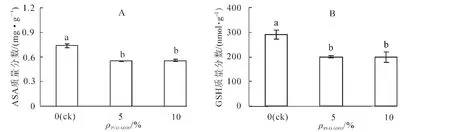
图2 干旱胁迫对黄瓜幼苗ASA和GSH质量分数的影响Figure 2 Effects of drought stress on ASA and GSH content in leaves of cucumber seedlings
2.3 干旱胁迫对黄瓜幼苗叶片可溶性蛋白和丙二醛的影响
由图3可以看出:干旱胁迫条件下,可溶性蛋白质量分数显著提高,且随着胁迫程度的加重增加明显,10%PEG 6000处理显著高于5%PEG 6000处理(P<0.05)(图3A)。干旱胁迫同样提高了幼苗叶片的丙二醛质量摩尔浓度,显著高于对照(P<0.05),但10%PEG 6000处理与5%PEG 6000处理差异不显著(图3B)。

图3 干旱胁迫对黄瓜幼苗叶片可溶性蛋白和MDA的影响Figure 3 Effects of drought stress on soluble protein and MDA content in leaves of cucumber seedlings
3 讨论
当植物遭受干旱、紫外线、高温及重金属、病虫等生物或非生物胁迫时,体内会形成过量的自由基,形成氧化胁迫,导致蛋白质、DNA及脂类的氧化伤害,进而使细胞膜受伤,破坏膜的正常功能[17]。丙二醛是膜脂过氧化作用的产物,不但标志膜脂过氧化程度,也间接反映组织中自由基的含量。丙二醛的产生和积累会加剧对细胞的毒害,使膜的结构和功能受损,还可以使酶分子间发生交联聚合,导致酶失活[18]。本试验结果表明:在短期干旱胁迫下,黄瓜幼苗叶片丙二醛质量摩尔浓度增加(P<0.05),说明活性氧的大量产生对植株造成了过氧化伤害。渗透调节是植物适应干旱等逆境胁迫的重要机制之一。本研究显示:胁迫条件下黄瓜叶片可溶性蛋白质量分数显著增加(P<0.05)。可溶性蛋白的积累不仅可以协调细胞与外界渗透压的平衡,降低细胞的渗透势,增强从环境吸水的能力,维持水分平衡,还有利于更好地保护膜表面,维持膜的稳定性。因而,可溶性蛋白在植物体内的积累在一定程度上提高了植株的抗性,是植物对外界逆境的重要应激反应。
植物遭受逆境引发活性氧水平升高的同时,也会主动或被动地启动自身的抗氧化防御系统进行防御,减缓细胞伤害,提高植物对逆境胁迫的适应性。而防御系统中抗氧化酶超氧化物歧化酶、过氧化物酶、过氧化氢酶和抗坏血酸过氧化物酶活性的高低就成为控制伤害的关键因素[19]。其中,超氧化物歧化酶是植物体内清除活性氧的第一道防线,能催化O2-·生成过氧化氢(H2O2)和氧气(O2),而生成的过氧化氢(H2O2)则会被过氧化氢酶、抗坏血酸过氧化物酶和过氧化物酶等抗氧化酶清除,生成氧气和水。本试验中,超氧化物歧化酶活性在干旱胁迫条件下显著下降(P<0.05),其原因可能是胁迫后迅速抑制了超氧化物歧化酶基因的表达进而导致超氧化物歧化酶合成减少。相反地,过氧化氢酶和抗坏血酸过氧化物酶活性在不同胁迫条件下均上升,而过氧化物酶活性在中度胁迫条件下上升,在重度胁迫条件下下降。酶活性的改变与植物体内的活性氧代谢密切相关,说明在胁迫24 h后,植物体内活性氧代谢的平衡被打破,酶活性不同程度的被诱导或破坏来响应外界环境的改变。
有关抗氧化酶系统与植物耐旱关系的研究已有大量的报道。细胞内活性氧的动态平衡是由抗氧化系统决定的。该系统不仅包括大量的抗氧化酶而且还包括一些抗氧化物质,如抗坏血酸、还原型谷胱甘肽是植物细胞中主要的低分子量可溶性抗氧化剂。这些抗氧化物质在抵御逆境胁迫时同样重要[20],也有清除活性氧的作用,它们是抗坏血酸-还原型谷胱甘肽循环系统中的重要物质组分。脱氢抗坏血酸还原酶、单脱氢抗坏血酸还原酶、谷胱甘肽还原酶和抗坏血酸过氧化物酶则是植物抗坏血酸-还原型谷胱甘肽循环系统中的关键酶组分,在还原型抗坏血酸和还原型谷胱甘肽的再生过程中占有不可或缺的地位。大量的研究资料表明,抗坏血酸和还原型谷胱甘肽的含量及其代谢相关酶类活性的变化是植物对环境胁迫的响应。本试验发现:在干旱胁迫下抗坏血酸和还原型谷胱甘肽质量摩尔浓度均显著下降(P<0.05),这是植物体内活性氧积累导致膜脂过氧化的的重要原因之一。徐向东等[21]研究高温胁迫黄瓜幼苗抗坏血酸和还原型谷胱甘肽含量也得到了相似的结果。同时,干旱胁迫还导致了谷胱甘肽还原酶、单脱氢抗坏血酸还原酶和脱氢抗坏血酸还原酶的酶活性降低,是抗坏血酸和还原型谷胱甘肽质量摩尔浓度降低的重要原因。
然而,植物的抗旱性是一个受多种因素影响的复杂数量性状,单一的指标难以全面准确地反映抗旱性强弱。综上所述,在遭受短期中度和重度干旱胁迫后,黄瓜叶片膜系统遭到了破坏,丙二醛质量摩尔浓度显著增加,酶促抗氧化系统(抗氧化酶活性)较非酶抗氧化系统(抗氧化物质含量)在清除活性氧方面扮演了更重要的角色,但这与胁迫时间密切相关,其精确的机制需要从基因水平、表达调控、信号传导网络等多个方面进一步研究。
[1] CELLIER F,CONÉJÉRO G,BREITLER J C,et al.Molecular and physiological responses to water deficit in droughttolerant and drought-sensitive sunflower lines (Helianthus annuus L.):accumulation of dehydrin transcripts correlates with tolerance[J].Plant Physiol,1998,116(1):319-328.
[2] 刘佳,郁继华,徐秉良,等.干旱气候条件下水分胁迫对辣椒叶片生理特性的影响[J].核农学报,2012,26(8): 1197-1203. LIU Jia,YU Jihua,XU Bingliang,et al.Effects of water stress on the physiological characteristics of pepper leaves in arid climates[J].J Nucl Agric Sci,2012,26(8):1197-1203.
[3] MEDICI L O,REINERT F,CARVALHO D F,et al.What about keeping plants well watered?[J].Environ Exp Bot, 2014,99(10):38-42.
[4] 翟胜,梁银丽,王巨媛,等.干旱半干旱地区日光温室黄瓜水分生产函数的研究[J].农业工程学报,2005,21 (4):136-139. ZHAI Sheng,LIANG Yinli,WANG Juyuan,et al.Water production function of cucumber in Chinese solar greenhouse in arid and semiarid region[J].Trans Chin Soc Agric Eng,2005,21(4):136-139.
[5] 张智猛,戴良香,宋文武,等.干旱胁迫处理对花生品种叶片保护酶活性和渗透物质含量的影响[J].作物学报, 2013,39(1):133-141. ZHANG Zhimeng,DAI Liangxiang,SONG Wenwu,et al.Effect of drought stress at different growth stages on peanut leaf protective enzyme activities and osmoregulation substances content[J].Agron Sin,2013,39(1):133-141.
[6] SAIRAM R K,VASANTHAN B,ARORA A.Calcium regulates Gladiolus flower senescence by influencing antioxidative enzymes activity[J].Acta Physiol Plant,2011,33(5):1897-1904.
[7] GIANNOPOLOLITIS C N,RIES S K.Superoxide dismutase(Ⅰ)occurrence in higher plants[J].Plant Physiol,1977, 59(2):309-314.
[8] EGLEY G H,PAUL R N Jr,VAUGHN K C,et al.Role of peroxidase in the development of water impermeable seed coats in Sida spinosa L.[J].Planta,1983,157(3):224-232.
[9] CAKMAK I,MARSCHNER H.Magnesium deficiency and high light intensity enhance activities of superoxide dismutase,ascrobate peroxidase,and glutathione reductase in bean leaves[J].Plant Physiol,1992,98(4):1222-1227.
[10] NAKANO Y,ASADA K.Hydrogen peroxide scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J]. Plant Cell Physiol,1981,22(5):867-880.
[11] ANWAR H M,YOSHIYUKI N,KOZI A.Monodehydroascorbate reductase in spinach chloroplasts and its participation in the regeneration of ascorbate for scavenging hydrogen peroxide[J].Plant Cell Physiol,1984,25(3):385-395.
[12] FOYER C H,HALLIWELL B.The presence of glutathione and glutathione reductase in chloroplasts:a proposed role in ascorbic acid metabolism[J].Planta,1976,133(1):21-25.
[13] JIANG Mingyi,ZHANG Jianhua.Effect of abscisic acid on active oxygen species,antioxidative defence system and oxidative damage in leaves of maize seedlings[J].Plant Cell Physiol,2001,42(11):1265-1273.
[14] GRIFFITH O W.Determination of glutathione and glutathione disulfide using glutathione reductase and 2-vinylpyridine[J].Anal Biochem,1980,106(1):207-212.
[15] HEATH R L,PACKER L.Photoperoxidation in isolated chloroplasts(Ⅰ)Kinetics and stoichiometry of fatty acid peroxidation[J].Arch Biochem Biophysil,1968,125(1):189-198.
[16] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976,72(1/2):248-254.
[17] 赵洁,杜润峰,王龙飞,等.达乌里胡枝子抗氧化防御系统对干旱及增强UV-B辐射的动态效应[J].草地学报, 2013,21(2):308-315. ZHAO Jie,DU Runfeng,WANG Longfei,et al.Dynamic responses of antioxidative defense system of Lespedeza davurica to drought and enhanced UV-B radiation[J].Acta Agrestia Sin,2013,21(2):308-315.
[18] 刘忠霞,刘建朝,胡景江.干旱胁迫对苹果树苗活性氧代谢及渗透调节的影响[J].西北林学院学报,2013,28 (2):15-19. LIU Zhongxia,LIU Jianchao,HU Jingjiang.Effects of drought stress on active oxygen metabolism and contents of adjustment substances in the leaves of apple seedling[J].J Northwest For Univ,2013,28(2):15-19.
[19] JIANG Yiwei,HUANG Bingru.Drought and heat stress injury to two cool-season turfgrasses in relation to antioxidant metabolism and lipid peroxidation[J].Crop Sci,2001,41(2):436-442.
[20] SHARMA P,DUBEY R S.Drought induces oxidative stress and enhances the activities of antioxidant enzymes in growing rice seedlings[J].Plant Growth Regul,2005,46(3):209-221.
[21] 徐向东,孙艳,郭晓芹,等.褪黑素对高温胁迫下黄瓜幼苗抗坏血酸代谢系统的影响[J].应用生态学报,2010, 21(10):2580-2586. XU Xiangdong,SUN Yan,GUO Xiaoqin,et al.Effects of exogenous melatonin on ascorbate metabolism system in cucumber seedlings under high temperature stress[J].Chin J Appl Ecol,2010,21(10):2580-2586.
An antioxidant system in cucumber seedling leaves with short term drought stress
DING Ling1,WU Xue1,DU Changxia1,2,XU Yanli1,FAN Huaifu1,2
(1.School of Agriculture and Food Science,Zhejiang A&F University,Lin’an 311300,Zhejiang,China;2.The Key Laboratory for Quality Improvement of Agricultural Products of Zhejiang Province,Zhejiang A&F University,Lin’an 311300,Zhejiang,China)
To determine the effect of short term drought stress on an antioxidant system in cucumber seedling leaves,the Cucumis sativus‘Jinyou No.1’seedlings were cultured in a shanqi nutrient solution under drought stress simulated by 5%and 10%PEG 6000.A control,5%and 10%PEG 6000 with three replications was used to compare superoxide dismutase (SOD),glutathione reductase (GR),ascorbate (ASA),glutathione (GSH),soluble protein,malondialdehyde(MDA).Results after 24 h of treatment showed that compared to the control,SOD and GR activities as well as ASA and GSH content significantly decreased (P<0.05).However, soluble protein and MDA content significantly increased (P<0.05).Thus,short term stress resulted in acceleration of the membrane lipid peroxidation,and the enzymatic antioxidant system played a more active role in the process of antioxidant.[Ch,3 fig.21 ref.]
horticulture;cucumber;drought stress;antioxidant system
S642.2
A
2095-0756(2015)07-0285-06
浙 江 农 林 大 学 学 报,2015,32(2):285-290
Journal of Zhejiang A&F University
10.11833/j.issn.2095-0756.2015.02.017
2014-04-25;
2014-07-02
国家自然科学基金资助项目(31101539,31201658)
丁玲,从事蔬菜栽培生理研究。E-mail:ling_3389@126.com。通信作者:樊怀福,副教授,博士,从事设施园艺与无土栽培研究。E-mail:wwghff@126.com

