脂氧素受体激动剂BML-111对野百合碱诱导肺动脉高压大鼠肺动脉压力及机制的研究*
湖北医药学院附属太和医院(十堰 442000) 陈永梅 龚兴瑞 向 勇 秦成名
脂氧素受体激动剂BML-111对野百合碱诱导肺动脉高压大鼠肺动脉压力及机制的研究*
湖北医药学院附属太和医院(十堰 442000)陈永梅龚兴瑞向勇秦成名△
目的:观察脂氧素受体激动剂BML-111对野百合碱(MCT)诱导肺动脉高压大鼠肺动脉压力的作用。方法:将SD大鼠24只随机分为C组、PH组、B组三组,PH组和B组大鼠行皮下注射野百合碱50μg/g,C组注射等量生理盐水,自野百合碱注射的当天起,B组每天腹腔注射1mg/kg·d BML-111连续4周。观察指标:平均肺动脉压力(MPAP)、右心室收缩压(RVSP)、右心室(RV)/[左室(LV)+室间隔(S)]、血浆内皮素ET及肿瘤坏死因子α(TNFα)。结果: PH组、B组与C组相比MPAP、RVSP、RV/(LV+S)、血浆ET及TNFα水平高于C组(P<0.05);B组与PH组相比,MPAP、RVSP、RV/(LV+S)、血浆ET及TNFα低于PH组(P<0.05)。结论: 脂氧素受体激动剂BML-111可减轻野百合碱诱导肺动脉高压大鼠肺动脉压力,其机制可能与减轻血浆ET及TNFα水平,抑制肺动脉重构有关。
肺动脉高压是临床常见疾病,其主要原因是各种因素所导致的肺血管内皮重构,表现为肺动脉压力的进行性升高,并最终导致右心衰竭。传统治疗效果并不满意[1]。炎症因素的作用逐步得到重视,炎症因素导致肺小血管功能紊乱,内皮细胞、平滑肌细胞过度增生,最终肺部细小动脉管腔狭窄形成肺动脉高压[2, 3]。野百合碱(MCT)是一种较常用的刺激炎症反应从而导致大鼠肺动脉高压形成的药物,其制作肺动脉高压模型越来越成熟[4]。BML-111是一种脂氧素类似物,其血管内皮受体结合后可促进炎症介质消退,减轻血管内皮重构, 因此有可能成为治疗肺动脉高压的药物。本试验拟观察BML-111对野百合碱(MCT)诱导肺动脉高压大鼠的作用,并初步分析其可能机制。
资料与方法
1动物与试剂选择湖北医药学院动物实验中心健康雄性SD大鼠30只,体重200~230g,实验器材包括:天平、压力换能器、注射器、水合氯醛、氟利多、肝素等大鼠试验用操作器械。试剂MCT购自Sigma公司,内皮素(ET) 和肿瘤坏死因子α(TNFα) ELISA 试剂盒购自南京建成生物有限公司。
2实验方法
2.1实验分组与模型建立:将24只大鼠分为分为C组、PH组、B组3组,每组各8只。PH组和B组大鼠给予皮下注射野百合碱50mg/kg; C组注射等量生理盐水,注射完成后将大鼠放回笼中常规喂养; B组自野百合碱注射的当日起,每天腹腔注射1mg/kg·d BML-111连续4周,于大鼠麻醉前,术后第7天,第14天,第21天,第28天记录体重变化情况。
2.2肺动脉压力测量:将10cm硬膜外导管末端1~1.5cm加热拉伸,并使其弯曲成鱼钩状,用注射器注水成功表示肺动脉导管通畅。饲养4周后将大鼠取出进行实验,100ml水合氯醛加入氟哌利多5mg对大鼠行腹腔注射, 剂量为3ml/100g,麻醉后将大鼠固定于手术台上,术中持续面罩给氧。分离大鼠右侧颈外静脉,将充满肝素盐水的右心导管后插入,一端连接换能器另一端与监护仪相连,当置入导管进入右心室稳定后记录其右室收缩压(RVSP),监护仪出现肺动脉波形时,待其稳定后记录平均肺动脉压(MPAP)。压力测量完毕后处死大鼠,游离右室(RV)和左室+室间隔(LV+S)并称重,计算(RV)/(LV+S)。
2.3ET和TNFα含量的测定:肺动脉压力监测完毕后直接将针刺入左心室抽取血液, 离心后取上清,采用酶联免疫吸附法检测血浆ET和TNFα水平。
3统计学处理统计学分析采用SPSS13.0对各组大鼠体重变化的比较采用重复测量资料方差分析,对血流动力学改变和肺肺部炎症因子的情况采用完全随机设计的方差分析,以P<0.05为有显著性差异,以P<0.01为有显著性差异。
结 果
1大鼠生长情况见表1。所有大鼠顺利完成实验。4周结束后,PH组和B组大鼠相比C组大鼠,注射后表现为进食、活动减少,生长减慢,B组大鼠情况略好于PH组。三组大鼠之间体重增长速度存在差异,C组增长最快, B组次之, PH组最慢(P<0.05)。不同时间点的体重有显著性差异(P<0.05),处理方式与时间之间存在交互作用(P<0.05)。
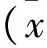
表1 各组大鼠体重变化情况±s)
注:*与C组比较,P<0.05;#与PH组比较,P<0.05
2血流动力学改变见表2。大鼠处死后发现,PH组和B组大鼠MPAP、RV/(LV+S)、RVSP均较C组升高,且PH组比B组升高明显(P<0.05)。
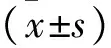
表2 各组大鼠MPAP、RV/(LV+S)、RVSP比较
注:*与C组比较,P<0.05;#与PH组比较,P<0.05
3血浆ET和TNFα的含量测定见表3。PH组和B组大鼠血浆ET和TNFα含量相比C组增高,且PH组比B组增加更明显(P<0.05)。
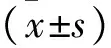
表3 各组大鼠血浆ET和TNFα含量比较
注:*与C组比较,P<0.05;#与PH组比较,P<0.05
讨 论
肺动脉高压是临床众多疾病发展的终末阶段,其发病机制目前仍不完全清楚, 其中炎症反应在肺动脉高压发生发展过程中扮演了重要角色。其中包含有多种炎症介质如白介素、肿瘤坏死因子等,这些炎症介质是导致肺血管发生形态学改变的基础,并最终形成肺动脉高压[5~8]。本实验中采用经典大鼠皮下注射MCT方法诱导肺动脉高压,模型制作成功,实验大鼠行MCT注射后,PH组大鼠生长明显减慢,MPAP、RV/(LV+S)、RVSP相比C组升说明PH组大鼠出现了肺动脉高压。由ELISA法检测发现ET及TNFα浓度均较正常对照组升高,说明MCT注射后诱发大鼠机体产生了炎症反应,进一步证明了炎症反应在肺动脉高压形成中具有重要作用。
ET是迄今为止最强的血管收缩物质,具有较强的收缩肺毛细血管和升高肺动脉压力的作用并导致血管内皮细胞增生和纤维化,MCT已经证实具有升高ET的作用,从而导致肺动脉重构并最终引起肺动脉压力升高,这在本实验中也被证实[9]。TNFα是体内重要的炎症介质,它在炎症、创伤等急性伤害发生时会升高,产生一系列的机体损伤反应并引起炎症信号的级联放大[10],在慢性缺氧和肺心病患者体内含量明显升高从而引起肺微血管改变[6, 11]。
在继往的研究中我们发现给予脂氧素受体激动剂BML-111可明显减轻左向右分流型大鼠肺动脉压力,其机制与降低金属基质蛋白本酶2、9的含量及组织途径抑制物-1的含量有关[12]。进一步的研究发现其作用于野百合碱诱导的肺动脉高压大鼠时,BML-111具有类似的作用,它可以减轻肺组织IL-8、ICAM-1、MCP-1的水平。本实验延续了以往的研究,并发现B组大鼠注射MCT后,四周内连续采用1mg/(kg·d)剂量的BML-111腹腔注射,试验发现MPAP、RV/(LV+S)、RVSP升高幅度小于PH组,进一步说明BML-111具有抑制MCT诱导大鼠肺动脉压力升高的作用。ELISA分析发现B组大鼠炎症因子ET及TNFα的升高幅度与PH组相比明显减轻,说明B组肺动脉压力升高较小的原因可能与BML-111减轻机体ET及TNFα炎症介质产生有关,减轻了炎症所导致的肺血管重构,这与其它的文献[5]研究结果相一致,通过TNFα阻断剂可有效抑制肺动脉高压。
[1]Dorfmuller P, Perros F, Balabanian K,etal. Inflammation in pulmonary arterial hypertension[J]. Eur Respir J, 2003,22(2):358-363.
[2]Humbert M, Montani D, Perros F,etal. Endothelial cell dysfunction and cross talk between endothelium and smooth muscle cells in pulmonary arterial hypertension[J]. Vascul Pharmacol, 2008,49(4~6):113-118.
[3]何振芬, 陈志诚. 肺动脉高压诊治研究进展[J]. 陕西医学杂志, 2012,41(1):110-112,128.
[4]Gomez-Arroyo JG, Farkas L, Alhussaini AA,etal. The monocrotaline model of pulmonary hypertension in perspective[J]. Am J Physiol Lung Cell Mol Physiol, 2012,302(4):363-369.
[5]Wang Q, Zuo XR, Wang YY,etal. Monocrotaline-induced pulmonary arterial hypertension is attenuated by TNF-alpha antagonists via the suppression of TNF-alpha expression and NF-kappaB pathway in rats[J]. Vascul Pharmacol, 2012,141(1):71-77.
[6]Price LC, Wort SJ, Perros F,etal. Inflammation in pulmonary arterial hypertension[J]. Chest, 2012,141(1):210-221.
[7]Kherbeck N, Tamby MC, Bussone G,etal. The role of inflammation and autoimmunity in the pathophysiology of pulmonary arterial hypertension[J]. Clin Rev Allergy Immunol, 2013,71(4):596-605.
[8]Sakao S, Tatsumi K, Voelkel NF. Endothelial cells and pulmonary arterial hypertension: apoptosis, proliferation,interaction and transdifferentiation[J]. Respir Res, 2009,10(13):95-98.
[9]Jasmin JF, Cernacek P, Dupuis J. Activation of the right ventricular endothelin (ET) system in the monocrotaline model of pulmonary hypertension: response to chronic ETA receptor blockade[J]. Clin Sci (Lond), 2003,105(6):647-653.
[10]高洁, 王旭红,陈茜. 皱肺平喘胶囊对COPD大鼠血清IL-(-8)和TNF-a表达的影响[J]. 陕西中医, 2009,30(11):1551-1553.
[11]张艳玲,席文胜,彭敏,等. 补中益气汤治疗慢性阻塞性肺疾病及对血清瘦素TNF-α的影响[J]. 陕西中医, 2011,32(4):391-393.
[12]陈永梅,周作华,赵颖, 等. 脂氧素受体激动剂BML-111对左向右分流大鼠肺动脉压力影响及其机制的研究[J]. 陕西医学杂志, 2013,42(5):518-520.
(收稿:2014-08-20)
The effect of lipoxin receptor agonist BML-111 on rats pulmonary arterial hypertension and mechanisms induced by monocrotaline
Department of Laboratory, Taihe Hospital, Affiliated of Hubei University of Medicine
(Shiyan 442000) Chen YongmeiGong XingruiXiang Yonget al
Objective: To observe the the effect of BML-111 on pulmonary arterial hypertension induced by monocrotaline and potential mechanisms . Methods: 24SD rats randomly divided into three groups: C group, PH group and B group, Both PH group and B group processed subcutaneous injection of 50ug/g monocrotaline while C group received same volume of saline, B group performed intraperitoneal injection of BML-111 1mg·kg-1·d-1from the day when monocrotaline was injected. The observation: MPAP, RVSP, RV/(LV+S), the concentration of endotheline(ET) and tumor necrosis factor α(TNFα) in the plasma. Results: the PH group and B group had higher level of MPAP, RVSP, RV/(LV+S), the plasma concentration of ET and TNFαcompared with C group(P<0.05), B group caused lower increase of MPAP, RVSP, RV/(LV+S), the plasma concentration of ET and TNFαcompared with PH group(P<0.05). Conclusion: BML-111 can ameliorate pulmonary arterial hypertension, part of the reason may be attribute to the reduction the inflammation and decreasing the pulmonary arterial remodeling.
Hypertension,pulmonary/physiopathologyMonocrotaline/chemically inducedModels,animalRats
*湖北省十堰市科技局指导项目(ZD20111016 )
高血压,肺性/病理生理学野百合碱/化学诱导模型,动物大鼠
R363.2
A
10.3969/j.issn.1000-7377.2015.05.003
△通讯作者

