缺氧诱导因子-1α在胆囊癌组织中的表达及临床意义*
陕西省人民医院肝胆外科(西安710068)
李 晖 吴武军 范志勇 宋 勇 胡海田
缺氧诱导因子-1α在胆囊癌组织中的表达及临床意义*
陕西省人民医院肝胆外科(西安710068)
李 晖 吴武军 范志勇 宋 勇 胡海田
目的:探讨缺氧诱导因子(HIF-1α)在胆囊癌组织中的表达及其临床意义。方法:选取30例胆囊癌组织作为观察组,18例正常慢性胆囊炎组织作为对照组,对观察组和对照组分别利用免疫组织化学技术来检测石蜡病理切片组织中HIF-1α的表达情况,进一步分析HIF-1α与胆囊癌临床病理因素及预后之间的关系。结果:HIF-1α蛋白在30例胆囊癌组织中的阳性表达率为63.3%(19/30) , 而在18例胆囊炎组织中均未见表达,两者间有极显著性差异(P<0.01)。HIF-1α表达与肿瘤TNM分期(P<0.05)及淋巴结转移以及肿瘤的大小呈正相关(P<0.05),而与胆囊癌组织分化程度、患者的年龄和性别等无关(P>0.05),与预后呈负相关((35.0% vs 16.7%,P<0.05)。结论:HIF-1α的在胆囊癌的发生发展过程中起着重要作用,可作为判断胆囊癌诊断及预后的有用指标。
胆囊癌是胆道系统最常见的恶性肿瘤,我国流行病学调查研究显示其位于消化道恶性肿瘤的第6位,近20年来其发病率有上升趋势[1]。原发性胆囊癌早期症状不明显且无特异性,诊断时往往已处于晚期,且胆囊癌恶性程度高,浸润快,极易转移。手术治疗仍是目前治疗胆囊癌最主要的方法,但手术切除率低,预后差,5年生存率仅为5%~13%[2,3]。因此,探索采用新的检测指标,研究其在胆囊癌的发生、发展、浸润及转移中的作用机理,将对胆囊癌的临床诊断、预后评价及靶向治疗产生极大的指导价值。有研究证实:缺氧是肿瘤物理微环境的基本特征之一,肿瘤的进展常常伴有肿瘤细胞的迅速增殖以及微环境的缺氧状态[4]。缺氧诱导因子-1是肿瘤细胞对抗缺氧的环境而生成的一种蛋白即核转录调控因子,研究证明:在多种癌前病变及恶性肿瘤中均有HIF-1α的过度表达,能调节缺氧反应基因产物的合成,能够改善肿瘤细胞的能量代谢,促进血管形成,促使细胞增殖转移[5]。本研究旨在探究胆囊癌组织中 HIF-1α的表达与否及相关临床意义。
资料与方法
1 研究对象 随机抽取2008年9月至2010年9月在我院行手术治疗的胆囊癌患者30例,进行随访6~40个月的随访,平均随访 25个月。其中男9例,女21例,年龄45~85岁,中位年龄65.83岁,均已经病理确诊为胆囊腺癌,其中高分化胆囊癌 10例,中分化胆囊癌9例,低分化胆囊癌 11例。另取2008年9月至2010年9月手术切取的18例慢性胆囊炎组织,均取自因患胆囊结石而切除胆囊的患者的胆囊壁,取材时避开出血及坏死组织,镜下诊断全部为慢性胆囊炎。根据1995年UICC制定的胆囊癌TNM分期标准,I+II期7例,III期16例,IV期7例。
2 免疫组化染色方法
2.1 S-P法检测HIF-1α步骤:以5μm为厚度连续石蜡切片,脱蜡并逐级脱水,蒸馏水冲洗10min,为消除内源性过氧化物酶置于0.3%的H2O2中10min,以pH7.4的磷酸盐缓冲液冲洗3次。滴加正常兔血清(福州迈新生物技术开发有限公司),室温孵育25min,pH7.4的磷酸盐缓冲液冲洗3次,去多余液体,滴加一抗(福州迈新生物技术开发有限公司 1:100)放于4℃冰箱放置一晚。将已被生物素标记的羊抗兔二抗Ig G(福州迈新生物技术开发有限公司)滴入并放置于室温15min后,用pH7.4的磷酸盐缓冲液冲洗后滴加DAB显色剂,苏木素复染,经脱水封片等操作后显微镜下观察。
3 结果评估 采用半定量积分法判断阳性结果:按染色强度评:无染色为0分,浅黄色为1分,棕黄色为2分;棕褐色为3分;在400倍的高倍镜视野下取10个视野,每个视野选取100个细胞,计算阳性细胞的百分数:细胞阳性率为0得0分,<25%得1分,25%~50%得2分,>50%得3分。二者积分乘积<2为阴性,>2为阳性。
4 统计学处理 采用SPSS 19.0对肿瘤分化程度、淋巴结转移及TNM与HIF-1的关系用卡方检验进行检验,生存分析采用Kaplan-Meier法并用Log-rank检验,以P<0.05为有显著性差异,P<0.01为有极显著性差异
结 果
1 HIF-1α在胆囊癌中的表达 见图1。HIF-1α蛋白在胆囊癌组织中的阳性表达率为63.3% (19/30);胆囊炎组织内HIF-1α表达评分均小于2分,提示无HIF-1α的过表达。
2 HIF-1α表达与临床病理的关系 见附表。HIF-1α的表达与患者的年龄及性别无关(P>0.05)。HIF-1α蛋白的表达增高与肿瘤的淋巴结转移(P=0.043)及TNM分期(P=0.021)密切相关,而与肿瘤的分化程度无关(P=0.135)。胆囊癌的TNM分期越高,HIF-1α表达率越高。
3 HIF-1α表达对胆囊癌患者预后的影响 生存曲线见图2。19例HIF-1α表达阳性的胆囊癌患者的3年生存率为16.7%,而11例HIF-1α表达阴性的患者3年生存率为35.0%。中位生存时间分别为19和35个月,具有显著性差异(P=0.037)。
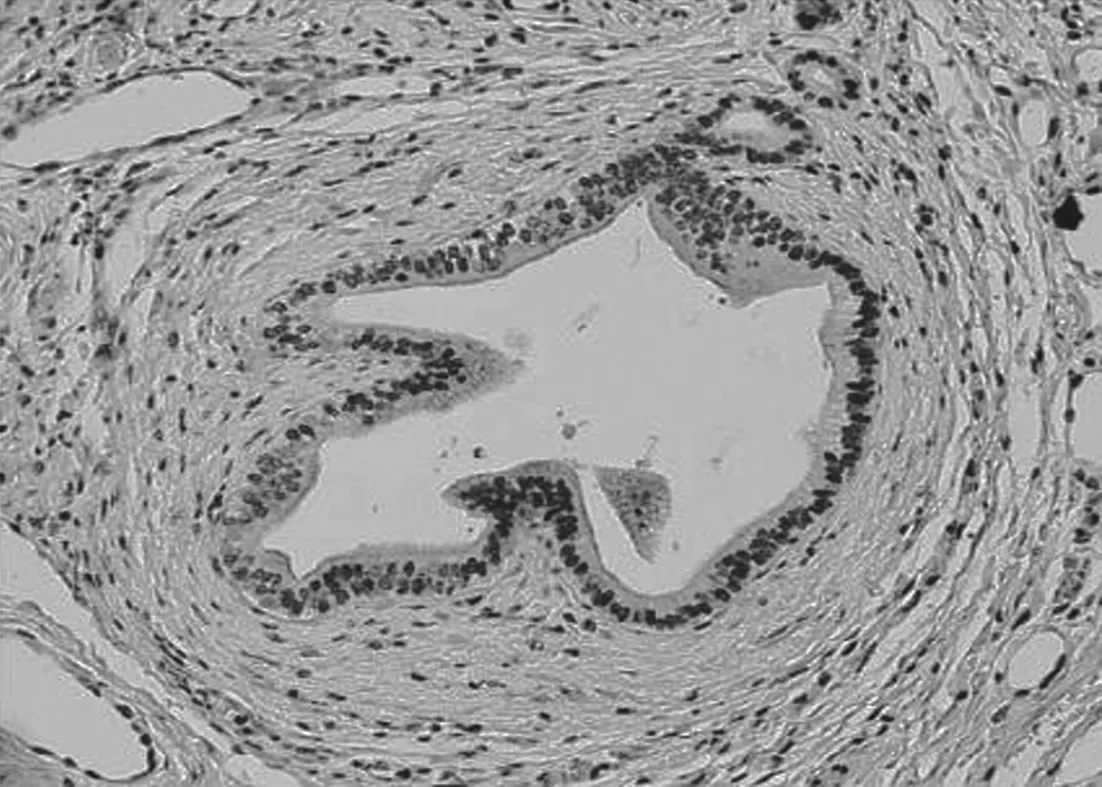
图1 HIF-1α表达阳性(HE ×200)

临床病理因素HIF⁃1α阳性n(%)χ2值P值年龄 ≤60岁 >60岁7(58.3%)12(66.7%)0.2150.643性别 男 女5(55.6%)14(66.7%)0.3350.563肿瘤分化程度 高分化 中分化 低分化40%(4)66.6%(6)81.8%(9)4.0060.135淋巴结转移 有 无73.9%(17)28.6%(2)4.7510.043TNM分期 I+II III IV28.6%(2)62.5%(10)100%(7)7.7000.021肿瘤大小 ≤2cm 2~5cm >5cm3(37.5%)9(69.2%)8(88.9%)4.8140.028
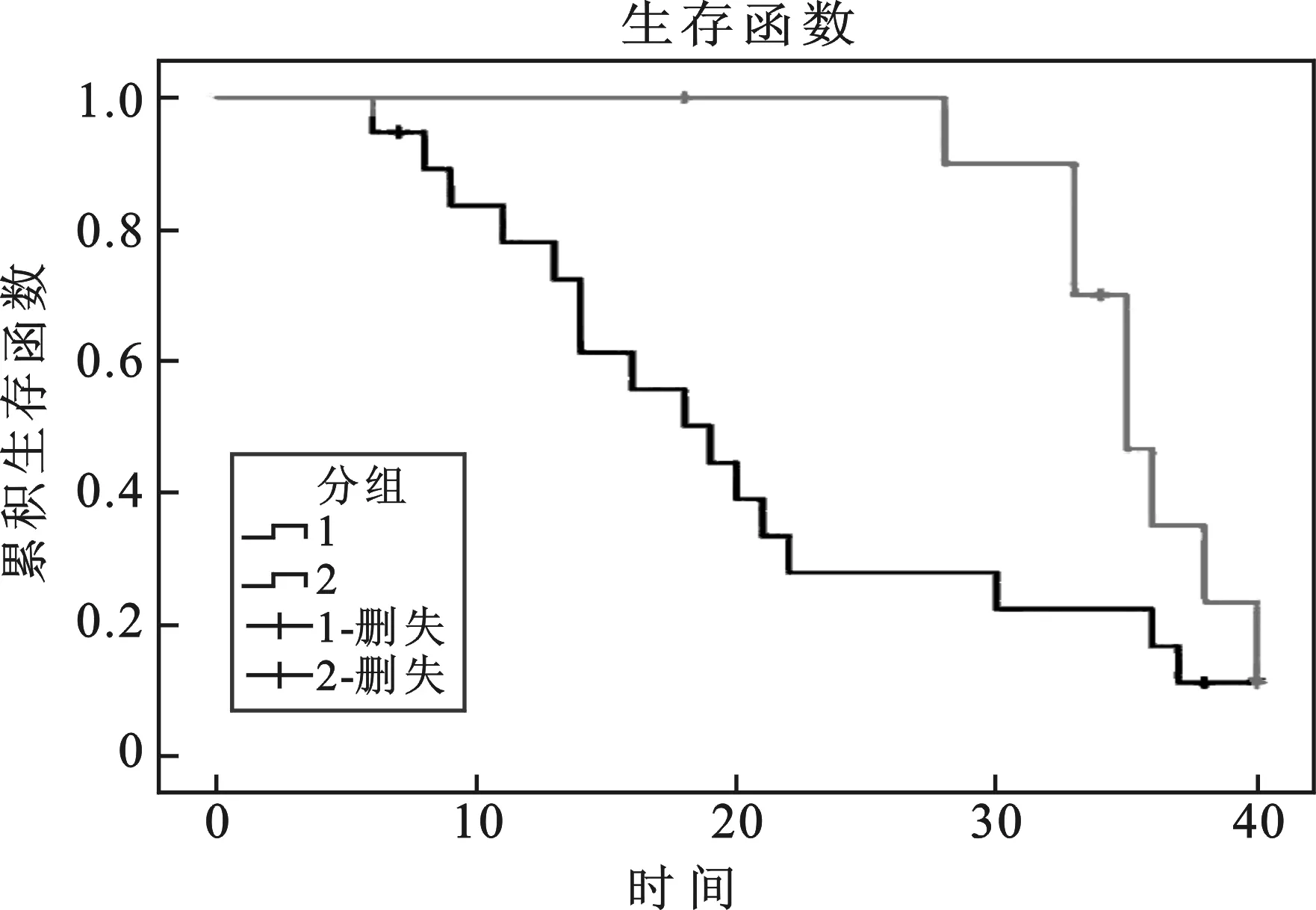
图2 生存曲线
讨 论
胆囊癌是胆道系统常见的高度恶性肿瘤,占消化道肿瘤第6[1],其恶性程度高,起病隐匿,早期诊断较困难,患者就诊时多属中晚期,预后较差。胆囊癌的发生与性别、年龄、职业、种族等均有着密切关系,因此提高胆囊癌的早期诊断水平及预后判断,对临床诊疗及治疗方案的选择有重要意义。胆囊癌是一种实体恶性肿瘤,其快速增殖和相对血供缺乏造成肿瘤细胞局部缺氧,肿瘤细胞为适应缺氧环境,通过调控相应靶基因表达出乏氧诱导因子-1,从而激活肿瘤血管生成,改善肿瘤细胞代谢,为肿瘤组织增加血、氧、能的供应。 HIF-1α与肿瘤的发生、发展密切相关。
缺氧条件下哺乳动物和人体内产生的HIF-1是一种二聚体转录因子,主要由HIF-1α和HIF-1β两个组份结合而组成,对缺氧诱导的基因表达起着关键性作用[6]。HIF-β功能相对较弱,HIF-1α是主要的功能基团,对氧的较为敏感,决定了HIFα的活性。乏氧状态下HIF-1α被活化,通过调节下游靶基因而导致包括肿瘤细胞适应低氧,血管生成和浸润等一系列的生物学反应[7,8]。国内外大量实验研究均证实了HIF-1α在恶性肿瘤中的高表达。Zhong等[9]发现了至少13 肿瘤的细胞中HIF-1α呈不同程度的表达。笔者也在既往的研究中发现HIF-1α在胰腺癌中过表达,而在胰腺正常组织中表达为阴性[10]。Erdenebulgan等[11]研究发现:在胆囊癌的患者中HIF-1α的高表达与淋巴结转移以及静脉侵犯相关,提示预后较差,HIF-1α可作为预测胆囊癌恶性行为的辅助参数。本实验研究数据显示:HIF-1α蛋白在30例胆囊癌组织中的阳性表达率为63.3%(19/30) , 而在18例胆囊炎组织中均未见表达,两者间有极显著性差异。提示HIF-1α可用于胆囊癌的辅助诊断,与国内外其他学者研究结果相一致[10~12]。我们的实验结果也提示了HIF-1α与肿瘤淋巴结转移(0.043)、TNM分期以及肿瘤大小呈正相关,与肿瘤病理分级、患者年龄以及性别无关,这与国内外其它学者的研究结果基本一致[11,12],说明胆囊癌局部癌细胞过量表达HIF-1α,以适应相对缺氧的肿瘤微环境,HIF-1α在胆囊癌发生发展中可能起着重要作用,与胆囊癌病情的进展及预后密切相关,HIF-1α的检测对评估患者的病情有辅助作用。有关患者的预后及生存率,我们利用Kaplan-Meier分析及生存曲线得出,胆囊癌患者的预后与HIF-1α的表达呈负相关,HIF-1α的过表达的胆囊癌患者与无HIF-1过表达的患者相比,中位生存时间显著不同,提示HIF-1α是预测胆囊癌预后的重要指标,这些与国外学者研究结果一致[11,12]。总之,HIF-lα蛋白表达水平的检测对胆囊癌的诊断、分期、疗效判断及预后判断有重要价值。
有关肿瘤缺氧问题研究日益深入,而以HIF-1α为靶点的基因治疗研究将有效得阻断氧信号的阻断,特异性阻断肿瘤细胞对缺氧环境的适应,减少肿瘤血管生成和肿瘤浸润。对特异性阻断HIF-1α信号通路的药物的研究将为胆囊癌和其他实体肿瘤的治疗开辟新的方向。
[1] 邹声泉,张 林. 全国胆囊癌临床流行病学调查报告[J]. 中国实用外科杂志,2000,20(1):43-46.
[2] Hundal R,Shaffer EA.Gallbladder cancer: epidemiology and outcome[J].Clin Epidemiol,2014 ,7(6):99-109.
[3] Donohue JH.Present status of the diagnoses and treatment of gallbladdercarcinoma[J].J Hepatobiliary Panereat Surg,2001,8(6):530-534.
[4] Marx J.Cell biology:How cells endure low oxygen[J].Science,2004,303 (5663): 1454-1456.
[5] Caro J. Hypoxia regulation of gene transcription[J]. High Alt Med Biol,2001,6(2):145-154.
[6] 樊利芳,刁路明.缺氧诱导因子-1与肿瘤[J]. 中华病理学杂志,2002, 31(2):168-170.
[7] 朱 宏, 施瑞华. 缺氧诱导因子与肿瘤血管生成[J]. 国外医学肿瘤学分册,2004 ,31(8):591-593.
[8] Shi YH,Fang WG .Hypoxia-inducible factor-l in tumor angiogenesis[J].World J Gastmenterol,2004,10(8) :1082-1087.
[9] Zhong H.Over expression of HIF-1αin common human Cancer and their metastases[J] .Cancer Res,1999,59(22):253-255.
[10] 李 晖,吴武军. 缺氧诱导因子-1在胰腺癌组织中的表达及临床意义[J]. 现代肿瘤医学,2011, 19(11):2257-2260.
[11] Batmunkh E, Shimada M, Morine Y,etal. Expression of hypoxia-inducible factor-1 alpha (HIF-1α) in patients with the gallbladder carcinoma[J].Int J Clin Oncol,2010, 15(1):59-64.
[12] Sun W, Shen ZY ,Zhang H ,etal. Overexpression of HIF-α in primary gallbladder carcinoma and its relationship to vasculogenic mimicry and unfavourable prognosis[J]. Oncol Rep,2012,27(6):235.
(收稿:2014-11-16)
The significance and expression of HIF-1α in gallbladder carcinoma
Department of Hepatobiliary Surgery,Shaanxi Provincial Hospital
(Xi’an 710068) Li Hui Wu Wujun Fan Zhiyong et al
Objective:To detect the expression of HIF-1α(hypoxia inducible factor lα) in the tissue of gallbladder carcinoma and to evaluate its clinical significance. Methods:HIF-1α was examined in 30 patients of primary gallbladder carcinoma and in 18 patients suffering cholecystitis respectively using Immunohistochemistry technology,and then analyze the relationship between clinico-phathological factor of gallbladder carcinoma and the expression of HIF-1. Results: The positive rate of HIF-1 in gallbladder carcinomas was 63.3%(19/30). In 18 cases of cholecystitis ,no HIF-1αexpression was detected. The positive rate of HIF-1 in gallbladder carcinomas was significantly higher than that in the tissues of cholecystitis (P<0.01). HIF-1 protein expression was closely relevant with lymphatic metastasis(P=0.043), TNM stage(P=0.021)and tumor size(P=0.028) while was negative correlations with prognosis((35.0% vs 16.7%,P=0.037), but uncorrelated with the pathological grading,the age and sex of patients(P>0.05) . Conclusion: High expression of HIF-1 plays a considerable role in development of gallbladder carcinoma. HIF-1 could possibly become a helpful marker for diagnosing and assessing prognosis in the carcinoma of gallbladder .
Gallbladder neoplasms/pathology Immunohistochemistry @HIF-1
*陕西省科学技术研究发展计划项目(2014K11-03-03-11)
胆囊肿瘤/病理学 免疫组织化学 @缺氧诱导因子
R735.8
A
10.3969/j.issn.1000-7377.2015.05.028

