温和冷应激及复温对牦牛卵巢颗粒细胞的影响
杨 琨,张 倩,李谷月,潘阳阳,余四九,何俊峰,崔 燕
(甘肃农业大学动物医学院,兰州 730070)
温和冷应激及复温对牦牛卵巢颗粒细胞的影响
杨 琨,张 倩,李谷月,潘阳阳,余四九,何俊峰,崔 燕*
(甘肃农业大学动物医学院,兰州 730070)
细胞冷应激反应是一个复杂的过程,它包括低温本身的应激阶段和复温后的应激阶段。本研究以牦牛卵巢颗粒细胞为研究对象,利用实时荧光定量PCR、Western blot技术,分析温和冷处理1、5 d及复温1、2、4、8及24 h条件下,细胞内CIRBP、HSP70及P53变化规律。结果显示,细胞在25 ℃培养5 d,然后通过复温至37 ℃,会影响细胞生理状态以及诱导细胞应激反应。CIRBP的表达量在25 ℃温和冷处理第1天开始上升,并且在复温后24 h左右恢复到正常水平。HSP70的表达量在37 ℃复温培养后逐步上升,复温8 h出现峰值,随后下降。P53 mRNA表达水平在复温培养4 h出现峰值,随后下降,并且其在CIRBP及HSP70 mRNA高表达时,均有明显的下降。结果表明,低温会诱导细胞CIRBPmRNA和蛋白表达水平的上升;HSP70能够被冷应激后的复温诱导;CIRBP和HSP70都具有抗应激损害和细胞凋亡的作用。这些数据将为亚低温和复温在各种研究和治疗领域的应用提供参考。
牦牛;卵巢颗粒细胞;温和冷应激;复温;CIRBP;HSP70;P53
细胞应激反应普遍存在于生物界,热、冷、缺氧、低渗等应激因素均可打破细胞代谢的相对平衡,并引发细胞内一系列复杂的基因表达和生理适应性反应过程。目前,人们已对热休克效应进行了深入研究,而冷应激方面的研究资料相对较少。另外,正常生理或意外情况下,恒温动物或培养条件下的细胞、组织和器官都有可能受到各种温度冷应激及复温的影响,例如心脏手术或脑损伤治疗过程中常需降低体温,器官和细胞的保存运输通常也在低温下进行,以及提升重组蛋白质产量也是通过降低温度得到实现[1-4]。冷应激后复温至正常温度,观察到的过高热表型变化,表明细胞正在以某种方式使其自身适应温和温度,并感应相对而不是绝对的低温[5]。温和冷应激(25~35 ℃)和热休克都是以某种方式诱导相似的表型修饰,有研究报道,虽然一些对温度变化较敏感的蛋白质表达量不变或增加,但其转录和翻译速率会普遍下降[6-7]。另外,冷应激还会影响mRNA稳定性的调节、替代转录起始位点和影响最终剪接[8]。还有资料显示,温和冷应激也能够引起代谢下降[9-10]、细胞周期停滞[11]、凋亡程序活化、细胞骨架分解等[4,10-12]。
在众多的冷休克蛋白(Cold shock protein,CSP)中,冷诱导RNA结合蛋白(Cold inducible RNA binding protein,CIRBP)受到广泛关注。CIRBPmRNA表达是通过控制启动子的冷应激元件进行转录[4]。在亚低温其表达显著增加,这似乎是适应冷应激的关键决定因素,并且能通过各种机制诱导冷特异性因子转录、翻译[7,10,13],另外,研究发现CIRBP基因具有抗应激损害和细胞凋亡的作用。热应激蛋白(Heat stress proteins,HSPs)是由细胞核内高度保守的热应激基因编码的蛋白,普遍存在于整个生物界,几乎所有的细胞均能合成HSPs。HSP充当蛋白质的分子伴侣,参与许多细胞的正常生理过程,直接参与蛋白质从初生链合成到多亚基复合体折叠、装配的整个生物合成,并参与蛋白质向内质网的移位、参与分解错装的蛋白质等,并与新生肽和多肽链中错配的部分结合,对调节细胞内环境的稳定具有重要作用。另外,研究表明HSPs还可调节细胞的氧化还原状态[14],并在一些促凋亡效应发生时,能够防止细胞凋亡。另外,HSPs能够被热应激或冷应激后的复温诱导[15]。HSP70是一族最保守和最重要的热休克蛋白,其在正常细胞内表达水平较低,而在应激状态下显著升高,可作为应激反应和评价组织细胞处于危险状态的分子生物标志,因此已成为HSPs中关注的焦点。P53肿瘤抑制蛋白是含有P53、P63以及P73的P53蛋白超家族内一名成员。P53蛋白在细胞凋亡过程中发挥至关重要的作用,能够将来自细胞应激反应的各种信息,如DNA损伤、缺氧、核苷酸缺失等信号传递给相关基因,诱导细胞周期停滞和细胞凋亡[16-17]。
牦牛常年生活在低温、低氧和高海拔的青藏高原,其繁殖效率受到严重影响,本课题组主要从事牦牛胚胎移植的研究。通常将器官、细胞从高原运输到实验室有较长时间的延迟,在此期间,细胞通常保持在22~25 ℃,为其提供一个“睡眠模式”,避免在运输过程中受到各种干扰[18],其后,培养物转移到37 ℃培养箱中进行培养。在前期试验中,发现细胞在25 ℃处理5 d,37 ℃复温后,形态发生变化。因此,将进一步对25 ℃细胞储存期间及37 ℃复温后,CIRBP、HSP70以及P53 mRNA及蛋白的表达变化及相关性进行研究。这些数据带来的一些新的细胞和分子机制,可能对组织和器官的低温储存提供参考,并为研究生理低温、治疗低温或意外低温后复温的适应性提供依据。
1 材料与方法
1.1 试验动物
青海省西宁市乐家湾屠宰场3岁左右的健康母牦牛。
1.2 主要试剂
胎牛血清、Trizol购自美国Invitrogen公司。反转录酶、Taq酶、限制性内切酶、pMD18-T vector、荧光定量试剂盒均为大连宝生物公司产品。DMEM/F12培养基、胰蛋白酶、DEPC、Tris碱、四甲基联苯胺和TEMED购自Sigma公司。丙烯酰胺和N,N′-亚甲双丙烯酰胺购自Amresco公司。蛋白分子质量标准marker和预染蛋白质marker购自Fermentas公司。SDS购于合肥博美生物科技有限责任公司,滤纸购自美国伯乐公司。PVDF膜购自Millipor公司,蛋白裂解液购自Solarbio公司,ECL曝光液购自碧云天公司。普通琼脂糖凝胶DNA回收试剂盒、质粒小提试剂盒、免疫组化SP试剂盒、增强型HRP-DAB底物显色试剂盒购自北京天根有限公司。山羊源CIRBP多克隆抗体(ab106230)及兔源HSP70多克隆抗体(ab79852)购自英国Abcam,鼠源内参Actin抗体(I-19)购自Santa Cruz公司,兔源FSHR多克隆抗体(bs-0895R)、兔抗羊(bs-0295G-HRP)、羊抗兔(bs-0294R-HRP)、羊抗鼠(bs-0296G-HRP)购自北京博奥森公司。引物由TaKaRa公司合成,测序由华大基因公司完成。
1.3 试验方法
1.3.1 卵巢颗粒细胞的培养 按照F.Caloni等[19]方法,并适当调整进行常规卵巢颗粒细胞培养试验。待细胞汇合率达90%以上传代,同时冷冻保存。将传至3~5 代的细胞用于试验(图1A)。
冷处理和复温试验中,细胞进行胰蛋白酶消化并以10 000个·cm-2接种并在37 ℃下培养。在冻存细胞前,收集部分细胞样品作为对照组(0 d),并提取RNA或蛋白质。对于温和低温试验,细胞在相同培养基25 ℃下处理1~5 d,然后转至37 ℃下进行1~24 h复温。
1.3.2FSHR免疫细胞化学染色 采用免疫细胞化学技术测定促卵泡刺激素受体(FSHR) 在颗粒细胞的特异性表达,具体步骤参照文献[20-21]。1.3.3 引物设计与合成 牦牛P53基因测序引物(yakP53-1、P53-2)根据GenBank中家牛(NM174201)、瘤牛(U74486)、绵羊(NM001009403)、野猪(AF124298)的P53基因序列设计得到;根据牦牛CIRBP(KF682140)、HSP70(KC790105)、β-actin(DQ838049)及提交的P53(KF682141)基因序列设计荧光定量引物,由TaKaRa公司合成(表1)。序列分析使用NCBI在线软件、MEGA5和DNAman软件。
表1 PCR扩增引物和荧光定量PCR引物
Table 1 PCR primers used in the RT-PCR and real-time RT-PCR

引物名称Primersname引物序列(5'-3')Primerscomposition产物大小/bpPCRproductssize/bpYakP53senseprimer-1CGACCTCGGAGCGTGCAT1390YakP53antisenseprimer-1GCCACAGGCTGAGCAGATGAYakP53senseprimer-2GGTGCTTAGACCTCTGCTTGG707YakP53antisenseprimer-2GGTGACATGGTGTGCCTTGCYakCIRBPreal-timeSGTATGCCGTTTTCTTTGGCTTC126YakCIRBPreal-timeASGCTCTACTCTGCCTGCCTCAAYakHSP70real-timeSACCTTCGACGTGTCCATCCT145YakHSP70real-timeASCCTTCTTGTGCTTGCGTTTGYakP53real-timeSCCCATCCTCACCATCATCAC80YakP53real-timeASGCACAAACACGCACCTCAAYakβ-actinreal-timeSAGGCTGTGCTGTCCCTGTATG207Yakβ-bactinreal-timeASGCTCGGCTGTGGTGGTAAA
1.3.4 mRNA的提取,反转录cDNA及PCR扩增 收集颗粒细胞,用TRIzol提取总RNA,反转录成cDNA。PRC反应体系为20 μL(模板1 μL,上、下游引物各0.5 μL,Taq PCR Master Mix 10 μL,无菌去离子水8 μL) 。取10 μL PCR产物,用1%琼脂糖凝胶电泳检测,150 V 20 min。紫外灯下观察并用凝胶成像系统采集图像。胶回收试剂盒回收PCR产物片段,华大基因公司测序。
1.3.5 荧光定量PCR 使用罗氏480仪器进行试验。反应体系:10 μL SYBR Premax Tag、 0.5 μL 上、下游引物、1 μL cDNA 样品和8 μL 灭菌超纯水。反应程序:95 ℃预变性5 min;95 ℃变性10 s,62 ℃退火10 s,72 ℃延伸15 s,共45个循环。扩增结束后进行熔解曲线分析。每管样品设4个重复,每个试验重复3次。试验数据用SPSS 21.0软件进行方差分析,Duncan法进行均值的多重比较。
1.3.6 Western blot方法检测组织中蛋白水平的表达 收集细胞,裂解30 min,4 ℃ 1 200 g离心5 min,收集上清,测定蛋白浓度。(1)加入上样缓冲液,沸水煮10 min。(2)SDS聚丙烯酰胺凝胶电泳,每孔上样10 μL,蛋白至分离胶,电压由80 V切换为100V直至电泳结束。(3)转膜用300 mA 的电流,4 ℃电泳1~2 h。(4)牛奶封闭2 h,一抗4 ℃过夜孵育、二抗37 ℃孵育2 h。(5)加入曝光液显色5~10 min观察结果。取3次曝光结果,通过ImageJ软件测定WB条带表达量,重复3次。

2 结 果
2.1 免疫组织化学染色鉴定颗粒细胞
FSHR免疫细胞化学染色是卵巢颗粒细胞的特异性染色。收集正常培养的卵巢颗粒细胞(图1A);进行FSHR免疫染色,阳性定位于细胞胞浆,呈棕褐色着染(图1B);阴性对照组并未检测到阳性表达(图1C)。
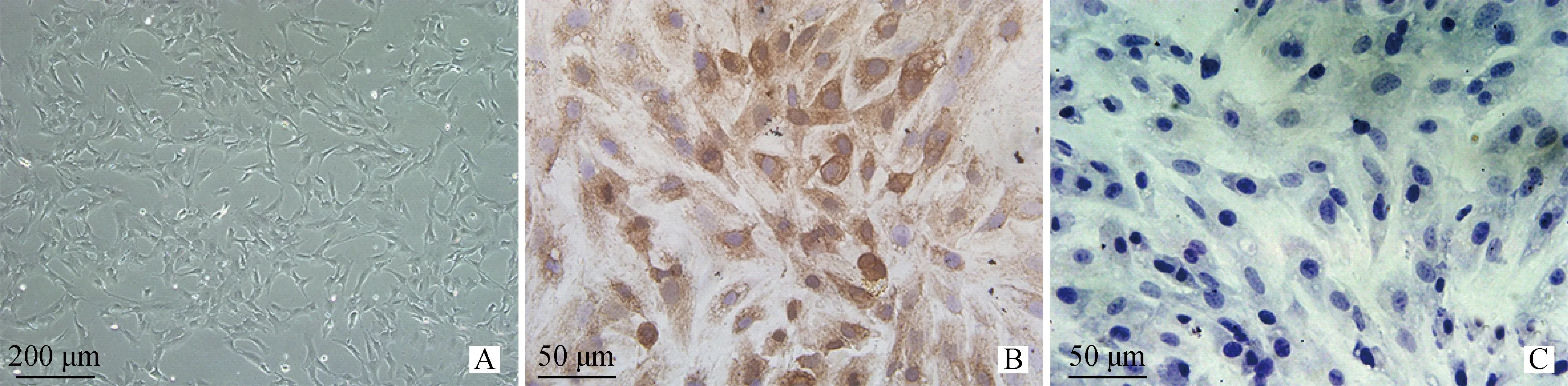
A.牦牛卵巢颗粒细胞培养照片(倒置显微镜 100×);B.牦牛卵巢颗粒细胞FSHR免疫细胞化学染色,颗粒细胞呈阳性(400×);C.牦牛颗粒细胞FSHR免疫细胞染色的阴性对照(400×)A.Cultured ovary granulosa cells of yak after 48 h(100×);B.Immunohistochemical staining of FSHR in cultured yak ovary granulosa cells,and the nucleus of granulosa cells was positive for the expression of FSHR(400×);C.The negative control of FSHR immunohistochemical staining in granulosa cells of yak(400×)图1 牦牛卵巢颗粒细胞形态及免疫组化Fig.1 Morphological characteristic and immunohistochemistry of yak ovarian granular cells
2.2CIRBP的表达
2.2.1CIRBPmRNA表达 通过RT-PCR检测CIRBP荧光定量引物,发现条带单一,片段大小符合试验设计(图2A)。qRT-PCR检测CIRBPmRNA的表达水平,细胞在25 ℃处理第1天时,CIRBP表达水平开始升高为对照组的1.5倍,在25 ℃培养第5天时,表达量为对照组的4.6倍。在25 ℃低温处理5 d后,进行复温培养,CIRBP表达量迅速下降,24 h后接近对照组表达水平(图2B)。
2.2.2 CIRBP蛋白的表达 通过Western blot检测CIRBP蛋白的表达情况,细胞在25 ℃处理第1天时,CIRBP表达水平开始升高为对照组的1.6倍,在25 ℃培养第5天时,表达量为对照组的18倍。在25 ℃低温处理5 d后,进行复温培养,CIRBP表达量迅速下降,24 h后为对照组表达水平3倍左右(图2C和图2D)。
2.3HSP70的表达
2.3.1HSP70 mRNA表达 通过RT-PCR检测HSP70荧光定量引物,发现条带单一,片段大小符合试验设计(图3A)。通过qRT-PCR检测HSP70 mRNA的表达水平,细胞在25 ℃冷处理5 d期间,HSP70 mRNA表达量无显著变化,然而,37 ℃复温培养后,导致表达量逐步增加(8 h时高达对照组的4.7倍),随后下降(图3B)。
2.3.2 HSP70蛋白表达 通过Western blot检测HSP70蛋白的表达情况,细胞在25 ℃冷处理的5 d期间,HSP70蛋白的表达量无明显变化,只在第5天有略微上升,为对照组的1.2倍。在25 ℃低温处理5 d后进行复温培养,HSP70表达量逐渐上升,8 h后达到峰值,为对照组的3.6倍,随后表达量下降,24 h后为对照组表达水平2倍左右(图3C和图3D)。
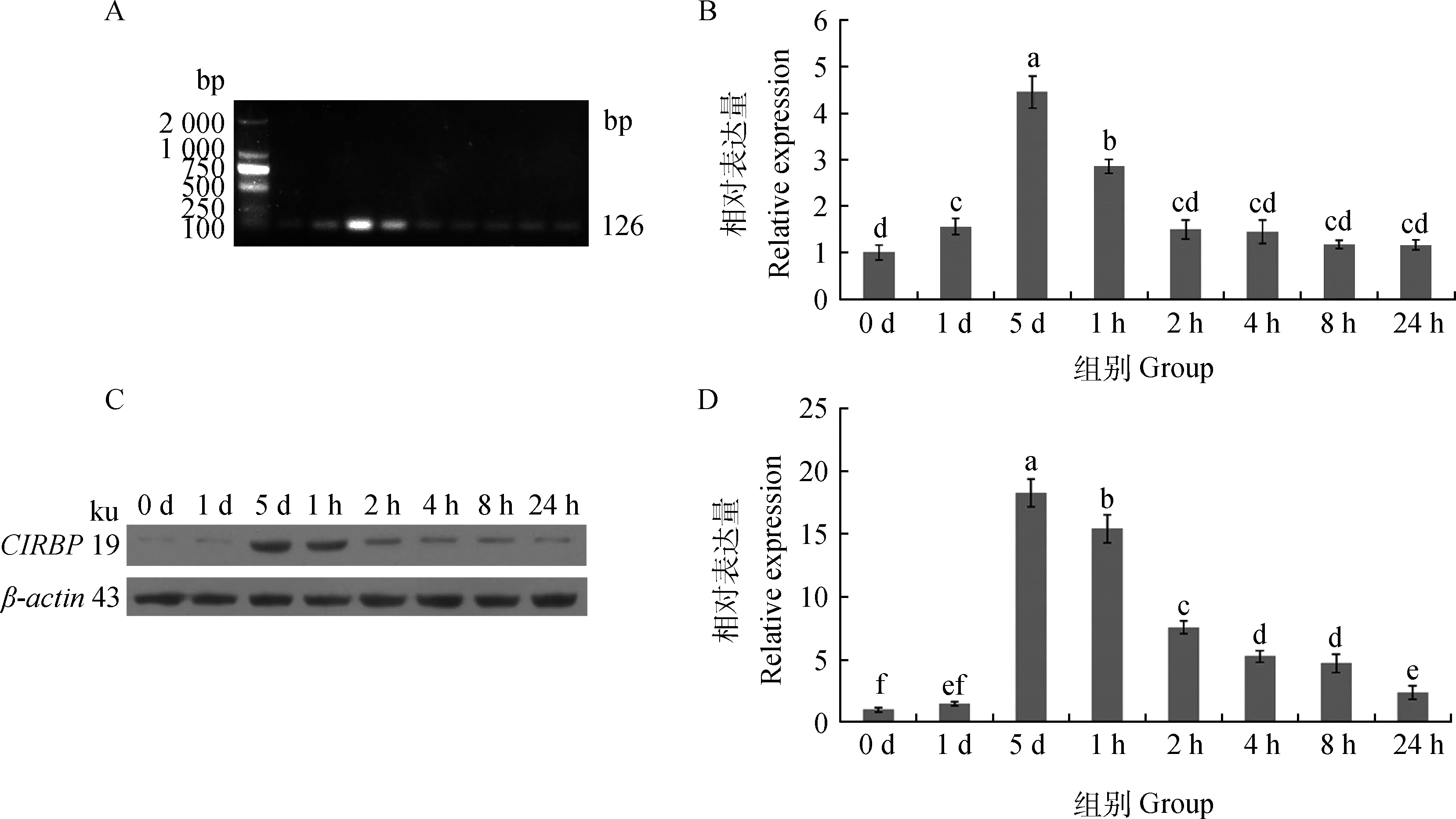
表达量=平均值±SE,n=3,对照组0 d值确定为1。0 d.正常对照组,1 d和5 d.25 ℃培养1和5 d,1、2、4、8和24 h.25 ℃冷处理后,复温37 ℃培养1、2、4、8和24 h。标有a,b,c,d不同字母的组间差异极显著(P<0.01),标有相同字母的组间无差异(P>0.05)。下同。A.CIRBP荧光定量引物的RT-PCR反应凝胶电泳图;B.荧光定量PCR反应结果;C.CIRBP(19 ku)及β-actin(43 ku)蛋白Western blot结果;D.ImageJ对Western blot结果分析The expression are mean ± SE,n=3 .Values at 0 d were arbitrary taken as 1.0 d.The control group;1 d and 5 d.1 or 5 days at 25 ℃;1 h,2 h,4 h,8 h and 24 h.5 days at 25 ℃ followed by 1 to 24 h at 37 ℃.Different letters mean significant difference between the groups(P<0.01),same letters mean no difference between groups(P>0.05).The same as below.A.The picture of RT-PCR amplification products with agarose gel electrophoresis;B.The qRT-PCR result of CIRBP mRNA levels;C.The picture is the Western blot expression of CIRBP(19 ku) and β-actin(43 ku) antibody;D.The ratio of CIRBP protein expressed quantity to β-actin protein expressed quantity calculated by the software ImageJ图2 冷应激及复温后CIRBP表达变化Fig.2 Cold-shock and rewarming affect CIRBP expression
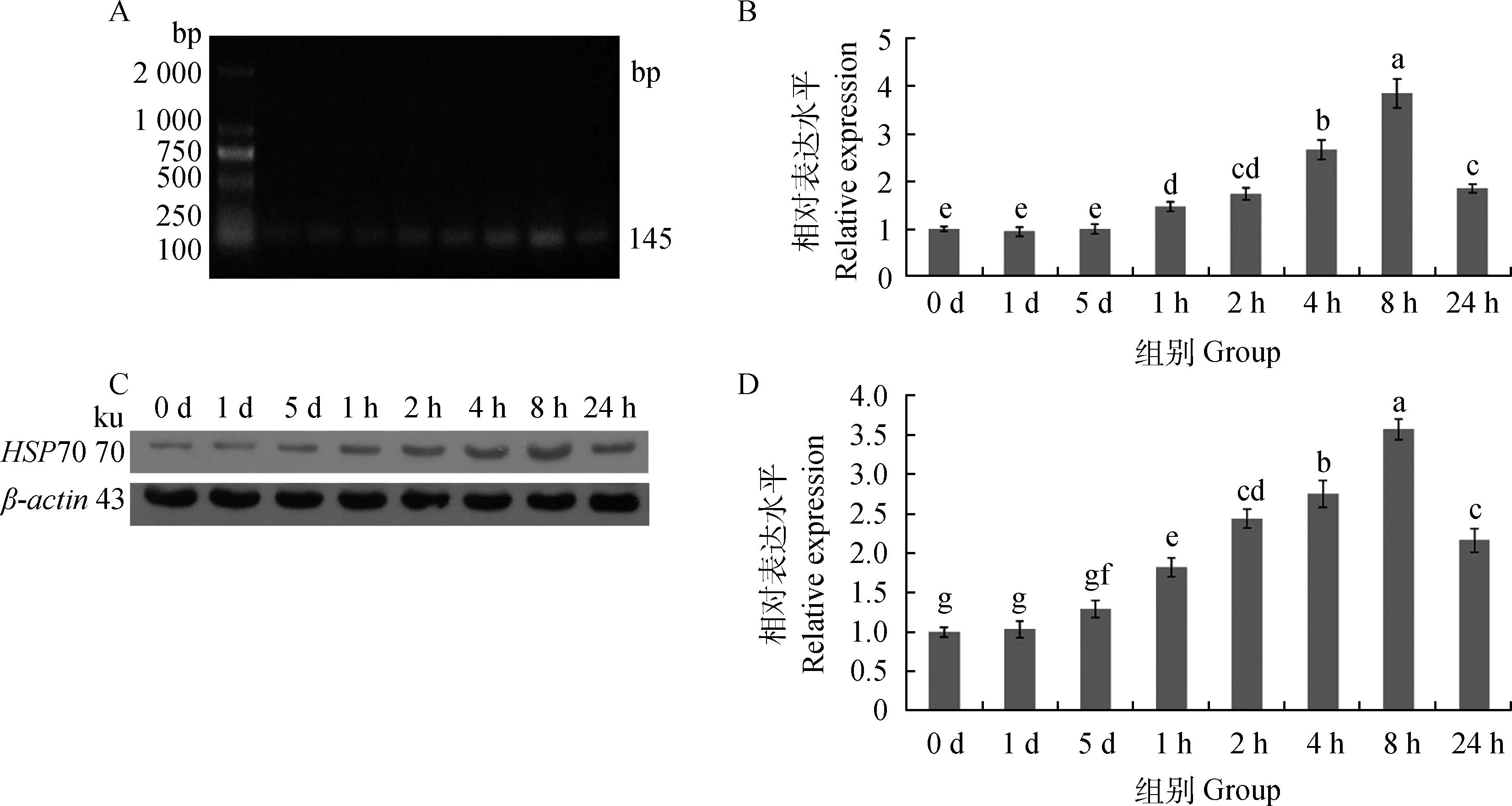
A.HSP70荧光定量引物的RT-PCR反应凝胶电泳图;B.荧光定量PCR反应结果;C.HSP70(70 ku)及β-actin(43 ku)蛋白Western blot结果;D.ImageJ对Western blot结果分析A.The picture of RT-PCR amplification products with agarose gel electrophoresis;B.The qRT-PCR result of HSP70 mRNA levels ;C.The picture is the Western blot expression of HSP70(19 ku) and β-actin(43 ku) antibody;D.The ratio of HSP70 protein expressed quantity to β-actin protein expressed quantity calculated by the software ImageJ图3 冷应激及复温后HSP70表达变化Fig.3 Cold-shock and rewarming affect HSP70 expression
2.4P53基因克隆和表达
2.4.1P53基因克隆 将P53-1及P53-2扩增得到的2段基因序列进行拼接(MEGA5软件),得到牦牛P53 mRNA序列,全长2 002 bp,并提交至GenBank(KF682141)。使用DNAman软件分析可知牦牛P53 mRNA的编码区为52~1 210 bp,全长1 159 bp,预测编码蛋白大小约为43 ku。通过NCBI在线BLAST软件分析发现牦牛P53 mRNA与家牛、瘤牛的序列相似性较高,达到99%,与印度水牛相似性为98%,与绵羊和野猪的相似性为95%(图4A)。
2.4.2P53 mRNA的表达 通过RT-PCR检测HSP70荧光定量引物,发现条带单一,片段大小符合试验设计(图4B),细胞在25 ℃冷处理5 d期间,P53 mRNA表达水平在第1天显著上升约为对照组2倍,第5天则明显下降,约为对照组表达量的一半。37 ℃复温培养后,P53表达量迅速上升,在复温培养4 h出现峰值,为对照组的4倍;8 h时明显下降,随后24 h又略微上升为对照组2倍(图4C)。
3 讨 论
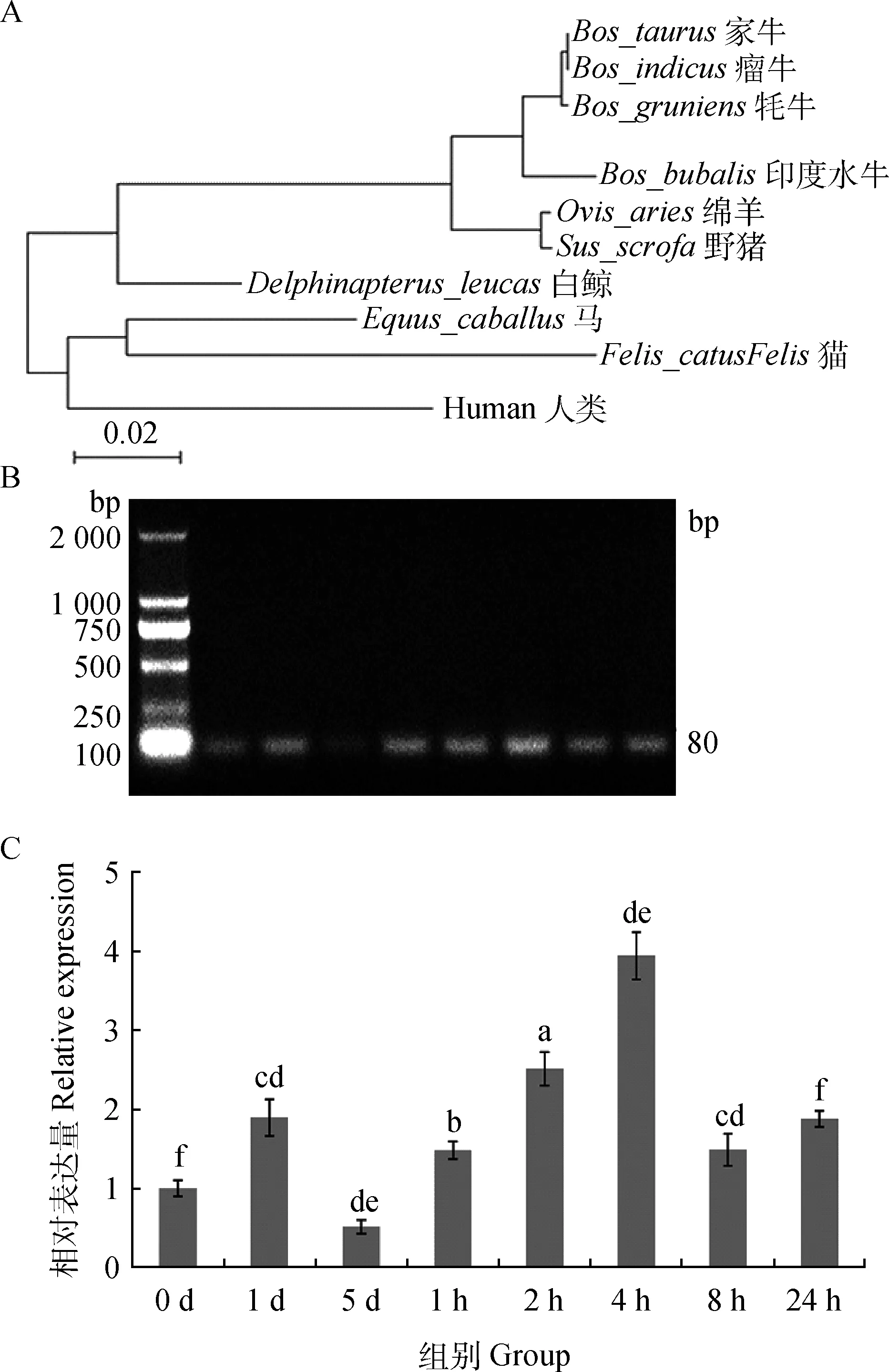
A.牦牛P53基因进化树;B.P53荧光定量引物的RT-PCR反应凝胶电泳图;C.荧光定量PCR反应结果A.The phylogenetic tree of yak P53 with its closely related counterparts based on the P53 cDNA sequences;B.The picture of RT-PCR amplification products with agarose gel electrophoresis;C.The qRT-PCR result of P53 mRNA levels图4 冷应激及复温后P53 mRNA表达变化Fig.4 Cold-shock and rewarming affect P53 mRNA expression
笔者重点研究了在亚低温及返回正常生理温度时期,细胞内CIRBP、HSP70、P53 mRNA和蛋白的变化规律及相互联系,与其他学者研究结果相同,认为低温能够诱导一些基因的表达、RNA加工和细胞内信号的重新编码,并影响细胞形态和生存。此外,返回到生理温度(37 ℃)后,冷应激造成的影响会持续或加剧[1,3,10]。在低温冷处理期,基因转录和翻译速率降低,但有一些特定的基因仍然能够继续以正常速率表达[2,22],低温也可以调节特定的转录产物如CIRBP的表达水平与稳定性[23]。BALB/3T3小鼠成纤维细胞CIRBP在各种冷处理温度下持续表达,培养温度从37 ℃降至32 ℃,6 h后,能够诱导CIRBPmRNA和蛋白质的显著表达,在32 ℃培养24 h后,诱导CIRBPmRNA和蛋白的强烈表达,而在39或42 ℃培养时,CIRBP的表达下降[24]。同时,H.Nishiyama等还发现,对不同来源细胞系如小鼠TAMA26支持细胞、BMA1骨髓基质细胞和HepG2人类肝癌细胞,进行温和冷热处理也会诱发上述类似的效应[24-25]。与上述报道一致,本研究显示在25 ℃培养时,颗粒细胞CIRBP的表达量上升,复温后,表达量返回到基础水平。这表明低温会诱导细胞CIRBPmRNA和蛋白表达水平的上升,可能有保护细胞免受冷应激损伤的作用。试验结果中出现蛋白表达高于基因的情况,如:CIRBP蛋白的表达在25 ℃培养第5天时,基因的表达量为对照组的4.6倍(qRT-PCR),而蛋白的表达量为对照组的18倍。在排除试验误差的情况下,qRT-PCR约是2n次方变化与Western blot不同,且两种方法的敏感性不一样,一个是拷贝数的差异,一个是微克数的变化。如果一种增加,另一种降低,这往往与RNA或蛋白在细胞内的稳定性相关。如RNA稳定性差,易降解,则出现RNA表达降低,蛋白表达相对增加,反之亦然。探究出现该结果的真正原因及相关调节机制,需要进行后续深入的研究证实。
E.Laios等[26]报道,大鼠心肌细胞在4 ℃低温冷处理1 h,检测不到HSP,然而37 ℃复温2 h后,检测到HSP70,复温4~6 h,HSP70表达水平最高,在6 h后开始下降,同时他们还发现,细胞在4、10、15、20或25 ℃冷处理后,37 ℃复温4 h,都可以检测到HSP70。与其它过高热研究结果一致,冷应激后返回到常温会诱导细胞热休克样反应,HSP70表达水平在复温后的8 h,表达量超过了常温时期的正常水平[5,10,26]。本研究显示,细胞HSP70 mRNA和蛋白表达水平在25 ℃温和冷处理5 d期间,无显著变化,然而37 ℃复温导致其表达水平的逐步上升,随后下降。这说明过高热应激时检测到热休克的感应机制是相对的而不是绝对的,因为在复温后的应激阶段,同样也会检测到热休克效应。
研究显示,人类恶性胶质瘤A-172细胞在4、15或20 ℃冷处理1 h,随后37 ℃复温培养10 h,会诱导P53积累[27]。此外,C.D.Gregory报道,体外培养的Burkitt淋巴瘤衍生的细胞系保留了亲代细胞的增殖和细胞凋亡能力,将其在1 ℃冷处理20~30 min或25 ℃处理4 h,复温培养1~2 h后,通过形态学特征和DNA片段检测到细胞凋亡[28]。有关亚低温对细胞凋亡的影响存在争议,一些研究表明冷应激诱导细胞凋亡,而另一些研究认为它能够抵抗随后热诱导的细胞凋亡,具有一定保护作用[28-29]。这些差异可能是由于所使用的细胞、温度变化后的分析时间和分析方法不同所导致。在本研究的试验模型中,温和低温处理期间,细胞凋亡因子P53 mRNA表达在第1天明显上升,而在第5天明显下降并低于正常水平,随后复温期间其表达量急剧增加,在4 h达到峰值后,8 h显著下降。综上可知,在CIRBP和HSP70 mRNA表达量达到峰值时,P53 mRNA的表达也显著下降,有可能说明CIRBP和HSP70可保护细胞免受应激诱导的凋亡,具体机制需要进一步研究,以确定冷应激处理如何以及在多大程度上阻止或诱导细胞凋亡。
4 结 论
本研究对低温本身的应激阶段和复温后的应激阶段内牦牛卵巢颗粒细胞内CIRBP、HSP70和P53 mRNA及蛋白表达量进行了初探,研究结果对组织和器官的低温储存提供参考,并为研究生理低温、治疗低温或意外低温后复温的适应性提供依据。
[1] AL-FAGEEH M B,MARCHANT R J,CARDEN M J,et al.The cold‐shock response in cultured mammalian cells:Harnessing the response for the improvement of recombinant protein production[J].BiotechnolBioeng,2006,93(5):829-835.
[2] AL-FAGEEH M,SMALES C.Control and regulation of the cellular responses to cold shock:the responses in yeast and mammalian systems[J].BiochemJ,2006,397:247-259.
[3] ROOBOL A,CARDEN M J,NEWSAM R J,et al.Biochemical insights into the mechanisms central to the response of mammalian cells to cold stress and subsequent rewarming[J].FebsJ,2009,276(1):286-302.
[4] FUJITA J.Cold shock response in mammalian cells[J].JMolMicrobBiotech,1999,1(2):243-255.
[5] LIU A Y,BIAN H,HUANG L E,et al.Transient cold shock induces the heat shock response upon recovery at 37 degrees C in human cells[J].JBiolChem,1994,269(20):14768-14775.
[6] ERMOLENKO D N,MAKHATADZE G I.Bacterial cold-shock proteins[J].Cmls-CellMolLifeSci,2002,59(11):1902-1913.
[7] DRESIOS J,ASCHRAFI A,OWENS G C,et al.Cold stress-induced protein Rbm3 binds 60S ribosomal subunits,alters microRNA levels,and enhances global protein synthesis[J].PNatlAcadSciUSA,2005,102(6):1865-1870.
[8] ARS E,SERRA E,DE LA LUNA S,et al.Cold shock induces the insertion of a cryptic exon in the neurofibromatosis type 1(NF1) mRNA[J].NucleicAcidsRes,2000,28(6):1307-1312.
[9] PLESOFSKY N,BRAMBL R.Glucose metabolism in Neurospora is altered by heat shock and by disruption ofHSP30[J].Bba-MolCellRes,1999,1449(1):73-82.[10] SONNA L A,FUJITA J,GAFFIN S L,et al.Invited review:effects of heat and cold stress on mammalian gene expression[J].JApplPhysiol,2002,92(4):1725-1742.
[11] SHAPIRO I M,LUBENNIKOVA E I.Population kinetics of cells in tissue culture incubated at low temperature[J].ExpCellRes,1968,49(2):305-316.
[12] CREAGH E M,SHEEHAN D,COTTER T G.Heat shock proteins-modulators of apoptosis in tumour cells[J].Leukemia,2000,14(7):1161-1173.
[13] LADOMERY M.Problems and paradigms:Multifunctional proteins suggest connections between transcriptional and post‐transcriptional processes[J].Bioessays,1997,19(10):903-909.
[14] JIAN Z,LI K,LIU L,et al.Heme oxygenase-1 protects human melanocytes from H2O2-induced oxidative stress via the Nrf2-ARE pathway[J].JInvestDermatol,2011,131(7):1420-1427.
[15] FUJITA J.Cold shock response in mammalian cells[J].JMolMicrobBiotech,1999,1(2):243-255.
[16] MOLLEREAU B,MA D.TheP53 control of apoptosis and proliferation:lessons from Drosophila[J].Apoptosis,2014,19(10):1421-1429.
[17] GOTTLIEB T M,OREN M.P53 and apoptosis[J].SeminCancerBiol,1998,8(5):359-368.
[18] HUNT L,HACKER D L,GROSJEAN F,et al.Low-temperature pausing of cultivated mammalian cells[J].BiotechnolBioeng,2005,89(2):157-163.
[19] CALONI F,RANZENIGO G,CREMONESI F,et al.Effects of a trichothecene,T-2 toxin,on proliferation and steroid production by porcine granulosa cells[J].Toxicon,2009,54(3):337-344.
[20] WU J,WANG Y,XIAO W,et al.Assessment of recombinant porcine follicle-stimulating hormone receptor using a novel polyclonal ectodomain antibody[J].EndocrRes,2004,30(2):269-285.
[21] TARU SHARMA G,DUBEY P K,SAI KUMAR G.Localization and expression of follicle‐stimulating hormone receptor gene in buffalo(Bubalusbubalis) Pre-antral follicles[J].ReprodDomestAnim,2011,46(1):114-120.
[22] BURDON R H.Temperature and animal cell protein synthesis[C].SympSocExpBiol,1986,41:113-133.[23] AL-FAGEEH M B,SMALES C M.Cold-inducible RNA binding protein(CIRBP) expression is modulated by alternative mRNAs[J].RNA,2009,15(6):1164-1176.
[24] NISHIYAMA H,ITOH K,KANEKO Y,et al.A glycine-rich RNA-binding protein mediating cold-inducible suppression of mammalian cell growth[J].JCellBiol,1997a,137(4):899-908.
[25] NISHIYAMA H,HIGASHITSUJI H,YOKOI H,et al.Cloning and characterization of humanCIRBP(cold-inducible RNA-binding protein) cDNA and chromosomal assignment of the gene[J].Gene,1997b,204(1):115-120.
[26] LAIOS E,REBEYKA I M,PRODY C A.Characterization of cold-induced heat shock protein expression in neonatal rat cardiomyocytes[J].MolCellBiochem,1997,173(1-2):153-159.
[27] OHTSUBO T,WANG X,TAKAHASHI A,et al.P53-dependent induction of WAF1 by a low-pH culture condition in human glioblastoma cells[J].CancerRes,1997,57(18):3910-3913.
[28] GREGORY C D,MILNER A E.Regulation of cell survival in burkitt lymphoma:Implications from studies of apoptosis following cold‐shock treatment[J].IntJCancer,1994,57(3):419-426.
[29] GUEDEZ L,STETLER-STEVENSON W G,WOLFF L,et al.Invitrosuppression of programmed cell death of B cells by tissue inhibitor of metalloproteinases-1[J].JClinInvest,1998,102(11):2002.
(编辑 程金华)
Effects of Mild Cold Shock Followed by Warming Up at 37 ℃ on the Ovarian Granulosa Cellular Stress Response of the Yak
YANG Kun,ZHANG Qian,LI Gu-yue,PAN Yang-yang,YU Si-jiu,HE Jun-feng,CUI Yan*
(CollegeofVeterinaryMedicine,GansuAgriculturalUniversity,Lanzhou730070,China)
The cellular effects of hypothermia has been recognized a complex process including a stress response to cold and subsequent rewarming.In this study,real-time fluorescence quantitative PCR and Western blot techniques were used to observe the dynamic expression ofCIRBP,HSP70 andP53 in the yak ovarian granulosa cells.Cells were preincubated at 25 ℃ for 1 and 5 d,and rewarmed at 37 ℃ for 1,2,4,8 and 24 h.The results showed that hypothermia and subsequent rewarming affected cell biology and induced a cellular stress response.The expression ofCIRBPwas increased at 25 ℃ already at day 1 and returned to basal level upon rewarming after 24 h.While the expression ofHSP70 was gradually increased upon rewarming at 37 ℃,maximal expression was occurred at 8 h after rewarming and followed by decline.Moreover the maximal expression ofP53 was appeared at 4 h after rewarming and followed by a decline.Additionally,the observation thatP53 mRNA was significantly decreased,a process that accompanied a maximal expression ofCIRBPandHSP70 mRNA,suggested that the expression ofCIRBPmRNA and protein was increased upon exposure to hypothermia,andHSP70 was induced upon rewarming.Overall,theCIRBPandHSP70 were shown to play a role in protecting cells from the deleterious effects of stress and apoptosis.These findings would bring new insights into the potential beneficial effects of mild hypothermia and rewarming used in various research and therapeutical fields.
yak;ovarian granulosa cells;mild cold shock;rewarm;CIRBP;HSP70;P53
10.11843/j.issn.0366-6964.2015.05.008
2014-12-11
国家自然科学基金(31360594;31272616)
杨 琨(1986-),男,山东诸城人,博士,主要从事动物组织学与胚胎学研究,E-mail:119260378@qq.com
*通信作者:崔 燕,教授,E-mail:cuiyan369@sina.com
S823.8+5.2
A
0366-6964(2015)05-0738-08

