枯草芽孢杆菌对绵羊瘤胃上皮细胞β-防御素-1表达的影响
王 佩,范燕茹,金 鑫,杨银凤*
(1.内蒙古农业大学 兽医学院,呼和浩特 010018; 2.农业部动物疾病临床诊疗技术重点实验室,呼和浩特 010018)
枯草芽孢杆菌对绵羊瘤胃上皮细胞β-防御素-1表达的影响
王 佩1,2,范燕茹1,2,金 鑫1,2,杨银凤1,2*
(1.内蒙古农业大学 兽医学院,呼和浩特 010018; 2.农业部动物疾病临床诊疗技术重点实验室,呼和浩特 010018)
选用益生枯草芽孢杆菌研究其对体外培养的绵羊瘤胃上皮细胞β-防御素表达的调节作用。首先,在体外成功培养绵羊瘤胃上皮细胞,然后用枯草芽孢杆菌对体外培养的绵羊瘤胃上皮细胞进行不同浓度、不同时间的刺激,利用荧光定量PCR技术(Real-time fluorescence quantitative PCR,RT-PCR)从mRNA水平检测刺激后上皮细胞中绵羊β-防御素-1(Sheep beta-defensin-1,SBD-1)基因表达水平的差异。结果表明:当菌液浓度为1010cfu·mL-1刺激上皮细胞8 h后,SBD-1的表达量达到最高;不同的菌液浓度诱导下SBD-1的表达量均有显著增加,109、1010、1011cfu·mL-1菌液浓度刺激下,SBD-1的表达量与空白相比差异极显著(P<0.01)。结果表明,枯草芽孢杆菌能够诱导绵羊瘤胃上皮细胞内SBD-1基因的表达。
β-防御素-1;瘤胃上皮细胞;枯草芽孢杆菌;荧光定量PCR
抗菌肽(Antimicrobial peptides,AMPs)是一种小分子多肽,是存在于各种生物如哺乳动物、节肢动物、植物中的一种天然抗生素,具有对革兰阳性菌、革兰阴性菌、真菌和病毒的广谱抗微生物活性[1],是许多生物的先天性免疫防御机制的一部分。防御素是一类富含半胱氨酸的阳离子内源性抗菌肽,是抗菌肽中的一个大家族。哺乳动物中,防御素主要分为3大类:α-防御素、β-防御素、θ-防御素[2]。β-防御素在牛、羊、猪和人类等许多物种中被发现,主要是由各器官的上皮细胞产生[3]。在绵羊体内发现有两种β-防御素存在,即绵羊β-防御素-1(SBD-1)和绵羊β-防御素-2(SBD-2)。绵羊β-防御素的表达大多在上皮细胞中,且主要在消化道和呼吸道中表达,在消化道中,SBD-2只表达于舌和远端回肠,而SBD-1表达较广,在整个消化道(从舌到结肠)都有,并且在瘤胃中表达量最多[4-6]。
益生菌是一类对宿主有益的活性微生物。在反刍动物中,益生菌可促进生长、提高饲料利用效率[7],而且,益生菌还能够改善胃肠道功能,参与机体免疫调节,然而,益生菌的作用机理还尚未明确。最近的研究表明,益生菌能够通过诱导抗菌肽比如防御素等来稳定胃肠道屏障功能。2007年,M.Schlee等[8]发现,益生大肠杆菌Nissle 1917可诱导人β-防御素-2表达量的增加;2008年,M.Schlee等[9]研究表明,乳酸菌菌株也能够诱导人β-防御素-2的表达。截至目前,研究者多使用的是肠上皮细胞及乳杆菌,而关于胃上皮细胞、枯草芽孢杆菌与β-防御素相互关系尚未见报道。大量研究表明,枯草芽孢杆菌对动物的生长繁殖和正常生理状态的维持都有重要意义,T.Marubashi等[10]发现,枯草芽孢杆菌能有效地改善鲮鱼的生长和免疫力,J.H.Lee等[11]发现,枯草芽孢杆菌可通过抑制人乳腺癌细胞内细菌的生长而抑制癌细胞生长,芽孢杆菌作为益生菌开发应用的潜力很大,并且,我国芽孢杆菌资源丰富[12]。因此,本研究采用RT-PCR技术检测益生菌枯草芽孢杆菌对绵羊瘤胃上皮细胞中SBD-1表达的影响,为在分子水平上揭示益生菌对防御素的调控机理提供一定的基础及依据。
1 材料与方法
1.1 材料
1.1.1 主要试剂和仪器 细胞培养基:DMEM/F12培养基(Hyclone)。细菌培养基:LB培养基,1 L蒸馏水中加入10.0 g 胰蛋白胨、5.0 g 酵母提取粉、5.0 g NaCl、15.0 g 琼脂,121 ℃ 灭菌15 min。细胞角蛋白一抗(Sigma)、飞捷FAST200 RNA提取试剂盒(飞捷公司)、TaKaRa反转录试剂盒(DRR037A)、TaKaRa荧光定量PCR酶(RR820A)、CO2培养箱(Thermo)、显微成像系统(CKX41,Olympus)、净化工作台(杭州苏净)、多功能酶标仪(SynergyTMH4,Biotek)、普通PCR仪、实时荧光定量PCR仪(VIIA7,ABI)等。
1.1.2 绵羊瘤胃上皮细胞的获取 试验材料来自于呼和浩特市北亚屠宰场的绵羊。
1.1.3 供试菌株 枯草芽孢杆菌CMCC63501购于中国微生物菌种网。
1.2 试验方法
1.2.1 绵羊瘤胃上皮细胞的培养及鉴定 将取来的瘤胃组织用灭菌生理盐水冲洗去除瘤胃内容物后,钝性分离组织的黏膜上皮层和固有层,然后将其放入PBS溶液中带入细胞间,所用PBS溶液中含 1 mg·mL-1青霉素、 500 μg·mL-1链霉素、100 μg·mL-1庆大霉素、50 μg·mL-1两性霉素。带入细胞间后,再用上述PBS溶液反复清洗3次,之后,用0.25% Trypsin-0.02% EDTA消化液于37 ℃ 消化,于显微镜下观察,至消化液中出现上皮细胞为止,收集,于37 ℃、5% CO2培养箱中静置培养,所用培养基为含20% 胎牛血清、 200 μg·mL-1青霉素、 100 μg·mL-1链霉素、50 μg·mL-1庆大霉素、25 μg·mL-1两性霉素 、2 μg·mL-1胰岛素-转铁蛋白-硒添加剂、β-巯基乙醇的F12液体培养基。
当原代细胞数量达到细胞培养瓶的80%~90%后,便可将细胞传于12孔板,进行传代培养。传代细胞生长至80%~90%后,对细胞进行形态学观察及免疫细胞化学鉴定[13],鉴定为上皮细胞后,则可用于刺激试验。
1.2.2 枯草芽孢杆菌的培养 将枯草芽孢杆菌接种于LB培养基中,37 ℃、200 r·min-1氧培养24 h。按照倍比稀释法用无抗生素DMEM/F12培养基将枯草芽孢杆菌菌液的浓度调为:1012、1011、1010、109、108cfu·mL-1,即可用于细胞刺激试验。
1.2.3 瘤胃上皮细胞和枯草芽孢杆菌的共培养 将传代细胞用PBS洗涤3次,每孔加入1 mL 无血清无抗生素DMEM培养基进行孵育。孵育24 h后,向细胞板中每孔加入900 μL 的无血清无抗生素的DMEM培养基,并分别加入100 μL浓度为1010、109、108、107、106cfu·mL-1的枯草芽孢杆菌菌液和DMEM/F12作为空白对照,置37 ℃ 培养2 h。刺激2 h后,用含双抗的PBS冲洗3次,加入含双抗无血清的DMEM培养基,分别培养2、4、8、12和24 h。
1.2.4 瘤胃上皮细胞总RNA的提取 用含双抗的PBS将共培养后的瘤胃上皮细胞冲洗3次后,按照FAST200RNA提取试剂盒说明书进行RNA的提取:①加入RA2液500 μL,充分颠倒混匀5~10次,静置1 min。②将样本裂解物全部吸入或倒入内套管,离心1 min。 ③取出内套管,吸取外套管中液体后放回内套管,加入500 μL洗液,离心1 min,重复一次。④取出内套管,吸取外套管中液体后放回内套管,不加洗液,离心1 min。⑤将内套管移入新的1.5 mL Eppendorf管,在膜中央加入洗脱液25~50 μL。⑥室温静置1 min后,离心1 min,获得总RNA。所提RNA用1.5%琼脂糖凝胶电泳来检测RNA质量,同时,用酶标仪测A260 nm和A280 nm及其比值,以检测RNA浓度和纯度。
1.2.5 总RNA的反转录 以提取的瘤胃上皮细胞总RNA为模板,用TaKaRa反转录试剂盒(DRR037A)进行反转录反应,所用反应体系为10 μL:5×Prime Script Buffer 2 μL,Prime Script RT Enzyme Mix 0.5 μL,OLigo dT Primer(50 μmol·mL-1) 0.5 μL,Random 6 mers(100 μmol·mL-1) 0.5 μL,样品RNA 6.5 μL。反应条件为37 ℃ 15 min,85 ℃ 5 s。RT产物cDNA于-20 ℃保存备用。
1.2.6 RT-PCR 根据GenBank中提供的SBD-1基因(U75250)和内参因β-actin(U39357)序列,用DNAStar软件设计特异性引物,并由上海生工生物公司合成。SBD-1基因引物:上游P1:5′-GGCTCCATCACCTGCTCCTC-3′,下游P2:5′-CGTCTTCGCCTTCTGTTACTTCTT-3′,β-actin基因引物:上游P3:5′-GTCACCAACTGGGA-CGACA-3′,下游P4:5′-AGGCGTACAGGGACAGCA-3′,以cDNA为模板,进行RT-PCR反应。
反应体系为20 μL:SYBR Premin Ex Taq(2×) 10 μL,Up primer(10 μmol·mL-1) 0.8 μL,Down primer(10 μmol·mL-1) 0.8 μL,cDNA模板2 μL,dH2O 6.4 μL。扩增程序:95 ℃ 预变性30 s;95 ℃ 变性5 s,63 ℃ 退火34 s,50个循环;熔解程序:95 ℃ 5 s;60 ℃ 30 s;95 ℃ 15 s,每个样品的目的基因及内参基因分别设置3个重复。反应结束后,根据扩增曲线的Ct值计算定量结果,并对数据进行统计学分析,然后通过应用统计学分析软件SPSS 17.0的统计程序和单因子方差分析中的最小显著法(Least significant difference)对每组试验数据进行综合统计分析。
将cDNA以10倍浓度进行梯度倍比稀释,将5个浓度的样品分别进行SBD-1和β-actin实时荧光定量PCR扩增,则可得到不同浓度下SBD-1和β-actin基因表达的标准曲线。
1.3 数据处理
SBD-1基因的相对表达量采用ΔΔCt法计算:ΔCt(目的基因)=Ct(目的基因)-Ct(内参基因);ΔΔCt=Ct(枯草芽孢杆菌刺激组)-Ct(对照组)。目的基因的相对表达量=2-ΔΔCt,当扩增效率接近等于1时,可简化为2-ΔCt公式进行目的基因相对表达量的计算。
2 结 果
2.1 绵羊瘤胃上皮细胞培养
2.1.1 绵羊瘤胃上皮细胞原代培养 用0.25% 胰蛋白酶对绵羊瘤胃上皮组织连续消化后,在显微镜下观察,可看到大小均一、单个存在的折光度较高的细胞,且数量较多(图1A),即可收集培养。培养4 d后,贴壁细胞有的单个存在,有的呈岛屿状分布,形态多呈中间厚四周薄的圆形或椭圆形(图1B)。培养6 d后,小岛屿状的细胞团生长成大片细胞(图1C)。8 d后,片状细胞相互连接在一起,细胞数量达80%~90%,几乎将整个细胞瓶铺满,细胞成鹅卵石铺路状,形状多为圆形或多角形,界限较为清晰,有个别细胞因生长密度大导致形态有所变化(图1D),可以进行传代培养。
2.1.2 绵羊瘤胃上皮细胞传代培养 传代后的细胞,培养2 d后,细胞呈铺路石状的单个细胞(图2A),与原代细胞相比,形态更加清晰,上皮样细胞鹅卵石铺路状更为明显,且相邻距离较近。4 d后,细胞量可达到80%~90%,镜下观察基本没有空余的位置,细胞界限明显(图2B),可以进行后续试验。
2.1.3 绵羊瘤胃上皮细胞的鉴定 传代培养后的细胞,细胞呈铺路石状,是典型的的上皮细胞形态(图3A)。经免疫细胞化学染色法鉴定,细胞胞浆呈黄褐色,即角蛋白阳性反应,细胞核经H.E染色呈现蓝色(图3B)。经鉴定所培养细胞为上皮细胞,可用于后续试验。

A.消化后的绵羊瘤胃上皮细胞;B.培养4 d后的绵羊瘤胃上皮细胞;C.培养6 d后的绵羊瘤胃上皮细胞;D.培养8 d后的绵羊瘤胃上皮细胞A.The ruminal epithelial cells in sheep after digestion; B.The ruminal epithelial cells in sheep after 4 days primary culture; C.The ruminal epithelial cells in sheep after 6 days primary culture; D.The ruminal epithelial cells in sheep after 8 days primary culture图1 绵羊瘤胃上皮细胞的原代培养结果 100×Fig.1 The primary culture of ruminal epithelial cells in sheep 100×
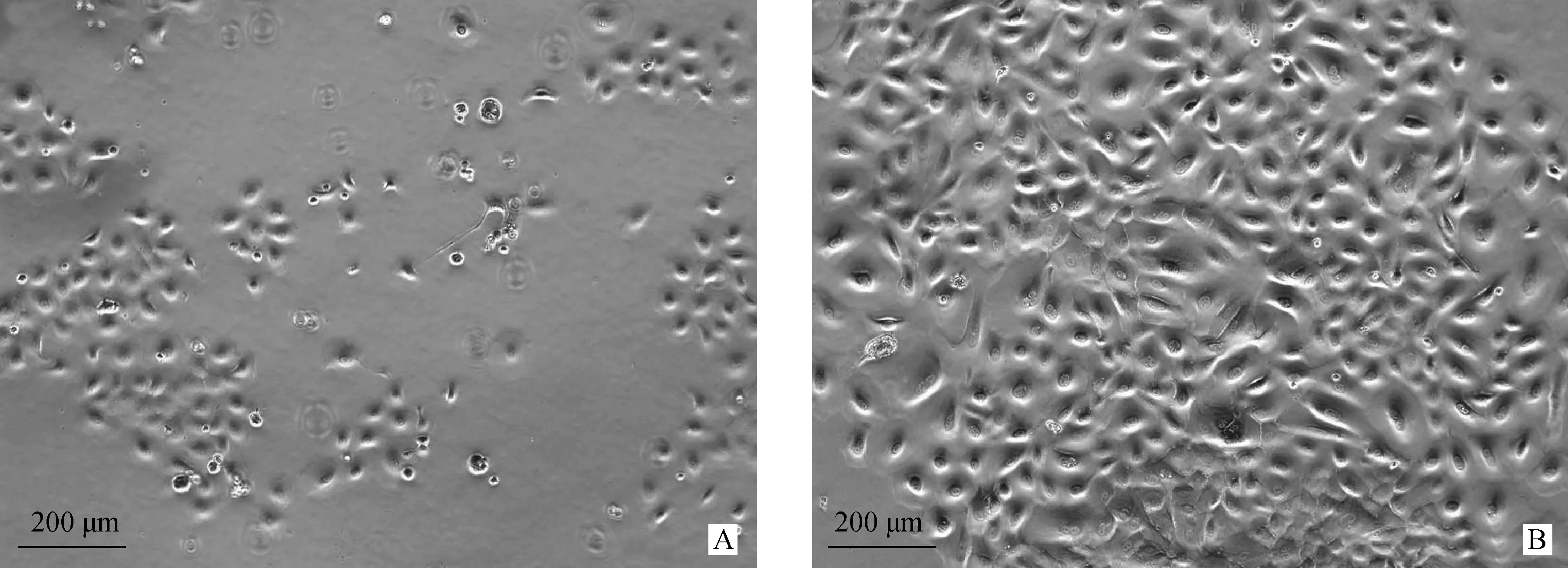
A.传代培养2 d后的绵羊瘤胃上皮细胞;B传代培养4 d后的绵羊瘤胃上皮细胞A.The ruminal epithelial cells in sheep after 2 days subculture; B.The ruminal epithelial cells in sheep after 4 days subculture图2 绵羊瘤胃上皮细胞的传代培养结果 100×Fig.2 The subculture of ruminal epithelial cells in sheep 100×

A.传代培养4 d后的绵羊瘤胃上皮细胞(100×);B.绵羊瘤胃上皮细胞免疫细胞化学染色结果(200×)A. The ruminal epithelial cells in sheep after 4 days subculture(100×); B.The ruminal epithelial cells in sheep by immunocytochemical staining(200×)图3 绵羊瘤胃上皮细胞的鉴定结果Fig.3 The verification of ruminal epithelial cells in sheep
2.2 瘤胃上皮细胞总RNA的检测
将所提取的总RNA用琼脂糖凝胶电泳进行检测,可见28S rRNA和18S rRNA条带清晰完整,5.8S条带隐约可见,均无拖尾(图4),说明所提RNA无降解。酶标仪检测样品A260 nm/A280 nm比值在2.0左右,表明几乎无蛋白质和多糖污染,RNA满足试验要求。

图4 瘤胃上皮细胞总RNA电泳结果Fig.4 The total RNA of ruminal epithelial cells
2.3 实时荧光定量PCR结果
2.3.1 瘤胃上皮细胞SBD-1和β-actin基因的实时荧光定量PCR扩增效率曲线 将5个浓度的样品分别进行SBD-1和β-actin基因实时荧光定量PCR扩增后,仪器会自动给出PCR扩增效率曲线图(图5)。从扩增效率曲线图中得出,SBD-1和β-actin基因扩增曲线的回归系数分别为R2=0.994 0和R2=0.997 4。从待测基因SBD-1和β-actin基因表达量的对数值(x轴)和Ct值(y轴)的关系可以看出,二者之间存在着反比例的关系,且扩增效率接近等于1,待测基因表达量的对数值与Ct值呈现明显的线性关系,表明可以用荧光定量PCR相对定量法检测SBD-1基因的表达,并可以通过运用2-ΔCt公式进行目的基因相对表达量的计算。

图5 SBD-1和β-actin基因的扩增效率曲线Fig.5 The real-time PCR amplification efficiency curve of SBD-1 and β-actin genes
2.3.2 瘤胃上皮细胞SBD-1和β-actin基因的实时荧光定量PCR扩增曲线及熔解曲线 绵羊瘤胃上皮细胞中SBD-1和β-actin基因表达的荧光定量PCR扩增曲线均表现出标准指数曲线特征(图6)。
从熔解曲线上看(图7),SBD-1和β-actin基因的荧光定量PCR扩增产物分别在86和88.5 ℃时出现单一峰,均没有出现杂峰,也没有出现异常增宽的主峰,同时主峰(熔解峰)对应的Tm值与扩增产物的理论Tm值相近,说明荧光定量PCR的扩增产物为单一的具有特异性的产物。

图6 β-actin和SBD-1基因的扩增曲线Fig.6 The real-time PCR amplification curve of SBD-1 and β-actin genes
2.3.3 枯草芽孢杆菌对瘤胃上皮细胞SBD-1表达影响的时间与浓度之间的关系 根据公式对数据处理后,运用软件进行图形处理。当刺激2、4、8、12和24 h后,随菌液浓度的增加,SBD-1的表达量增大,当菌液浓度为1010cfu·mL-1时,表达量达到峰值,之后,随菌液浓度的增大,表达量逐渐减少,且菌液浓度为109、1010、1011cfu·mL-1时,SBD-1的表达量与空白相比,均为极显著性差异(图8)。对于不同浓度不同时间刺激下,SBD-1的表达量从整体水平上看,菌液浓度为1010cfu·mL-1、刺激时间为8 h时,表达量达到最大值(图9)。

图7 SBD-1和β-actin熔解曲线Fig.7 The real-time PCR melt peak curve of SBD-1 and β-actin genes


**.P<0.01图8 不同枯草芽孢杆菌浓度刺激瘤胃上皮细胞2、4、8、12和24 h后SBD-1的表达量Fig.8 SBD-1 gene expression in ruminal epithelial cells stimulated by Bacillus subtilis with different concentrations after 2,4,8,12 and 24 h


**.P<0.01图9 枯草芽孢杆菌对瘤胃上皮细胞SBD-1表达的时间和浓度依赖关系Fig.9 SBD-1 gene expression in rumen epithelial cells stimulated by Bacillus subtilis with different concentrations at different times
3 讨 论
绵羊瘤胃上皮属于复层扁平上皮,由外到内依次为角质细胞层、颗粒细胞层、棘状细胞层和基底层,基底层和棘状层细胞是瘤胃上皮最重要的细胞,也是体外研究瘤胃上皮的最佳细胞,但是坚实的角质层细胞会影响胰蛋白酶的消化作用。P.Galfi等[14]首次应用胰蛋白酶连续消化法去除角质层,成功的培养了瘤胃上皮细胞;J.L.Klotz等[15]对消化缓冲液和胰蛋白酶浓度进行了优化,获得大量活细胞比例极高的瘤胃上皮细胞;孙志洪等[16]培养瘤胃上皮细胞时,在微生物去除、消化酶的选用和使用方面进行了优化;F.Stumpff 等[17]设计了特制的尤斯灌流室式的装置来分离瘤胃上皮细胞。本试验借鉴前人的经验,用青霉素、链霉素、庆大霉素、两性霉素去除瘤胃内微生物,并钝性分离瘤胃黏膜得到上皮层,然后用0.25% 胰蛋白酶对所得上皮组织连续消化,获得了可培养的瘤胃上皮细胞。
益生菌已经由粮食及农业组织/世界卫生组织定义为活的微生物,可通过改善胃肠道微生物平衡有利地影响宿主动物,可以促进生长,提高饲料利用效率,保护宿主免受肠道感染。有研究表明,在反刍动物中,益生菌可提高动物增长率及饲料利用效率[7]。枯草芽孢杆菌是革兰阳性细菌生理学的研究代表[18],最近的研究表明,枯草芽孢杆菌的益生作用在人、植物和动物中都有所体现。2012年,J.H.Lee等[11]发现,枯草芽孢杆菌可以使人乳腺癌细胞内细菌的生长得到抑制;2004年,H.P.Bais等[18]研究表明,枯草芽孢杆菌可以形成一个稳定的、广泛的生物膜来抵抗病原菌,从而保护植物;2010年,D.Shahnaz等[19]发现,枯草芽孢杆菌在作物根部感染真菌方面具有防治作用。本试验研究发现,枯草芽孢杆菌可提高体外培养的绵羊瘤胃上皮细胞内抗菌肽防御素的表达,表明枯草芽孢杆菌可提高机体免疫力。
2007年德国学者M.Schlee等[8]研究发现,在培养的人肠上皮细胞Caco-2中加入益生菌大肠杆菌Nissle1917可以诱导人β-防御素-2的表达,之后,M.Schlee等[9]研究发现,不同的益生菌乳酸菌株也能够诱导人β-防御素-2的表达。刘佳明等[20]发现,乳酸杆菌细胞壁成分可上调小鼠阴道组织β-防御素-2的表达,黎观红等[21]发现,鼠李糖乳酸杆菌LGA能够促进鸡小肠上皮细胞β-防御素-9的表达。在试验中,M.Schlee等[9]所用的为不同的菌株,选取了4个浓度:106、107、108、109cells·mL-1,发现刺激6 h、菌液浓度为109cells·mL-1时表达量最大。刘佳明研究表明,防御素的表达量随乳杆菌浓度增大而增多,5、20、100 mg·L-1浓度的乳杆菌细胞壁成分处理下,100 mg·L-1浓度的乳杆菌细胞壁成分对β-防御素-2表达的增加最为明显。黎观红等[21]则研究了其中的3个浓度:105、106、107cfu·mL-1,发现菌液浓度为106cfu·mL-1、刺激时间为12 h时,表达量达到峰值。试验中,M.Schlee等[9]和刘佳明等[20]的结果均表明,菌液对防御素的作用存在剂量依赖关系,随菌液浓度增大而表达量增加,而黎观红则仅研究了3个浓度。本试验在前人研究的基础上,选用了108、109、1010、1011、1012cfu·mL-15个浓度,并且发现在不同时间不同浓度菌液的刺激下,SBD-1的表达量均有所不同,当菌液浓度为1010cfu·mL-1刺激上皮细胞8 h后,SBD-1的表达量达到最高,之后,随菌液浓度的增加表达量反而降低,菌液浓度的增加使本试验的结论更具说服力。试验结果的不同可能与不同菌种其菌体的有效成分有关,有效成分的鉴定仍需进一步研究。
4 结 论
本研究利用体外培养的绵羊瘤胃上皮细胞,从基因水平探讨了枯草芽孢杆菌诱导绵羊瘤胃上皮细胞内SBD-1基因的表达的可能性,结果表明,适宜浓度的枯草芽孢杆菌可显著提高绵羊瘤胃上皮细胞内SBD-1基因的表达。
[1] TAVARES L S,SILVA C S,DESOUZA V C,et al.Strategies and molecular tools to fight antimicrobial resistance:resistome,transcriptome,and antimicrobial peptides[J].FrontMicrobiol,2013,4(412),doi:10.3389/fmicb.2013.00412.
[2] YANG Y F,WANG C Y,ZHAO Y F,et al.Reindeer beta-defensin-1:full-length cDNA cloning and tissue expression[J].VetImmunolImmunopathol,2009,131(1-2):137-139.
[3] ZHAO P W,CAO G F.Production of bioactive sheep β-defensin-1 in Pichia pastoris[J].JIndustrialMicrobiolBiotechnol,2012,39(1):11-17.
[4] 李 砚,杨银凤.家畜体内防御素的多态性和表达[J].中国畜牧兽医,2013,40(3):160-168. LI Y,YANG Y F.The polymorphisms and expression of defensins in domestic animal[J].ChinaAnimalHusbandry&VeterinaryMedicine,2013,40(3):160-168.(in Chinese)
[5] 杨银凤,火 焱,王秀梅.抗微生物肽家族成员—防御素[C]//中国畜牧兽医学会动物解剖学及组织胚胎学分会、华中农业大学.中国畜牧兽医学会动物解剖学及组织胚胎学分会第十四次学术研讨会.武汉:中国畜牧兽医学会,2006:334-344. YANG Y F,HUO Y,WANG X M.Antimicrobial peptide family members-defensin[C]//Chinese Association of Animal Science and Veterinary medicine of Anatomy and Embryology Branch,uazhong Agticultural university.The proceedings in the fourteenth symposium of Chinese Association of Animal Science and Veterinary medicine of Anatomy and Embryology Branch.Wuhan:Chinese Association of Animal Science and Veterinary medicine,2006:334-344.(in Chinese)[6] 盛金良,陈创夫,杨 霞,等.绵羊防御素(sBD1)mRNA在不同发育阶段的组织分布和定量分析[J].畜牧兽医学报,2009,40(1):20-25. SHENG J L,CHEN C F,YANG X,et al.Distribution and quantitative analysis of sheep defensin(sBD1) mRNA in different developmental stages[J].ActaVeterinariaetZootechnicaSinica,2009,40(1):20-25.(in Chinese)
[7] EZEMA C.Probiotics in animal production:A review[J].AcadJ,2013,5(11):308-316.
[8] SCHLEE M,WEHKAMP J,ALTENHOEFER A,et al.Induction of human beta-defensin 2 by the probiotic Escherichia coli Nissle 1917 is mediated through flagellin[J].InfectImmun,2007,75(5):2399-2407.
[9] SCHLEE M,HARDER J,KTEN B,et al.Probiotic lactobacilli and VSL#3 induce enterocyte beta-defensin 2[J].ClinExpImmunol,2008,151(3):528-535.
[10] MARUBASHI T,GRACIA M I,VILA B,et al.The efficacy of the probiotic feed additive Calsporin(BacillussubtilisC-3102)in weaned piglets:combined analysis of four different studies[J].JApplAnimNutr,2013,1(2):1-5.
[11] LEE J H,NAM S H,SEO W T,et al.The production of surfactin during the fermentation of cheonggukjang by potential probioticBacillussubtilisCSY191 and the resultant growth suppression of MCF-7 human breast cancer cells[J].FoodChem,2012,131(4):1347-1354.
[12] 蔡 雁.动物益生芽胞杆菌的筛选和生物学特性及益生效果[D].武汉:华中农业大学,2006. CAI Y.The screening,biological characteristics and effect of the animal probioticBacillussubtilis[D].Wuhan:Huazhong Agticultural University,2006.(in Chinese)
[13] 范燕茹,王 佩,金 鑫,等.中国驯鹿瘤胃上皮细胞的体外分离培养[J].黑龙江畜牧兽医,2014,11:8-10. FAN Y R,WANG P,JIN X,et al.China reindeer rumen epithelial cells isolated and culturedinvitro[J].HeilongjiangAnimalScienceandVeterinaryMedicine,2014,11:8-10.(in Chinese)
[15] KLOTZ J L,BALDWIN R L,GILLIS R C,et al.Refinements in primary rumen epithelial cell incubation techniques[J].JDairySci,2001,84(1):183-193.
[16] 孙志洪,张庆丽,贺志雄,等.山羊瘤胃上皮细胞和空肠黏膜上皮细胞原代培养技术研究[J].动物营养学报,2010,22(3):602-610. SUN Z H,ZHANG Q L,HE Z X,et al.The research of primary culture of rumen epithelial cells and jejunal epithelial cells[J].ChineseJournalofAnimalNutrition,2010,22(3):602-610.(in Chinese)
[17] STUMPFF F,GEORGI M I,MUNDHENK L,et al.Sheep rumen and omasum primary cultures and source epithelia:barrier function aligns with expression of tight junction proteins[J].ExpBiol,2011,214(17):2871-2882.
[18] BAIS H P,FALL R,VIVANCO J M.Biocontrol of Bacillus subtilis against infection of arabidopsis roots by pseudomonas syringae is facilitated by biofilm formation and surfactin production1[J].AmSocPlantBiol,2004,134(1):307-319.
[19] SHAHNAZ D,SAMREEN W,MARIUM T,et al.Application ofBacillusspeciesin the control of root rot diseases of crop plants[J].ArchPhytopatholPlantProt,2010,43(4):412-418.
[20] 刘佳明,丁 卉,楼永良.乳杆菌细胞壁成分对小鼠阴道组织β-防御素2诱导表达的影响[J].中国微生态学杂志,2011,23(4):306-309. LIU J M,DING H,LOU Y L.The affect of mice β- defensin-2 in vaginal tissue by lactobacillus cell wall components[J].ChineseJournalofMicroecology,2011,23(4):306-309.(in Chinese)
[21] 黎观红,洪智敏,贾永杰,等.鼠李糖乳酸杆菌LGA对鸡小肠上皮细胞β-防御素-9基因表达的影响[J].畜牧兽医学报,2012,43(4):634-641. LI G H,HONG Z M,JIA Y J,et al.The influence of chicken β-defensin-9 in intestinal epithelial cells by lactobacillus rhamnosus[J].ActaVeterinariaetZootechnicaSinica,2012,43(4):634-641.(in Chinese)
(编辑 郭云雁)
Effects ofBacillussubtilison the Expression of SBD-1 in Cultured Ruminal Epithelial Cells of Sheep
WANG Pei1,2,FAN Yan-ru1,2,JIN Xin1,2,YANG Yin-feng1,2*
(1.CollegeofVeterinaryMedicine,InnerMongoliaAgriculturalUniversity,Hohhot010018,China; 2.KeyLaboratoryofClinicalDiagnosisandTreatmentTechnologyinAnimalDiseaseofMinistryofAgriculture,Hohhot010018,China)
In this study,Bacillussubtiliswas selected to investigate its effect on the β-defensin expression of ovine ruminal epithelial cells culturedinvitro.Firstly,the ovine ruminal epithelial cells were culturedinvitro,then the epithelial cells were stimulated byBacillussubtiliswith different concentrations at different times,the expression ofSBD-1 mRNA was determined by real-time fluorescence quantitative PCR(RT-PCR).The results indicated that the expression peak ofSBD-1 mRNA was after 8 h treated byBacillussubtiliswith 1010cfu·mL-1.The expression ofSBD-1 was increased significantly after treated byBacillussubtiliswith different concentrations,and the expression at 109,1010,1011cfu·mL-1showed stronger induction response than the blank(P<0.01).This study reveals thatBacillussubtiliscan induce the expression ofSBD-1 in ovine ruminal epithelial cells.
β-defensin-1;ruminal epithelial cells;Bacillussubtilis;real-time fluorescence quantitative PCR
10.11843/j.issn.0366-6964.2015.05.011
2014-07-28
国家自然科学基金项目(31160491)
王 佩(1989-),女,山西灵石人,主要从事反刍动物消化道免疫研究,E-mail:wangpei1205@126.com
*通信作者:杨银凤,教授,博士,主要从事反刍动物消化道免疫研究,E-mail:julie1963@163.com
S826;S813.3
A
0366-6964(2015)05-0760-08

