H7亚型和N9亚型禽流感病毒RT-LAMP可视化检测方法的建立
罗思思,谢芝勋,谢丽基,邓显文,谢志勤,黄娇玲,曾婷婷
(广西壮族自治区兽医研究所 广西畜禽疫苗新技术重点实验室,南宁 530001)
H7亚型和N9亚型禽流感病毒RT-LAMP可视化检测方法的建立
罗思思,谢芝勋*,谢丽基,邓显文,谢志勤,黄娇玲,曾婷婷
(广西壮族自治区兽医研究所 广西畜禽疫苗新技术重点实验室,南宁 530001)
应用反转录环介导等温扩增技术(RT-LAMP),建立一种H7亚型和N9亚型禽流感病毒(AIV)可视化快速检测方法。根据GenBank中H7亚型和N9亚型AIVHA和NA基因序列,在其保守区域设计筛选出H7亚型和N9亚型AIV的特异性LAMP引物各一套,优化反应条件,建立能检测H7亚型和N9亚型AIV RT-LAMP方法,并进行特异性和敏感性检验。结果显示,该法用实时浊度仪63 ℃反应1 h,能特异性地检测H7亚型和N9亚型AIV,而对其他15个H亚型和8个N亚型的AIV和禽类呼吸道病原体均无扩增,最低能检出10 拷贝·μL-1目的基因。所建立的H7亚型和N9亚型RT-LAMP方法特异性强、敏感性高,结果可视化,操作简便、快速,为H7、N9和H7N9亚型AIV的有效防控提供技术支撑,具有较好的应用前景。
H7亚型禽流感病毒;N9亚型禽流感病毒;反转录环介导等温扩增;可视化检测
根据血凝素(HA)和神经氨酸酶(NA)的差异,A型流感病毒分为不同亚型,目前已鉴定出17种HA亚型(H1~H17)和10种NA亚型(N1~N10)[1-2]。禽流感病毒(avian influenza virus,AIV)属于正黏病毒科A型流感病毒属,已发现H5N1、H5N2、H5N6、H7N2、H7N3、H7N7、H9N2和H10N8等亚型AIV可跨越种属屏障直接感染人[3-9]。2013年3月底在上海和安徽等地率先发现H7N9亚型AIV感染人的病例,这是全球首次发现H7N9感染并致死人的病例,引起了全世界的关注。2013—2014年陆续在我国浙江、上海、江苏和河南等省市发现了H7N9亚型AIV。因此,检测H7亚型和N9亚型AIV具有重要意义。
环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)是由T.Notomi等[10]在2000年发明的一种新型核酸扩增技术,利用内、外和环3对引物,针对病原的8个靶序列区域,加上Bst DNA聚合酶进行核酸变性和自动循环的链置换核酸扩增反应。由于3对引物同时扩增,所以LAMP扩增效率很高。针对RNA病毒检测,可在LAMP反应体系中加入反转录酶,直接以RNA作为检测模板,在60 ℃左右等温条件下,即可同时进行反转录和LAMP扩增,一步就可完成RT-LAMP的检测。目前,LAMP技术在动物病原体的检测中得到广泛应用[11-14],本研究旨在建立一种能检测鉴别H7亚型和N9亚型AIV的RT-LAMP检测方法,为H7亚型和N9亚型AIV的快速诊断提供技术支持。
1 材料与方法
1.1 材料
本研究所用31株AIV毒株(包括H1~H16亚型和N1~N9亚型,其中,H5和H7亚型AIV为广西壮族自治区疫病控制中心等惠赠的RNA)和3株常见禽病毒株(包括新城疫病毒、传染性支气管炎病毒和传染性喉气管炎病毒),为广西兽医研究所分离保存或香港大学等惠赠,具体见“结果”部分病原/分离株列表。MiniBEST Viral RNA/DNA Extraction试剂盒和反转录试剂购自大连宝生物公司;RNA纯化试剂盒购自QIAGEN公司;pGEM-T Easy载体和RNA体外转录试剂盒购自Promaga公司;胶回收试剂盒购自Axygen公司。
1.2 LAMP引物设计
根据GenBank中公开的H7亚型和N9亚型AIVHA和NA基因序列,用DNAStar软件比对序列,使用在线软件Primer Explorer V4 ( http://primerexplorer.jp/elamp4.0.0/index.html)设计筛选出针对H7亚型和N9亚型AIV LAMP引物各3套,经NCBI比对验证,确保引物的特异性。引物合成后,通过引物可行性预试验,从中再筛选出H7亚型和N9亚型LAMP引物各一套,为了提高H7亚型的敏感性,在F1c和B1c之间设计了一条加速引物AP。H7亚型和N9亚型AIV的LAMP引物序列如表1所示,引物由广州Invitrogen公司合成。

表1 H7亚型和N9亚型AIV的RT-LAMP引物序列
1.3 核酸的提取
按照MiniBEST Viral RNA/DNA Extraction Kit Ver.4.0抽提试剂盒说明书,提取不同亚型AIV(除H5和H7亚型AIV外)、新城疫病毒(NDV)和传染性支气管炎病毒(IBV)的RNA,提取传染性喉气管炎病毒(ILTV)的DNA。
1.4 标准品的制备
用表1中H7-F3、H7-B3和N9-F3、N9-B3两对引物对H7N9亚型AIV RNA RT-PCR扩增HA基因和NA基因的目的片段,将其PCR产物连入含有T7启动子的pGEM-T Easy克隆载体,挑取阳性克隆菌测序验证。提取测序正确的质粒,利用限制性内切酶SpeI酶切,使克隆载体线性化,按照RNA体外转录试剂盒的说明书,使质粒转录为体外RNA,用RNA纯化试剂盒,纯化体外转录的RNA片段。利用NanoDrop ND-1000微量核酸检测仪检测所转录RNA浓度,根据相对分子质量和核酸浓度计算拷贝数。将体外转录的H7亚型和N9亚型AIV RNA目的片段梯度稀释至105~1拷贝·μL-1,各取1 μL作为模板,用于敏感性的测定。
1.5 RT-LAMP反应条件的优化
根据LAMP报道和本实验室经验,反应条件具体需优化温度以及甜菜碱(Betaine)、硫酸镁(MgSO4)和dNTPs三种反应试剂,反应温度在58~67 ℃间摸索,试剂在终浓度为0.2~1.6 mol·L-1Betaine、1~6 mmol·L-1MgSO4和0.2~1.6 mmol·L-1dNTPs范围进行优化。
1.6 敏感性试验
按照优化好的反应条件,对体外转录浓度为105~1拷贝·μL-1H7亚型和N9亚型AIV RNA进行H7亚型和N9亚型RT-LAMP检测,检验其敏感性。此外,在H7亚型AIV RT-LAMP试验中,对添加AP引物和不用AP引物的反应体系进行平行试验,分析其敏感性差异。
1.7 特异性试验
按照优化好的反应条件,对不同HA(H1~H16)、NA (N1~N9)亚型AIV和禽类常见呼吸道疾病(NDV、IBV和ILTV)进行检测,验证H7亚型和N9亚型AIV RT-LAMP特异性。
1.8 RT-LAMP的初步应用
利用所建立的H7亚型和N9亚型AIV RT-LAMP方法对134份临床样品进行检测,其中,中国农业大学赵继勋教授提供的经分离鉴定为H7N9亚型AIV鸡组织悬液(喉气管、肝、肺、脑)的RNA样品5份,美国宾夕法尼亚大学提供的经分离鉴定为H7N2(9份)、H11N9(6份)亚型AIV 家禽咽肛棉拭子的RNA样品共15份,本实验室保存的经分离鉴定为AIV(H1、H3、H4、H6、H9)、NDV、IBV、ILTV的咽肛棉拭子样品(采集于活禽市场)共114份。
2 结 果
2.1 反应条件的优化
通过对反应温度的摸索,结果显示在温度范围为61~65 ℃时,扩增效率较好,最终确定该法最佳反应温度为63 ℃。通过对反应试剂的优化,25 μL RT-LAMP反应体系具体如下:1 μL引物预混液(包括FIP和BIP浓度为40 μmol·L-1、B3和F3浓度为5 μmol·L-1、LF和LB浓度为20 μmol·L-1)、1 μL 8 U·μL-1Bst DNA聚合酶、2.5 μL 10×Bst buffer、1 μL 5 U·μL-1AMV反转录酶、3.5 μL 10 mmol·L-1dNTPs、4.0 μL 5 mol·L-1Betaine、5.0 μL 25 mmol·L-1MgSO4、1.0 μL 625.0 μmol·L-1Calcein、1.0 μL 12.5 mmol·L-1MnCl2、2.0 μL RNA模板,其余以超纯水补足。充分混匀反应体系后,置于实时浊度仪63 ℃反应1 h,80 ℃作用5 min终止反应。
2.2 敏感性试验
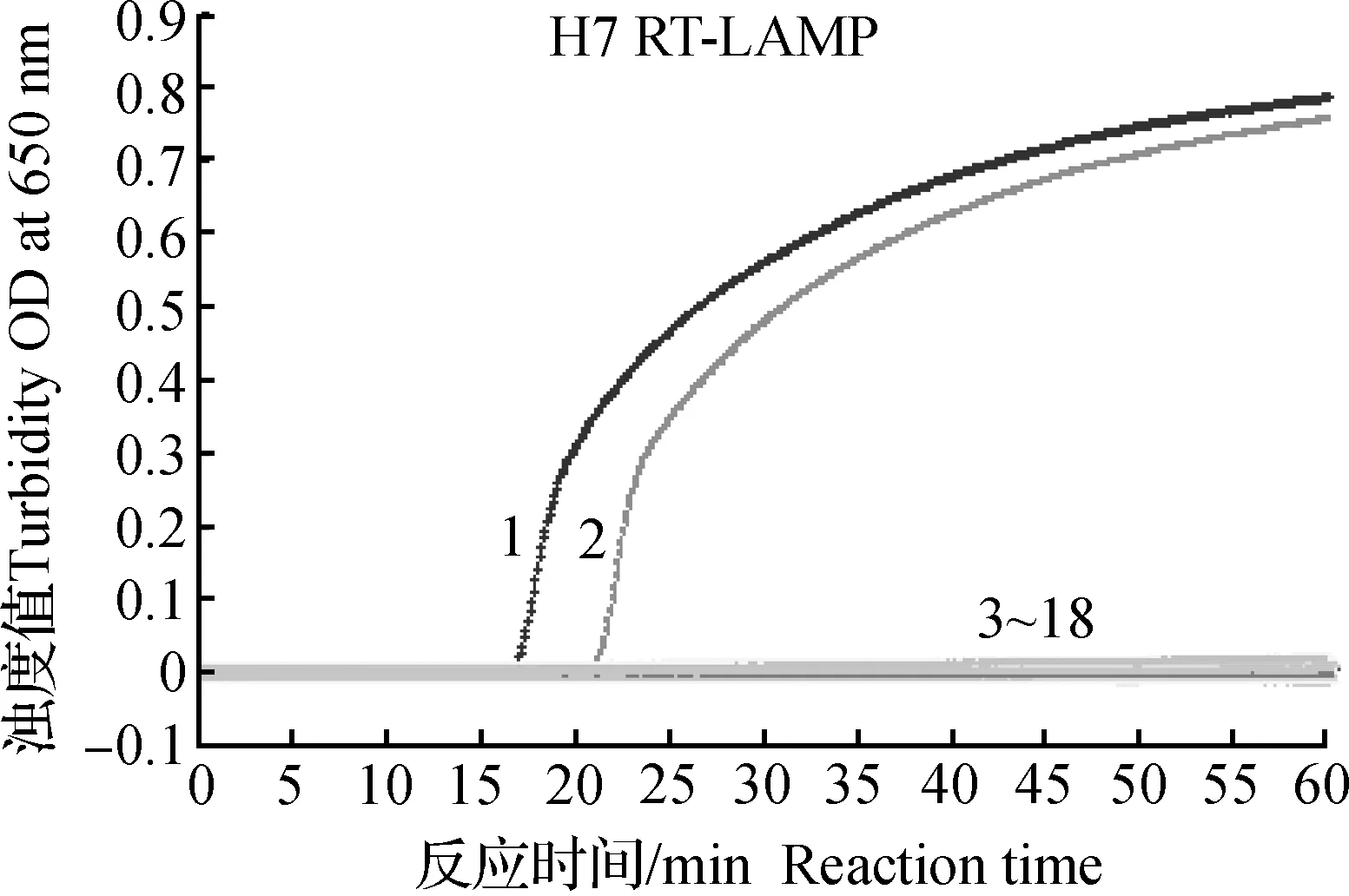
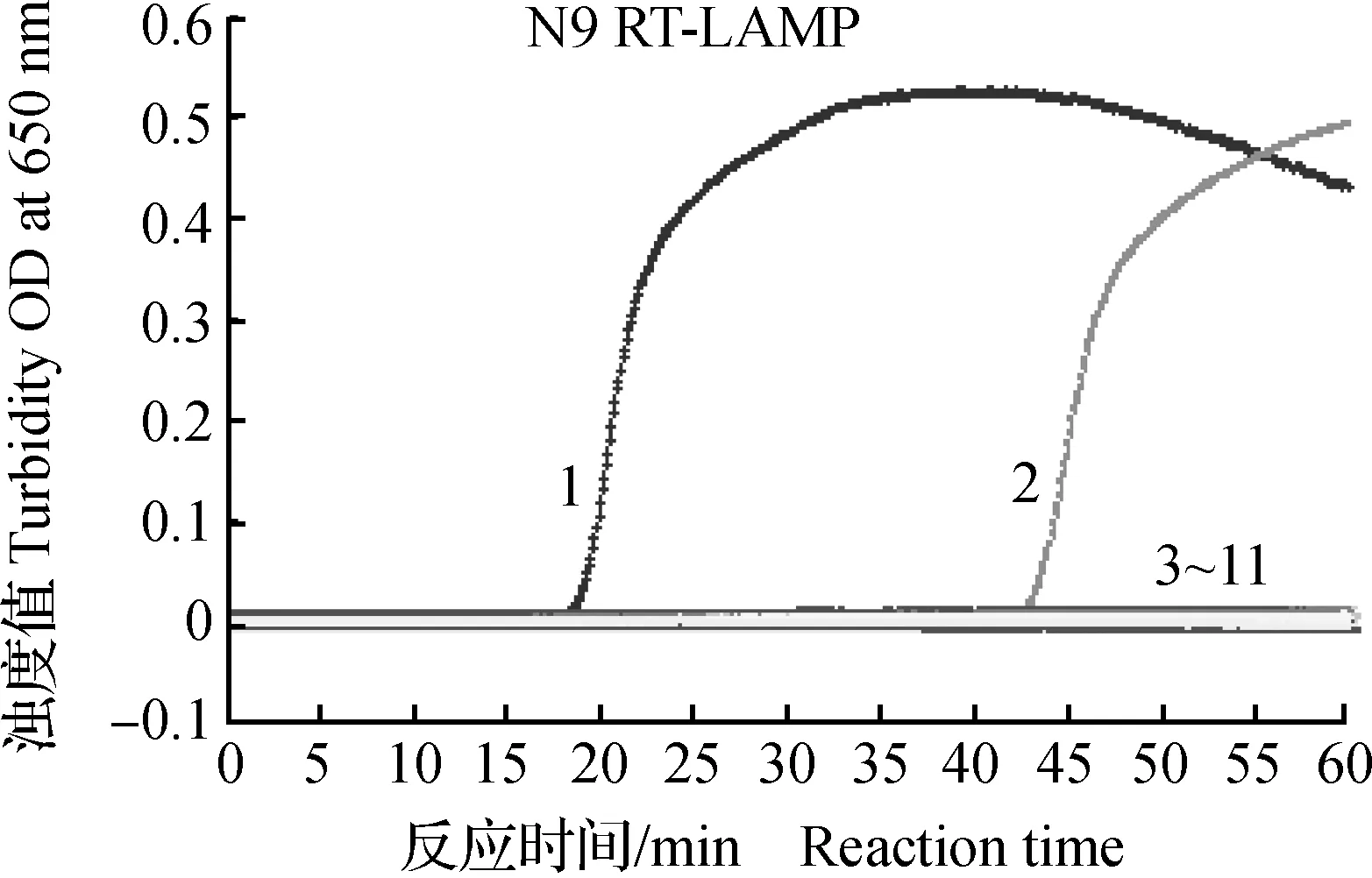
所建立的H7亚型和N9亚型AIV RT-LAMP的最低检测限均为10 拷贝·μL-1(图1和2),对浓度为105~10 拷贝·μL-1的H7亚型和N9亚型AIV RNA检测为阳性,浊度仪扩增生成典型的S型扩增曲线,同时,反应液变翠绿色;对浓度为1 拷贝·μL-1的H7亚型和N9 亚型AIV RNA检测为阴性,生成直线,反应液仍为桔黄色。此外,缺少AP引物的H7亚型 AIV RT-LAMP的最低检测限为102拷贝·μL-1。

1.105拷贝·μL-1;2.104拷贝·μL-1;3.103 拷贝·μL-1;4.102拷贝·μL-1;5.10 拷贝·μL-1;6.1拷贝·μL-1;7.阴性对照1.105 copies·μL-1;2.104 copies·μL-1;3.103 copies·μL-1;4.102 copies·μL-1;5.10 copies·μL-1;6.1 copy·μL-1;7.Negative control图1 H7 RT-LAMP敏感性试验结果Fig.1 Sensitivity results of H7 RT-LAMP

1.105拷贝·μL-1;2.104拷贝·μL-1;3.103拷贝·μL-1;4.102拷贝·μL-1;5.10 拷贝·μL-1;6.1拷贝·μL-1;7.阴性对照1.105 copies·μL-1;2.104 copies·μL-1;3.103 copies·μL-1;4.102 copies·μL-1;5.10 copies·μL-1;6.1 copy·μL-1;7.Negative control图2 N9 RT-LAMP敏感性试验结果Fig.2 Sensitivity results of N9 RT-LAMP
2.3 特异性试验
H7亚型AIV RT-LAMP检测结果见图3,H7N9和H7N7 RNA的检测结果为阳性,可见明显的S型浊度曲线,而对其他HA亚型AIV的检测均为阴性,检测结果为直线;N9亚型RT-LAMP检测结果见图4,只有H7N9和H11N9 RNA为阳性结果,可见明显的S型浊度曲线,而对其他NA亚型AIV的检测均为阴性,检测结果为直线。Calcein指示剂法(图略)和实时浊度监控结果一致。此外,用该法对更多毒株的检测结果见表2,表明所建立的 RT-LAMP检测方法特异性扩增H7亚型和N9亚型AIV,而对其他HA和NA亚型AIV不发生交叉反应。
1.H7N9;2.H7N7;3.H1N2;4.H2N3;5.H3N2;6.H4N6;7.H5N9;8.H6N6;9.H8N4;10.H9N8;11.H10N7;12.H11N9;13.H12N5;14.H13N5;15.H14N5;16.H15N9;17.H16N3;18.Negative control图3 H7 RT-LAMP特异性试验结果Fig.3 Specificity results of H7 RT-LAMP
1.H7N9;2.H11N9;3.H5N1;4.H1N2;5.H2N3;6.H8N4;7.H12N5;8.H4N6;9.H10N7;10.H9N8;11.Negative control图4 N9 RT-LAMP特异性试验结果Fig.4 Specificity results of N9 RT-LAMP
2.4 RT-LAMP的初步应用
应用所建立的H7亚型RT-LAMP方法对5份H7N9亚型AIV和9份H7N2亚型AIV临床样品的RNA检测结果均为阳性;应用建立的N9亚型RT-LAMP方法对5份H7N9亚型AIV 和6份H11N9亚型AIV临床样品的RNA检测结果均为阳性;应用所建立的H7、N9亚型AIV RT-LAMP方法分别对其他亚型AIV和常见的家禽呼吸道病原体的临床样品检测结果均为阴性,具体结果见表3,与实际相符。
3 讨 论
2013年3月,在中国首次发现H7N9亚型AIV感染和致死人的病例,引起全世界的关注。截至2014年11月2日,国内至少有456份感染H7N9亚型AIV的病例,其中177例死亡。该亚型病毒感染一般表现为流感样症状,重症患者出现高热、肺炎、呼吸窘迫和多器官障碍等症状,甚至死亡。此次感染的H7N9为重组病毒,突发性强,对人尚无有效的预防和治疗措施,给公共卫生安全带来很大的危害,对养殖业造成巨大的经济损失。加强对H7N9监测和诊断技术的研究,对该病的防控具有重要意义。目前,诊断AIV的方法中,病毒分离与鉴定方法是金标准,结果准确可靠,但检测的周期较长,达不到快速检测的要求。RT-PCR方法需接触有害物DNA染色剂[15];荧光定量RT-PCR方法可实时监测扩增过程,但荧光PCR仪器价格较昂贵,在实际应用中有一定的局限性[16]。因此,建立一种可视化、快速、特异、灵敏、易于操作与应用的检测方法对H7亚型和N9亚型AIV的防控具有重要意义。

表2 病原/分离株与H7亚型和N9亚型 RT-LAMP检测结果

表3 RT-LAMP临床检测结果
可视化RT-LAMP作为新型核酸检测技术,在动物传染病病原体的检测上,近几年已有很多报道[17-23]。目前,已有H7N9禽流感病毒等温扩增快速检测方法的报道[24],但该报道使用传统的LAMP反应结果观察方法,需在反应结束后打开反应管盖,添加荧光染料SYBR Green来观察反应液颜色变化和观察反应产物琼脂糖凝胶电泳结果有无特征性梯形条带确定检测结果。该结果判定方法较易使其产物形成气溶胶导致LAMP阳性产物污染实验室环境,造成下次检测时出现假阳性结果。本文与其不同之处在于,为了降低污染和假阳性,本研究在扩增前预先加入指示剂钙黄氯素,通过观察反应前后颜色变化判定结果,将该反应体系置于实时浊度仪63 ℃恒温作用,通过浊度值的变化实时监测整个扩增过程,能更清楚掌握扩增进程,使诊断结果更准确,同时颜色变化和浊度值判定的结果一致,避免开盖造成污染。此外,该报道只限于对H7N9亚型AIV进行检测,未见有对其他H7亚型和N9亚型AIV的验证检测,而本研究所建立的RT-LAMP检测方法的检测范围更广,既能对H7N9亚型AIV进行鉴别检测,也能对H7N2、H7N7、H5N9和H11N9等不同HA和NA亚型搭配中的H7亚型和N9亚型AIV进行鉴别诊断。
对于H7亚型和N9亚型AIV RT-LAMP的成功建立,作者认为以下两方面十分重要:首先,筛选基因保守序列,按照LAMP引物设计软件提示的Tm值、GC含量和错配等信息,设计特异性和扩增效率高的LAMP引物,此外,本研究发现在H7内引物F1c和B1c之间设计的加速引物AP能提高反应的敏感度;其次,由于RT-LAMP扩增效率很高,应对操作区域进行严格分区,如配制反应液区、加RNA模板区和结果观察区等,以免相互交叉污染导致假阳性结果。可视化RT-LAMP只需一台可控温的水浴锅,特别有利于养殖场、乡镇兽医站和现场的检测应用。
4 结 论
建立的H7亚型和N9亚型AIV RT-LAMP快速检测鉴别方法特异性强、敏感性高,不需特殊的仪器,可对H7、N9和H7N9亚型AIV进行快速鉴别检测,具有简便、快速和结果可视化的优点,有助于H7、N9和H7N9亚型AIV的早期诊断,为该病的有效防控提供技术支持。
[1] CHAN J F,TO K K,TSE H,et al.Interspecies transmission and emergence of novel viruses:lessons from bats and birds[J].TrendsMicrobiol,2013,21(10):544-555.
[2] TONG S,ZHU X,LI Y,et al.New world bats harbor diverse influenza A viruses[J].PLoSPathog,2013,9 (10):e1003657.
[3] BEIGEL J H,FARRAR J,HAN A M,et al.Avian influenza A (H5N1) infection in humans[J].NEnglJMed,2005,353 (13):1374-1385.
[4] PAPPAS C,MATSUOKA Y,SWAYNE D E,et al.Development and evaluation of an influenza virus subtype H7N2 vaccine candidate for pandemic preparedness[J].ClinVaccineImmunol,2007,14(11):1425-1432.
[5] TWEED S A,SKOWRONSKI D M,DAVID S T,et al.Human illness from avian influenza H7N3,British Columbia[J].EmergInfectDis,2004,10(12):2196-2199.
[6] FOUCHIER R A,SCHNEEBERGER P M,ROZENDAAL F W,et al.Avian influenza A virus (H7N7) associated with human conjunctivitis and a fatal case of acute respiratory distress syndrome[J].ProcNatlAcadSciUSA,2004,101(5):1356-1361.
[7] PEIRIS M,YUEN K Y,LEUNG C W,et al.Human infection with influenza H9N2[J].Lancet,1999,354(9182):916-917.
[8] 谭 伟,谢芝勋.H10N8亚型禽流感病毒的研究进展[J].中国畜牧兽医,2014,41(8):236-241. TAN W,XIE Z X.Research progress on avian influenza a virus subtype H10N8[J].ChinaAnimalHusbandry&VeterinaryMedicine,2014,41(8):236-241.(in Chinese)
[9] QI X,CUI L,YU H,et al.Whole-Genome sequence of a reassortant H5N6 avian influenza virus isolated from a live poultry market in China,2013[J].GenomeAnnounc,2014,2(5).pii:e00706-00714.
[10] NOTOMI T,OKAYAMA H,MASUBUCHI H,et al.Loop-mediated isothermal amplification of DNA[J].NucleicAcidsRes,2000,28(12):E63.
[11] PENG Y,XIE Z X,LIU J,et al.Visual detection of H3 subtype avian influenza viruses by reverse transcription loop-mediated isothermal amplification assay[J].VirolJ,2011,8:337.
[12] XIE Z,TANG Y,FAN Q,et al.Rapid detection of group I avian adenoviruses by a loop-mediated isothermal amplification[J].AvianDis,2011,55(4):575-579.
[13] XIE Z,FAN Q,LIU J,et al.Reverse transcription loop-mediated isothermal amplification assay for rapid detection of Bovine Rotavirus[J].BMCVetRes,2012,8:133.
[14] 罗思思,谢芝勋,邓显文,等.鸡毒支原体强弱毒株LAMP可视化鉴别检测方法的建立[J].中国兽医科学,2012,42(9):943-948. LUO S S,XIE Z X,DENG X W,et al.Development of a loop-mediated isothermal amplification assay for visual differentiation ofMycoplasmagallisepticumvirulent strains from attenuated strains[J].ChineseVeterinaryScience,2012,42(9):943-948.(in Chinese)
[15] 罗思思,谢芝勋,刘加波,等.H7N9亚型禽流感病毒三重PCR检测方法的建立[J].中国畜牧兽医,2014,41(2):61-64. LUO S S,XIE Z X,LIU J B,et al.Development of a triplex PCR assay for detection of H7N9 subtype avian influenza virus[J].ChinaAnimalHusbandry&VeterinaryMedicine,2014,41(2):61-64.(in Chinese)
[16] 罗宝正,莫秋华,李儒曙,等.新型H7N9亚型禽流感病毒多重荧光RT-PCR快速检测方法的建立[J].病毒学报,2014,30(1):1-5. LUO B Z,MO Q H,LI R S,et al.Rapid detection of novel avian influenza virus subtype H7N9 by multiplex real-time RT-PCR[J].ChineseJournalofVirology,2014,30(1):1-5.(in Chinese)
[17] 刘业兵,张 磊,孙跃辉,等.可视化的RT-LAMP方法检测禽白血病病毒[J].畜牧兽医学报,2011,42 (1):150-156. LIU Y B,ZHANG L,SUN Y H,et al.Visualized detection of avian leukosis virus by reverse transcription loop-mediated isothermal amplification assay[J].ActaVeterinariaetZootechnicaSinica,2011,42(1):150-156.(in Chinese)
[18] 李兆龙,陈仕龙,林锋强,等.禽新型黄病毒RT-LAMP检测方法的建立[J].畜牧兽医学报,2012,43(4):659-663. LI Z L,CHEN S L,LIN F Q,et al.Establishment of rapid reverse transcription loop mediated isothermal amplification for detection of avian novel flavivirus[J].ActaVeterinariaetZootechnicaSinica,2012,43(4):659-663.(in Chinese)
[19] 蒋 菲,黄书林,徐 威,等.H9亚型禽流感病毒环介导等温扩增检测方法的建立与荧光指示剂的应用[J].农业生物技术学报,2011,19(1):191-196. JIANG F,HUANG S L,XU W,et al.Detection of H9 avian influenza virus by loop-mediated isothermal amplification and application of fluorescent reagent[J].JournalofAgriculturalBiotechnology,2011,19(1):191-196.(in Chinese)
[20] 罗剑鸣,吴希阳,徐子乾,等.基于颜色判定的逆转录环介导等温扩增技术检测GII型诺如病毒基因[J].病毒学报,2012,28(2):165-171. LUO J M,WU X Y,XU Z Q,et al.Colorimetric detection of norovirus genotype GII by reverse transcription loop-mediated isothermal amplification[J].ChineseJournalofVirology,2012,28(2):165-171.(in Chinese)
[21] XIE L,XIE Z,ZHAO G,et al.A loop-mediated isothermal amplification assay for the visual detection of duck circovirus[J].VirolJ,2014,11:76.
[22] 薛超波,黄朱梁,孙 瑛,等.海产品中创伤弧菌实时浊度LAMP检测方法的建立[J].中国预防兽医学报,2013,35(11):912-915. XUE C B,HUANG Z L,SUN Y,et al.Development of a real-time turbidimeter-based loop-mediated isothermal amplification for detection ofVibriovulnificusin seafood[J].ChineseJournalofPreventiveVeterinaryMedicine,2013,35(11):912-915.(in Chinese)
[23] 袁瑛娜,单潇潇,王宗德,等.应用LAMP实时浊度法检测转基因大豆[J].现代食品科技,2011,27(10):1264-1267. YUAN Y N,SHAN X X,WANG Z D,et al.Development of a real-time turbidimeter-based loop-mediated isothermal amplification assay for detection of transgenic soybean[J].ModernFoodScienceandTechnology,2011,27(10):1264-1267.(in Chinese)
[24] 董志珍,郑文杰,王乃福,等.H7N9禽流感病毒等温扩增快速检测方法的建立[J].中国动物检疫,2013,30(7):72-77. DONG Z Z,ZHENG W J,WANG N F,et al.Development of rapid assay for H7N9 influenza virus by loop-mediated isothermal amplification method[J].ChinaAnimalHealthInspection,2013,30(7):72-77.(in Chinese)
(编辑 白永平)
Visual Detection of H7 and N9 Subtypes Avian Influenza Viruses by Reverse Transcription Loop-mediated Isothermal Amplification Assay
LUO Si-si,XIE Zhi-xun*,XIE Li-ji,DENG Xian-wen,XIE Zhi-qin,HUANG Jiao-ling,ZENG Ting-ting
(GuangxiKeyLaboratoryofAnimalVaccinesandNewTechnology,GuangxiVeterinaryResearchInstitute,Nanning530001,China)
A reverse transcription loop-mediated isothermal amplification (RT-LAMP) assay was developed for rapid visual detection of H7 and N9 subtype avian influenza viruses (AIV).According to the conservative sequences of hemagglutinin (HA) and neuraminidase (NA) genes of H7 and N9 subtype AIV in GenBank,two sets of primers were designed,then the reaction conditions were optimized.The specificity and sensitivity of the RT-LAMP assay were evaluated.RT-LAMP amplification was completed in 1 h by incubating all of the reagents in a single tube by real-time turbidimeter at 63 ℃.The specific test demonstrated that the RT-LAMP assay was specific for detecting H7 and N9 subtypes of AIV,and no cross reaction with other subtypes of AIV and avian respiratory pathogens.The detection limit of the RT-LAMP assay was 10 copies using vitro transcription RNA of target genes.The newly developed RT-LAMP assay is specific,sensitive,simple,rapid and can identify H7,N9 and H7N9 subtype AIV visually,and it will be a very useful screening assay for prevention and control these diseases.
H7 subtype avian influenza viruses;N9 subtype avian influenza viruses;reverse transcription loop-mediated isothermal amplification;visual detection
10.11843/j.issn.0366-6964.2015.07.014
2014-10-28
广西特聘专家专项 ( 2011B020);广西科技攻关重大专项 (14121003-4-2;1222003-2-4)
罗思思(1985-),女,广西平南人,助理研究员,主要从事禽流感病原学和防控技术的研究
*通信作者:谢芝勋,研究员,E-mail: xiezhixun@126.com
S852.659.5
A
0366-6964(2015)07-1176-08

