电场中MgO分子吸附H2的理论研究
徐红萍, 尹跃洪
(西北师范大学物理与电子工程学院甘肃省原子与分子物理及功能材料重点实验室, 兰州 730070)
电场中MgO分子吸附H2的理论研究
徐红萍, 尹跃洪
(西北师范大学物理与电子工程学院甘肃省原子与分子物理及功能材料重点实验室, 兰州 730070)
研究电场中MgO分子与H2的相互作用是探索MgO材料储氢性能的基础.在B3LYP/6-31G**水平上研究了电场中H2在MgO分子上的吸附行为.结果给出电场中单个H2在Mg/O上的吸附能由无电场时-0.021/-0.099 eV提高到场强为0.005 a.u.时的-0.037/-0.139 eV. H2吸附在O离子上时,电场效应更显著.电场中MgO分子最多能吸附10个H2,相应的质量密度达33wt%.表明电场诱导MgO材料吸附H2是一种具有潜力的储氢方法.通过电子结构分析讨论了电场中MgO分子储氢的机理.
电场; MgO; 储氢; 吸附
1 引 言
化石燃料日益枯竭,氢储量丰富、燃烧值高、可再生、清洁无污染,是理想的替代能源.氢能利用涉及氢的生产、储运及燃烧三个环节[1].氢分子间的作用很弱,汽化温度低(33 K),而且氢分子很小易渗漏,因此氢的储运是制约氢能利用的主要因素.对于储氢材料的研发需要解决两个关键指标:一是高的储存密度(质量密度和体积密度),二是氢的释放和重储的热力学和动力学性能[2].低温液态(21 K)和高压(35~70 MPa)储氢的成本高,还存在严重的安全问题.研发各种固体储氢材料是解决储氢问题的基本途径.根据吸附材料与H2分子作用强度不同,固体储氢可分为物理吸附和化学吸附两种方式.物理吸附材料与氢作用较弱(吸附能一般小于-0.1 eV),一般需在较低的温度下储存,且其储氢密度较小.化学吸附材料虽具有很高的储氢密度,但由于吸附材料与H2分子较强的化学作用(吸附能一般-2~-3 eV),脱氢较困难,通常需要在几百度的高温下进行.单纯的物理吸附或化学吸附不能同时满足稳定吸氢与快速脱氢的要求.理想储氢材料应具有对H2分子适宜的吸附强度.根据热力学分析,在室温和1 MPa条件下,固体储氢材料吸附单个H2分子的理想吸附能应为-0.1~-0.2 eV[3].探寻具有适宜吸附强度的储氢方法对寻找室温下储氢材料具有重要意义.
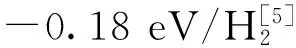
块体MgO是典型的离子化合物.虽然H2在MgO晶体和团簇表面的吸附很早就受到人们的关注,而理论与实验研究表明H2通常在其表面形成弱的物理吸附[7-13].由于MgO具有较强的极性,电场诱导MgO材料储氢逐渐受到人们的关注.Sun等制备了多孔MgO材料,发现外加电场后其储氢性能得到明显改善[14].然而,这种电场效应的微观机制,特别是电场中MgO单元与H2分子作用机理仍不清楚.研究小分子对H2的吸附是了解相应体相材料储氢性能的基础[15-17].另一方面,分子的外场效应(即在外加电场或磁场作用下的分子特性)是研究材料分子结构及性质的重要内容,并被成功用于很多领域[18-20].研究电场中MgO分子对H2的吸附是探索MgO材料储氢性能的基础,为寻找基于MgO材料的储氢方法提供理论指导,也为深入分析MgO材料的储氢机理提高了良好的平台.黄多辉等在密度泛函理论水平上研究了电场对MgO分子的几何与电子结构的影响[21],但电场中MgO分子吸附H2的研究则未见报道.本文在B3LYP/6-31G**水平上研究了电场中MgO分子吸附一个至多个H2的行为,结果表明电场可以提高MgO分子对H2的吸附强度,饱和吸附时的储氢质量密度达到33wt%,表明电场诱导MgO材料吸附H2是一种可能的储氢方法.并通过电子结构分析讨论了电场中MgO分子与H2的相互作用机理.
2 计算方法

Ea=[E(MgO·nH2)-E(MgO)-nE(H2)]/n
(1)
式中E(MgO·nH2)、E(MgO)及E(H2)分别为吸附体系、MgO及H2分子的总能量.通过电子结构分析,研究了电场影响MgO分子吸附H2性能的微观机制.所有计算使用Gaussian03程序完成[24].
3 结果与讨论
3.1 电场中单个H2在 MgO分子上的吸附
分别优化了不同方向的电场(包括平行和垂直于O-Mg分子轴向以及电场沿H2与Mg/O离子连线方向等)在不同强度条件下的MgO分子对单个H2分子的吸附结构.结果表明当电场方向沿O-Mg分子轴向时电场效应最显著,并且电场沿该方向时,H2在MgO分子上的吸附较无电场时增强.当场强为0.005 a. u.时已获得了适宜的吸附强度(虽然我们的计算表明进一步增大场强仍能提高吸附能,如场强为0.01 a.u.时,吸附能大于-0.20 eV,但吸附能太大不利于氢的脱附).电场反向时,H2在MgO分子上的吸附被削弱,如场强为-0.001 a. u.时,H2在Mg/O上的吸附强度分别降低为-0.005/-0.032 eV;场强为
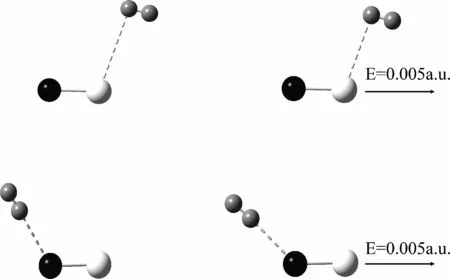
图1 不同场强条件下H2 吸附在MgO分子上的稳定结构.黑色球O原子,白色球Mg原子,灰色球H原子Fig. 1 The stable adsorption structures of H2 on MgO under different external electric fields. The black balls are O atoms, white and grey balls represent Mg and H atoms, respectively
-0.002 a. u.时H2在Mg原子上则不能形成稳定的吸附结构,而这对H2的脱附非常有利.因此以下仅讨论电场沿O-Mg分子轴向,场强为0.000 a. u.~ 0.005 a. u.时MgO分子对H2的吸附.在所给场强条件下,优化了单个H2分子以各种取向分别吸附在Mg/O离子上以及Mg-O离子间的结构,结果表明H2分子可以稳定地吸附在单个Mg/O离子上.图1给出了不同场强条件下,H2在Mg/O离子上的稳定吸附结构(由于电场中的吸附结构与无电场时的稳定结构相似,因此只给了无电场及场强为0.005 a. u.时的稳定结构).不同场强条件下,稳定吸附结构的吸附能(Ea)、H2分子键长(R-H2)、H2分子到Mg/O离子的距离(R-Mg/O-H2)以及H2分子上的净电荷(Charge)和吸附结构的偶极矩(μ)在表1中列出.
无电场时,H2分子在Mg上为侧位吸附(H2分子的方向与H2分子到Mg离子的连线垂直),而在O上为端位吸附(H2分子的方向与H2分子到O离子的连线一致).H2在O上的吸附能为-0.099 eV,而在Mg上的吸附能为-0.021 eV,表明H2在O上吸附更强.NBO电荷布居分析给出,在Mg上吸附时,H2分子带0.001e正电荷,表明少量电荷向MgO分子转移.在O上吸附时,H2分子带-0.02e负电荷,表明其从MgO分子得到电荷.上述数据表明,无电场时H2分子在MgO分子上的吸附能较小,形成弱的物理吸附.H2在O上吸附强于在Mg上.这可能是由于形成物理吸附的分子间以诱导极化的静电力为主,而O为阴离子,其离子半径更大,极化效应更强,因此吸附H2分子的能力更强.
表1 电场中单个H2在MgO分子上的吸附能、到MgO的距离、键长、NBO电荷及吸附结构的偶极矩
Table 1 The adsorption energies, distances from H2to MgO, bond lengths and NBO charges of H2and dipole moments of adsorption structures of H2on MgO under external electric field
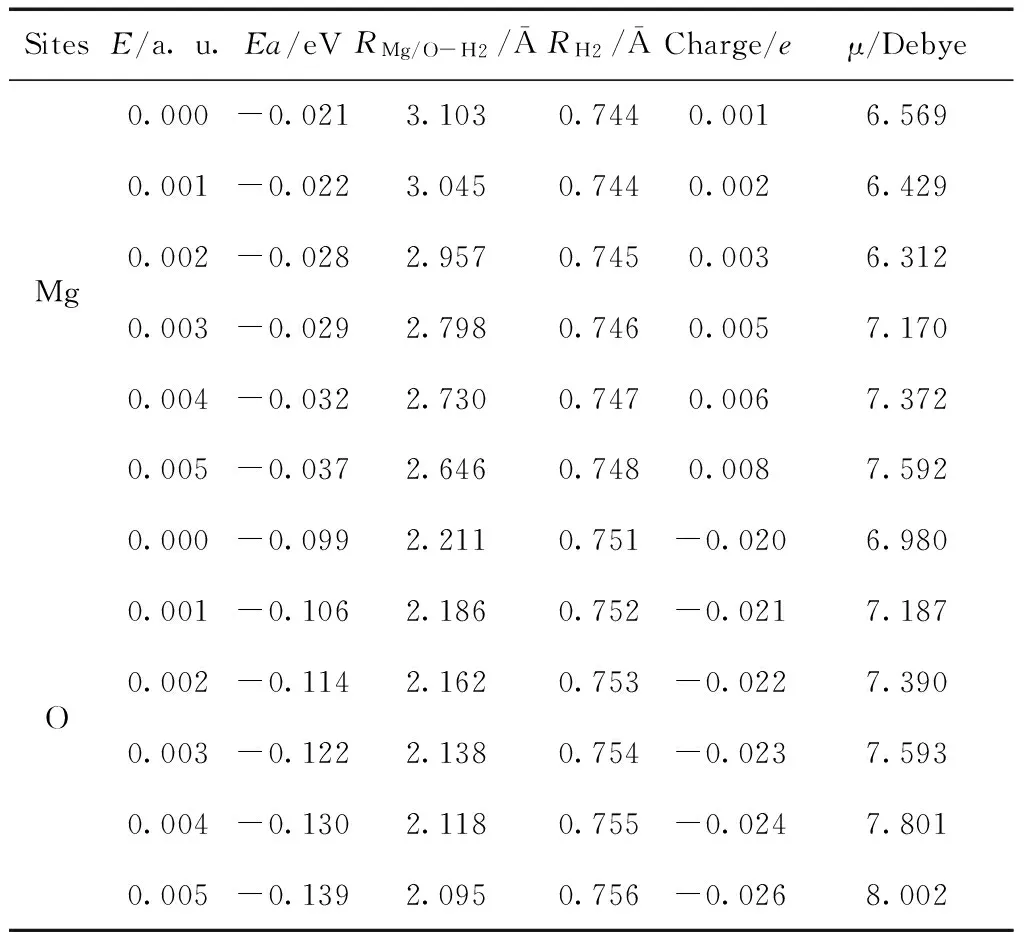
SitesE/a.u.Ea/eVRMg/O-H2/ĀRH2/ĀCharge/eμ/DebyeMg0.000-0.0213.1030.7440.0016.5690.001-0.0223.0450.7440.0026.4290.002-0.0282.9570.7450.0036.3120.003-0.0292.7980.7460.0057.1700.004-0.0322.7300.7470.0067.3720.005-0.0372.6460.7480.0087.592O0.000-0.0992.2110.751-0.0206.9800.001-0.1062.1860.752-0.0217.1870.002-0.1142.1620.753-0.0227.3900.003-0.1222.1380.754-0.0237.5930.004-0.1302.1180.755-0.0247.8010.005-0.1392.0950.756-0.0268.002
电场中,H2在Mg/O离子上的吸附结构与无电场时基本一致,但H2的分子取向随着电场的增强逐渐趋向外电场方向.随着电场的增强,H2在Mg/O上的吸附能均逐渐增大,H2到吸附原子的距离变短而H-H键长变长,表明电场使H2与MgO分子的相互作用增强而H-H键被削弱.并且H2在O离子上的吸附能更大、H2到吸附原子的距离更短,且H-H键长更长,表明电场中H2在O离子上的吸附更强.NBO电荷表明,H2吸附在Mg离子上,H2上的净电荷为正(0.001e~ 0.008e),有少量电荷由H2分子向MgO转移,且随着电场增强,转移的电量也逐渐增加.当H2吸附在O离子上时,H2上的净电荷为负(-0.020e~-0.026e),表明有电荷由MgO向H2分子转移,且随着电场增强,转移的电量也逐渐增加.由于电场的极化,随着场强的增加,所有吸附结构的偶极矩单调增加.
3.2 电子结构分析
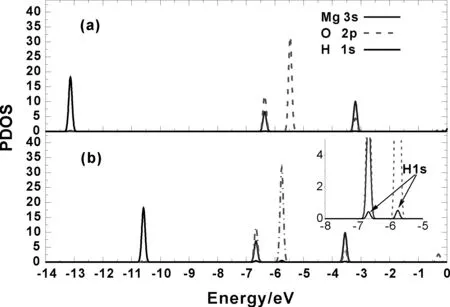
图2 电场中(E=0.005 a.u. )H2在Mg(a)和O(b)上吸附结构的PDOS.(b)中插图是能级为-7~-5 eV间的PDOS放大后的结果Fig. 2 The PDOS of H2 adsorption on Mg (a) and (O) atoms under external electric field with intensity of E=0.005 a.u.. The inset in (b) is the magnification of PDOS in the ranges of -7~-5 eV
为了在分子轨道水平上理解电场中H2与MgO分子的作用机理,我们研究了其典型吸附结构的分波态密度(PDOS).图2给出了电场强度为0.005 a. u.时H2在Mg和O上吸附结构的PDOS.在Mg上吸附时,H2的能级位于-13.2 eV处,与MgO分子价轨道的能级并无重叠,表明其间无分子轨道作用.H2在O上的吸附时情况则有所不同.由于H2在O上吸附时得电子,电子排斥能增加,其能级较在Mg上吸附时更高,位于-10.6 eV处.图2(b)插图清晰显示出在-5.7 eV
和-6.6 eV处有少量H2的1s成分与Mg的3s和O的2p成分重叠,表明其间存在一定的分子轨道作用.
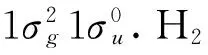
图3 场强为0.005 a. u.(MgO)H2吸附结构中H2分子参与形成的典型分子轨道Fig. 3 The typical molecular ortitals composed of H2 in the adsorption structures under external electric field
3.3 电场中多个H2在 MgO分子上的吸附
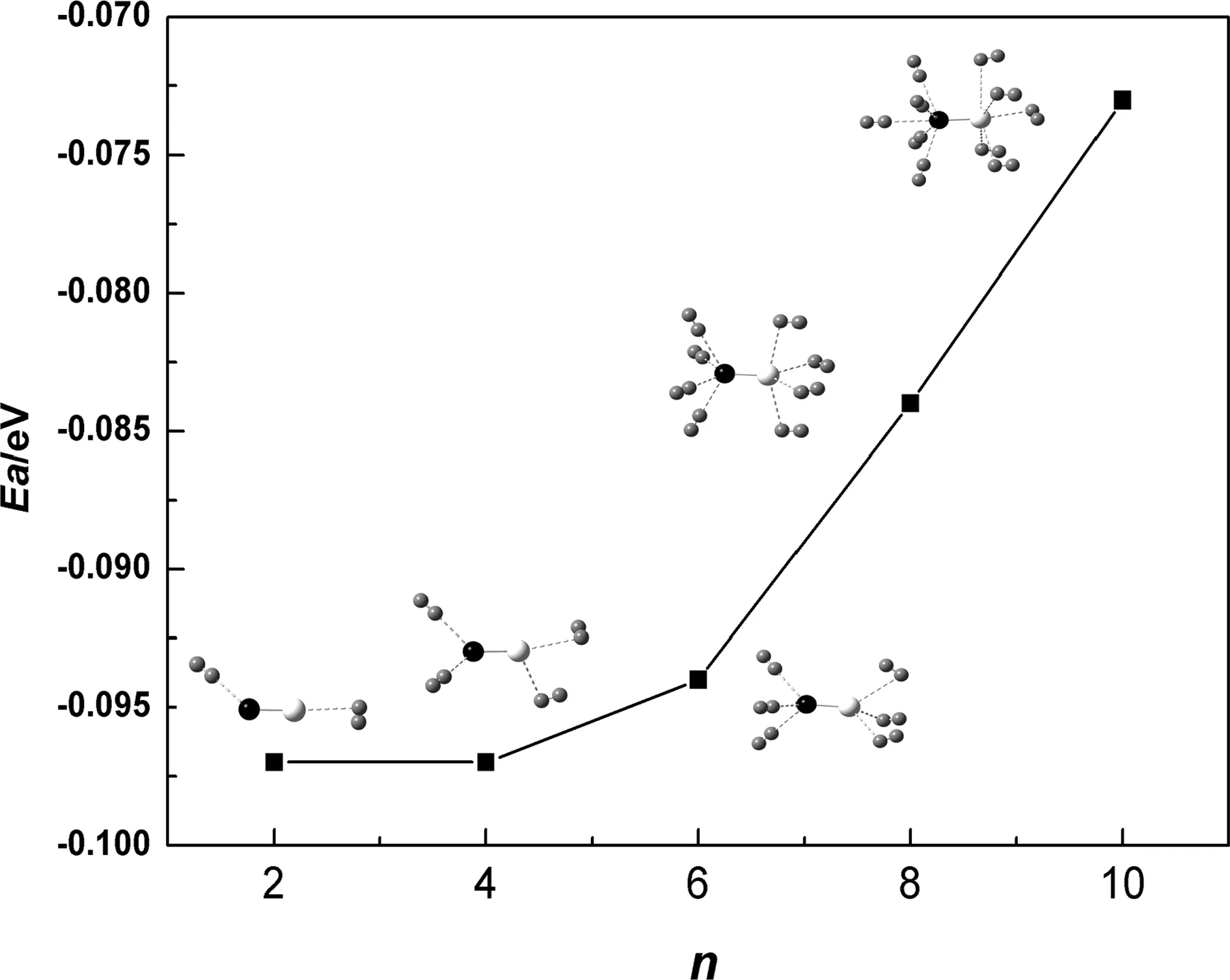
图4 电场中MgO分子吸附多个H2的结构及相应的平均吸附能Fig. 4 The adsorption structures and adsorption energies of multiple H2 on MgO molecule under external electric field
为研究电场中MgO分子的储氢质量密度,我们优化了场强为0.005 a.u.时多个H2在MgO分子上的吸附结构.由于电场中Mg及O均能吸附H2,因此我们从吸附两个H2开始,(即Mg及O均各吸附1个H2,其中H2在Mg上为侧位吸附,在O上为端位吸附),此后在Mg及O上逐次各增加1个H2,直至饱和吸附.优化得到的MgO分子吸附不同数目H2的稳定结构及相应的平均吸附能随吸附H2的数目n的关系如图4所示.电场中MgO分子最多能吸附10个H2,即Mg及O上均吸附5个H2,相应的质量密度高达33%.同时,随着吸附H2的数目n增多,相应的吸附强度降低,平均吸附能由吸附2个H2时的-0.098 eV变为吸附10个H2时的-0.073 eV,这可能是由于先吸附的H2对后吸附H2的位阻效应所致.
4 结 论
本文在密度泛函理论水平上研究了电场中H2在MgO分子上的吸附行为.结果表明电场能提高单个H2在MgO上的吸附强度.单个H2在Mg/O上的吸附能由无电场时-0.021/-0.099 eV分别提高到场强为0.005 a.u.时的-0.037/-0.139 eV;而电场反向时,吸附能降低,能快速脱附H2分子.电子结构分析表明,电场诱导H2与MgO极化,提高了吸附强度.H2吸附在O离子上时,由于阴离子极化效应更强,并且H2与MgO分子的价轨道形成一定的化学作用,因此电场效应更显著.电场中MgO分子最多能吸附10个H2,相应的质量密度达33wt%.同时,随着吸附H2的数目n增多,相应的吸附强度降低.
[1] Lubitz W, Tumas W. Hydrogen: an overview [J].ChemicalReviews, 2007, 107(10): 3900.
[2] Jena P. Materials for hydrogen storage: past, present, and future [J].TheJournalofPhysicalChemistryLetters, 2011, 2: 206.
[3] Bhatia S K. Optimum conditions for adsorptive storage [J].Langmuir, 2006, 25: 1688.
[4] Zhang Z W, Li J C, Jiang Q. Density functional theory calculations of the metal-doped carbon nanostructures as hydrogen storage systems under electric fields: a review [J].FrontiersofPhysics, 2011, 6(2): 1.
[5] Guo J H, Zhang H. The effect of electric field on hydrogen storage for B/C/N sheets [J].StructuralChemistry, 2011, 22: 1.
[6] Zhou J, Wang Q, Sun Q,etal. Electric field enhanced hydrogen storage on polarizable materials substrates [J].ProceedingsoftheNationalAcademyofSciences, 2010, 107(7): 2801.
[7] Sawabe K, Koga N, Morokuma K,etal. Anabinitiomolecular orbital study on adsorption at the MgO surface. I. H chemisorption on the (MgO)4cluster [J].TheJournalofChemicalPhysics, 1992, 97: 6871.
[8] Sawabe K, Koga N, Morokuma K,etal. Anabinitiomolecular orbital study on adsorption at the MgO surface. II. Site dependence of hydrogen chemisorption on the (MgO)4, 6, 8clusters [J].TheJournalofChemicalPhysics, 1994, 101: 4819.
[9] Hermansson K, Baudin M, Ensing B,etal. A combined molecular dynamicsabinitiostudy of H adsorption on ideal, relaxed, and temperature-reconstructed MgO (111) surfaces [J].TheJournalofChemicalPhysics, 1998, 109: 7515.
[10] Skofronick J G, Toennies J P, Traeger F,etal. Helium atom scattering studies of the structure and vibrations of H2physisorbed on MgO (001) single crystals [J].Phys.Rev. B, 2003, 67(3): 035413.
[11] Larese J Z, Frazier L, Adams M A,etal. Direct observation of molecular hydrogen binding to magnesium oxide (100) surfaces [J].Phys. B:CondensedMatter, 2006, 385: 144.
[12] Dawoud J N, Sallabi A K, Fasfous I I,etal. Structures of D2layers on MgO (001) [J].e-JournalofSurfaceScienceandNanotechnology, 2009, 7: 207.
[13] Chen H S, Chen H J. Adsorption of H2onto (MgO)9,12,24cluster surface was systematically investigated using density functional theory [J].ActaPhys.Sin., 2011, 60(7): 249 (in Chinese)[陈宏善, 陈华君.H2在MgO 团簇吸附的从头计算研究 [J]. 物理学报, 2011, 60(7): 249]
[14] Sun X, Hwang J Y, Shi S Z. Hydrogen storage in mesoporous metal oxides with ctalyst and external electric field [J].J.Phys.Chem. C, 2010, 114: 7.
[15] Giri S, Lund F, Núez A S,etal. Can starlike C6Li6be treated as a potential H2storage material? [J].TheJournalofPhysicalChemistryC, 2013, 117(11): 5544.
[16] Paul R, Kemper J B, Michael T B. Binding between ground-state aluminum ions and small molecules: Al+(H2/CH4/C2H2/C2H4/C2H6)n. can Al+insert into H2? [J].TheJournalofChemicalPhysics, 1998, 102: 8590.
[17] Viktoras D, Berwyck L J P, Evan J B. Attachment of molecular hydrogen to an isolated boroncation: an infrared and ab initio study [J].J.Am.Chem.Soc., 2008, 130: 12986.
[18] Liang D M, Jing T. Study on the properties of L1OH molecule under the external electric field [J].J.At.Mol.Phys., 2014, 31(2): 187 (in Chinese)[梁冬梅, 荆涛. 外电场作用下 L1OH 分子的特性研究 [J]. 原子与分子物理学报, 2014, 31(2): 187]
[19] Liu F T, Zhang S H, Shao J X. Study on the properties of FO Molecule under the external electric field[J].J.At.Mol.Phys., 2010, 27(3): 429(in Chinese) [柳福提, 张淑华, 邵菊香. 外电场作用下 FO 分子的特性研究[J]. 原子与分子物理学报, 2010, 27(3): 429]
[20] Wu X K, Jin T. The excited states structure and spectroscopy for tetracyanoquinodimethane(TCNQ) [J].J.At.Mol.Phys., 2011,28(3): 399(in Chinese) [吴学科, 荆涛. 外电场下 TCNQ 的激发与光谱性质研究[J]. 原子与分子物理学报, 2011, 28(3): 399]
[21] Huang D H, Wang F H, Ming J,etal. Study on structure characteristics of MgO molecule under external electric field [J].J.At.Mol.Phys., 2009, 58(5): 3052 (in Chinese)[黄多辉, 王藩侯, 闵军, 等. 外电场作用下MgO分子的特性研究 [J]. 物理学报, 2009, 58(5): 3052]
[22] Becke A D. Density‐functional thermochemistry. III. The role of exact exchange [J].TheJournalofChemicalPhysics, 1993, 98: 5648.
[23] Ditchfield R, Hehre W, Pople J A. Self‐consistent molecular‐orbital methods. IX. An extended Gaussian‐type basis for molecular‐orbital studies of organic molecules [J].TheJournalofChemicalPhysics, 1971, 54: 724.
[24] Frisch M J, Trucks G W, Schlegel H B,etal. Gaussian 03, Rev. C Wallingford CT: Gaussian, Inc., 2008.
Theoretical study of H2adsorption on MgO molecule under external electric field
XU Hong-Ping, YIN Yue-Hong
(College of Physics and Electronics Engineering, Northwest Normal University; Key Laboratory of Atomic & Molecular Physics and Functional Materials of Gansu Province, Lanzhou 730070, China)
The study on the interaction between H2and MgO molecule under external electric field is the basis for exploring the properties of hydrogen storage of MgO-based materials. The adsorption properties of H2on a MgO molecule under external electric field are studied at the level of B3LYP/6-31G**. The results show that the external electric field can efficiently enhance the adsorption energy of single H2on the Mg/O ions from -0.021/-0.099 eV without electric field to -0.037/-0.139 eV with the field intensity of 0.005 a.u., respectively. The electric field effect on O ion is more significant than that of Mg ion. Under the electric field, a MgO molecule can adsorb ten H2molecules at most, and the corresponding mass density of hydrogen storage reaches to 33wt%. Our results suggest that the electric field-induced adsorption of H2on the MgO-based materials is a potential method for hydrogen storage. The interaction between MgO molecule and H2under electric field is also discussed by the analysis of electronic structure.
External electric field; MgO; Hydrogen Storage; Adsorption
103969/j.issn.1000-0364.2015.12.002
2014-09-09
国家自然科学基金(11164024);甘肃省高等学校基本科研业务费项目;西北师范大学青年教师科研能力提升计划项目(NWNU-LKQN-12-30,NWNU-LKQN-13-17)
徐红萍(1978—),女,甘肃省临夏市人,研究生,讲师,主要研究领域为理论物理.
尹跃洪. E-mail: yyhwlx8 @nwnu.edu.cn
O561.1; O561.3
A
1000-0364(2015)06-0910-06

