中医临床研究伦理质量控制及量化评价
李 睿 翁维良 田元祥 耿 涛 陆 芳 赵 阳
(1 中国中医科学院西苑医院,北京,100091; 2 中国中医科学院中医临床基础医学研究所,北京,100700; 3 中国中医科学院广安门医院,北京,100053)
思路与方法
中医临床研究伦理质量控制及量化评价
李 睿1翁维良1田元祥2耿 涛3陆 芳1赵 阳1
(1 中国中医科学院西苑医院,北京,100091; 2 中国中医科学院中医临床基础医学研究所,北京,100700; 3 中国中医科学院广安门医院,北京,100053)
目的:建立中医临床伦理质量控制评价指标,实现对伦理质量的量化评价。方法:依据指标对科技部“十一五”国家科技支撑计划重大项目的全部课题组进行了中期和结题两阶段的量化评分,通过雷达图描述各课题的实际得分,利用卡方检验和相关性方法分析伦理质控水平对于课题总体质控得分的影响。结果:从中期到结题,伦理质控得分占质控评估总分的重要性呈下降趋势。结论:在试验早期阶段伦理质控的水平对于课题整体质量控制水平的影响更为重要。
中医临床研究;伦理;质量控制;评价
中医临床研究是运用中医药治疗方法,以人体为受试对象,为解决临床实际问题而进行的研究活动,属于人体生物医学研究范畴,而所有涉及到以人体为研究对象的医学研究都必须首先遵从伦理学原则[1]。近年来国家也越来越重视临床研究的伦理学建设,出台了多项法规规范,如CFDA颁布的《药物临床试验伦理审查工作指导原则》、国家中医药管理局印发的《中医药临临床研究伦理审查管理规范》等,以加强伦理审查工作质量,提升保护受试者的水平。临床研究的伦理原则根本目的是保护受试者的权益,将所有风险甚至不适控制在最小范围内[2]。因此,对于临床研究的伦理质控应着眼于临床研究是否符合伦理学基本要求,研究的开展是否遵照本单位医学伦理委员会的程序以及具体的执行情况等。
1 中医临床研究伦理质量控制[3]
1.1 研究方案伦理审查 伦理审查是开展生物医学研究的国际通则,中医临床研究方案在正式进入临床实施前必须经过伦理委员对其科学性和伦理合理性进行审查,以充分保护医学研究中受试者的权益和安全,保障研究的科学性和伦理合理性。对于研究方案的伦理质控要点包括[4]:1)临床试验开始前应获得本单位伦理委员会的批件,作为参加单位如伦理委员会不要求再次审核的,至少应保留组长单位伦理批件的复印件;2)批件上标注的版本日期及版本号应与临床实施的方案版本号和日期对应;3)临床实施阶段对于方案的各种变更需经过伦理委员会的批准;4)颁发批件的日期应早于首例受试者签署知情同意书日期等。
1.2 知情同意过程及知情同意书的签署 知情同意过程作为受试者了解试验风险和自身受益的重要途径,应严格执行“充分告知,完全理解,自主选择”的原则[5],研究者应保证所做出的解释和说明使得受试者充分知情,受试者最终是否参与临床研究的决定是在充分知晓整个研究的基础上做出的。对知情同意及知情同意书的签署质控要点包括[6-7]:1)签署的知情同意书份数应与筛选的受试者人数一致。2)签署时间是否在所有试验相关检查之前,但与疾病诊断相关的检查或医疗机构的常规检查除外。3)知情同意书签署内容应包括受试者(法定代理人)和研究者的签名、有效联系方式、签署日期。4)知情同意书的签署日期、姓名与试验过程及病历资料的相符性,如核实知情同意书的研究者签字是否与研究病历一致,受试者签字是否与患者日志一致。原则上必须是受试者本人签署知情同意书,但对于无行为能力和无法正常书写的受试者,应确保签署日期与签署人与原始文件中记录一致。5)应给予受试者充分的时间考虑是否参加该临床试验,但受试者与研究者的签字必须是同一天。6)给受试者一份签字后的知情同意书复印件。7)对于在临床试验中变更的知情同意书,需经过伦理委员会的审核,且在此之后入组的受试者应签署新版知情同意书等。
1.3 跟踪审查 伦理委员会应确保临床试验的全过程处于其监管范围内,定期跟踪审核研究方案的执行情况,重点关注安全性管理,包括新的安全性信息,严重不良事件以及非预期不良反应等,以确定是否需要采取相应措施重新平衡受试者的风险与收益,使得受试者的权利和安全得到持续的保护[8-9]。对于伦理跟踪审查的质控要点包括:1)临床试验中发生的严重不良事件和方案偏离均应向伦理委员会报告。2)对于时间跨度较长的研究项目,研究者每年至少向伦理委员会提交一次年度进展报告,并得到伦理委员会的批复意见。如审查意见是需要做必要修正后方可继续研究,则应制定向相应的修改措施并确保其落实情况。3)临床试验结束后应汇总受试者入组,严重不良事件发生以及受试者权益保护情况,向伦理委员会递送结题审查文件。
2 中医药临床研究伦理质量控制量化评价
中医临床研究伦理质量控制评估是对以解决中医临床问题为目的而进行的科研活动伦理质量的评估,考核的重点是受试者保护的措施及其执行水平。评估从方法上区分,有定性评估、定量评估及定性与定量相结合的评估。定性评估指标测评面较广,但不能较为直观地区分课题的执行水平;定量指标不易设置,但可实现对于课题的精确评价[10-11]。科技部“十一五”国家科技支撑计划重大项目“中医临床研究的方案优化及质量控制研究”课题组对“重大疑难疾病中医防治研究”项目的全部42个课题的伦理管理水平进行了中期和结题质控检查,并初步探索了伦理质控评价量化指标:

表1 中医临床伦理质量控制评估指标
注:抽查的20份知情同意书,其中课题承担单位5份,其余课题参加单位共计15份。
2.1 依此指标对全部课题进行了中期和结题的量化评估数据采集 对于有多名测评者参与采集的课题取平均值为其最终数据,同时为了消除定量评价结果在各指标间的数量差异,将各课题数据进行标准化处理,最终以雷达图的方式进行描述。

图1X2伦理质控中期评估图图2X2伦理质控结题评估

图3 中期质控评估总分 图4 结题质控评估总分
2.2 根据全部课题质量控制评估指标(12个指标)采集的数据,绘制中期和结题两阶段各课题的质控评估总得分,并将伦理质控评估得分和课题质控评估总得分进行相关性分析。
2.3 以伦理质控指标的重要性,即伦理质控得分占质控总得分的比例,分析中期和结题两个阶段伦理质控指标重要程度的变化。

表2 伦理质控评估与质控总分的相关性分析(中期)

表3 伦理质控评估与质控总分的相关性分析(结题)
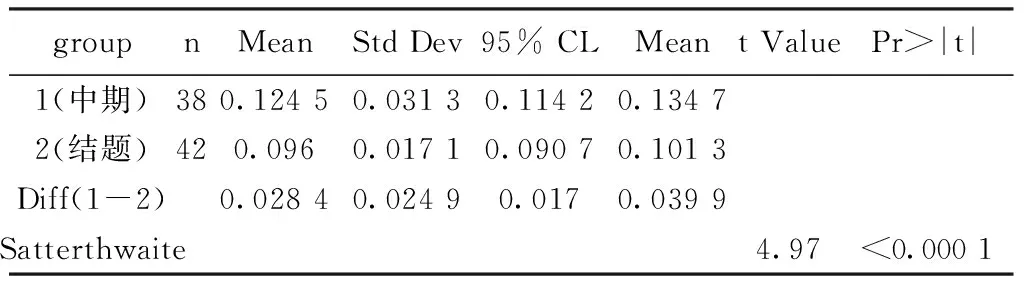
表4 伦理质控指标重要性统计描述
3 讨论
3.1 各课题在x1指标上的得分 全部课题在定性指标伦理委员会批件上的数据显示,中期和结题两个时间节点上被评估课题该指标得分均为满分。结合质控监查的实际情况,所有课题承担单位在正式进入临床受试者招募之前,研究方案均经过了本单位的伦理委员会的审核批准,同时参研单位(分中心)至少也保留了课题承担单位的伦理批件的副本,符合《中医临床研究质量控制与质量保证规范》规范要求以及以学伦理学的基本要求,说明研究者重视研究方案的伦理审查,在伦理审查对保护受试者的作用方面认识较为一致。
3.2 x2与质控总得分在中期和结题两阶段的变化 对各课题在x2(知情同意书签署完整规范性)指标的得分以雷达图表示。雷达图最内层的圆代表评价对象的最低水平,最外层的圆代表评价对象的最高水平;从圆心引出若干条射线将圆平均分割,每条射线代表一个评价对象,评价对象的实际值按比例标在图中相应的射线上,然后将实际值用直线连接起来,形成不规则的多边形[12-14],就绘制出了全部课题伦理质控评价的“雷达图”。从图1-图4,我们看到中期到结题两个时间节点上该指标变化不大,同时课题的总体质控得分也大致相同。同时分析X2的伦理质控评估分数与课题质控总分的相关性,相关性系数从中期的0.266 14下降到结题的0.146 56,且相关检验都没有统计学意义(P=0.106 3和P=0.354 3),说明伦理质控评估分数和课题质控总分不具有相关性。再进一步分析伦理质控指标的重要性,即计算伦理质控得分占质控总得分的比例,中期的均值为0.124 5(95% CI 0.114 2,0.134 7),结题的均值为0.096(95% CI 0.090 7,0.101 3),且二者具有统计学意义(P<0.000 1)。说明伦理质控从中期到结题占质控评估总分的重要性呈下降趋势,分析原因是在课题前中期入组数量相对较少,质控评估涉及的若干方面(研究记录质量、真实性、依从性、质量控制、数据管理)刚刚开始或尚未开始,因此分数也相对较低,此时强调研究开展的第一步:知情同意书签署规范性对于质控评估的总分影响相对较大;而到结题时鉴于前期的要求,知情同意书的签署已基本规范,各课题在此指标上的水平大致相同,而其他方面如研究记录质量、数据管理等方面各课题的水平变化差异变大,这些方面的优劣差异决定了质控总得分的差异,而此时伦理质控水平对总体质控得分的影响相对降低。
3.3 伦理质控中存在的常见问题 通过中期和结题伦理质控评估数据采集发现各课题普遍缺少伦理跟踪审查,尽管全部课题在开始试验之前已经获得了伦理委员会的批件,但是对于研究周期较长(>1年)的临床研究应进行持续的伦理跟踪审查,以确保方案执行的依从性以及伦理性。对于知情同意书签署规范性存在签署时间在筛选检查之后,知情同意书未交受试者一份,研究者、受试者联系方式及日期等必要信息缺失等问题[15]。
4 结论
中医临床研究伦理质控量化评估指标可以定量分析各课题在伦理质量方面的差异,同时通过雷达图以直观的二维图形式呈现不同时间节点上课题伦理质量的变化,有助于测评者客观评估课题伦理质控的整体质量和变化趋势。但目前中医临床研究伦理质控量化评估指标设置尚显不足,仅从知情同意书签署的规范性方面考量,若今后推广使用评价其他课题还应进行指标的补充。评估的目的不是单纯评出名次及优劣的程度,更重要的是引导和鼓励被评价对象向正确的方向和目标发展。依据评估指标进行考核,指标的评分标准及其所反映的内容,就具有较强的导向作用,引导被评估者向目标靠近。因此,中医临床研究伦理质控评估指标就中医临床研究伦理质量控制的关键环节进行评估,对课题组提高临床研究伦理质量控制水平有明显的导向作用。同时,在试验早期阶段伦理质控的水平对于课题整体质量控制的影响更为重要。
[1]汪秀琴,熊宁宁,王思成.中医药临床研究与伦理审查[J].中国医学伦理学,2010,23(4):82-83.
[2]World Medical Association.Declaration of Helsinki:recommendations guiding physicians in biomedical research in human subjects[Z].Helsinki:World Mecial Association,1964(Amended Tokyo 1975,Venice 1983,Hongkong 1989,Somerset West 1996,Edinburgh 2000).
[3]李睿,陆芳,翁维良.中医临床研究设计中的伦理问题与优化[J].中华中医药杂志,2010,25(7):1050-1053.
[4]王丽萍,王小丹.药物临床试验伦理委员会运作的实践经验[J].药学服务与研究,2012,12(3):191-220.
[5]胡晋红.论医学研究知情同意的伦理审查[J].中国医学伦理学,2014,27(2):180-182.
[6]陈敏,谢俊强.1080份知情同意书填写缺陷分析[J].现代医院,2012,12(6):119-120.
[7]胡晋红.医学研究知情同意过程及信息告知的伦理审查要点[J].药学服务与研究,2014,14(3):166-169.
[8]汪秀琴.临床研究的伦理审查——跟踪审查[J].中国医学伦理学,2011,24(7):677-678.
[9]张玮静,陆琴,吴炅.论伦理委员会秘书在临床研究跟踪审查中的作用[J].中国医学伦理学,2014,27(3):327-329.
[10]叶茂林.科技评价理论与方法[M].北京:社会科学文献出版社,2007:188-200.
[11]杜栋,庞庆华,吴炎.现代综合评价方法与案例精选[M].2版.北京:清华大学出版社,2008:6-8.
[12]付赟,方德英.雷达图法在综合评价中的应用研究[J].统计与决策,2007(24):176-178.
[13]吴大嵘,梁伟雄,温泽淮,等.建立中风病血瘀证宏观辩证量化标准的方法探讨[J].广州中医药大学学报,1999,4(16):249-258.
[14]邬新峰,赖世隆,梁伟雄.中医药临床疗效评价中结局指标的选择与应用[J].广州中医药大学学报,2002,19(4):251-255.
[15]韩小强,张京萍,席家宁医学伦理审查在医院的规范运行研究[J].中国医药,2012,7(5):642.
(2014-05-23收稿 责任编辑:徐颖)
基金项目:306医院医药卫生科研专项课题(编号:12QN04)
作者简介:张喆(1980.2—),男,博士,主治医师,研究方向:中西医结合消化系统疾病的诊治,E-mail:zhangzhebj@163.com
通信作者:许继宗(1979.5—),男,硕士,主治医师,研究方向:中医内科及针灸治疗,E-mail:sunglow010@126.com
Quantitative Evaluation and Quality Control of Ethics of Chinese Clinical Research
Li Rui1,Weng Weiliang1,Tian Yuanxiang2,Geng Tao3,Lu Fang1,Zhao Yang1
(1XiyuanHospitalofChinaAcademyofChineseMedicalSciences,Beijing100091,China; 2InstituteofBasicResearchinClinicalMedicine,ChinaAcademyofChineseMedicalSciences,Beijing100700,China; 3Guang’anmenHospital,ChinaAcademyofChineseMedicalSciences,Beijing100053,China)
Objective:In order to set up ethics quality control index of Chinese clinical research,and realize the quantitative evaluation of the ethics quality.Methods:In accordance with the quality control index,all the projects of “Prevention and Treatment of Difficult and Complicated Disease of TCM ” plan of the “11th Five-year National Key Technology R&D Program” were given a mid-term and concluding evaluation,and the scores were described with radar map method,and the influence of ethical level of quality control to total quality control scores was analyzed with chi-square test and correlation methods.Results:From mid-term stage to concluding stage,the importance of ethical quality score of total quality control score was in a downward trend.Conclusion:In the early stage,ethical quality control level shows greater impact on the total quality control level.
Chinese clinical research; Ethics; Quality control; Evaluation
中医药行业科研专项:中医慢病临床科研体系及其成果转化应用模式研究(编号:201107006);“重大新药创制”科技重大专项创新药物研究开发技术平台建设(编号:2012ZX09303-010-002)
李睿,女,主治医师,研究方向:中西医结合、中医药研究的临床评价,Tel:(010)62835652,E-mail:crystal005@163.com
翁维良,男,研究员,研究方向:中西医结合心血管、临床药理,E-mail:ww6488@126.com
R-052
A
10.3969/j.issn.1673-7202.2015.03.033

