黄花菜叶多糖的提取及抗氧化活性研究
周纪东,李余动
(1.浙江育英职业技术学院 生物技术系, 杭州 310018;2.浙江工商大学 食品与生物工程学院, 杭州 310035)
黄花菜属百合科萱草属多年生草本植物,又名金针菜,其花可食用,为我国特产蔬菜。是一种营养价值高、具有多种保健功能的花卉珍品蔬菜,还是一味良药,其花、叶、根晒干后均可入药用。[1]《本草纲目》中称其有安神醒脑、增智宽胸、美容养血、解热消毒、除烦通乳之功效。[2]黄花菜富含多糖类物质。[3]大量研究表明,植物多糖具有调节免疫、抗肿瘤、抗肥胖、控制血糖、降胆固醇、降血脂等多种功能,由于其来源广泛且没有细胞毒性、应用于生物体时毒副作用小等特点而被越来越多的人所关注,其相关研究也日益受到重视。[4-5]
近年来,人们深入研究开发了黄花菜的栽培技术,黄花菜的种植面积与产量逐年递增,采摘过程中作为植株主要部分的黄花菜叶子通常不加利用被废弃。目前,国内有关黄花菜中化学成分及其生物活性的研究已展开,主要集中于黄酮、多酚等化合物,[6-8]有关黄花菜中多糖的研究报道很少,尚无关于黄花菜叶中多糖的研究报道。本文就黄花菜叶中多糖的提取条件、含量测定及抗氧化活性等进行了研究,以期为深度开发利用黄花菜这一丰富资源提供科学依据。
一、材料与方法
(一)试剂与仪器
黄花菜采自浙江省桐庐县分水镇,经杭州市植物园卢毅军高级工程师鉴定为百合科萱草属黄花菜(Hemerocallis citrina Baroni)。
试验中使用的乙醇、石油醚、丙酮、硫酸、苯酚、H2O2、氯仿、正丁醇等主要试剂均为国产分析纯,木瓜蛋白酶为Merck公司产品,小鼠购自浙江省医学科学院。
试验使用的主要设备有:HH-2数显恒温水浴锅(常州国华电器有限公司);752W紫外—可见分光光度计(上海朗伯仪器有限公司);Anke TDL-40B离心机(上海安亭科学仪器厂);RE-2000A旋转蒸发仪(上海亚荣生化仪器厂);DZF-6021真空干燥箱(上海一恒科学仪器有限公司)。
(二)方法
1.多糖提取
提取工艺流程:黄花菜叶子→预处理→浸提→过滤→浓缩→醇析沉淀→离心分离→粗制PDL→复溶→除蛋白→脱色→纯化→PDL。
(1)样品预处理
黄花菜叶子于60℃干燥至恒重,用粉碎机磨成粉末,过400目筛备用。取适量黄花菜叶子粉末用滤纸包好,放入索氏提取器,用石油醚60~90℃回流脱脂3 h。将脱脂后的滤纸包风干,用80%乙醇85℃回流6 h,以除去样品中单糖、寡糖等,最后自然风干滤渣。
(2)热水浸提
①工艺参数的单因素试验。影响粗制PDL提取率的因素很多,选择提取温度、提取时间、液固比、提取次数作为考察因素,在保持其他因素相同条件下,分别考察上述各因素对多糖提取率的影响。多糖提取率(m/m)/%=[热水浸提物干品质量(g)/样品质量(g)]×100。
②工艺参数的正交试验。根据单因素试验的结果,确定正交试验的因素水平,采用L9(34)正交表进行正交试验,以多糖提取率为考察指标,研究粗制PDL浸提工艺参数的最佳组合。
③浓缩。热水浸提液用3层纱布过滤,滤液用旋转蒸发仪浓缩至约100 mL。
④醇析。向浓缩液中缓慢加入4倍体积的无水乙醇,用玻璃棒缓慢搅拌,使乙醇浓度达到80%(V/V),4℃静置24 h,4 000 r/min离心10 min,收集沉淀即为粗制PDL。
⑤除蛋白与脱色。将粗制PDL复溶于水,采用中性酶-Sevag法[9]除去蛋白质和H2O2氧化法[10]脱色。
⑥纯化。将多糖水溶液透析36 h后减压浓缩,按照④中所述,再次醇析沉淀、离心,所得沉淀分别用95%乙醇、无水乙醇、丙酮各洗3次,60℃真空干燥得PDL。
2.多糖含量测定
(1)标准曲线的建立
葡萄糖溶液标准曲线建立采用苯酚—硫酸法,[11]所得回归方程为 A=0.0087ρ(r=0.9997,n=6),式中 A为吸光度,ρ为葡萄糖溶液质量浓度(μg/mL)。该标准曲线在葡萄糖溶液质量浓度5.00~80.00 μg/mL范围内呈良好的线性关系。
(2)换算因素的计算
准确称取3份各20 mg PDL,分别用蒸馏水溶解,定容到100 mL。准确移取0.3 mL按照2(1)的方法测定吸光值,由回归方程计算供试液中葡萄糖质量浓度,根据f=m/(ρ×d)计算换算因素。式中f为换算因素;m为PDL质量(μg);ρ为PDL供试液中葡萄糖质量浓度(μg/mL);d为多糖的稀释因素。计算求得PDL相对于葡萄糖的换算因素f=1.4972(RSD=1.30%,n=3)。
(3)样品中多糖含量测定
准确称取6份各10 g黄花菜叶子,按照上述中多糖提取工艺(优化后)分别制备出粗制PDL和PDL各3份,分别用蒸馏水溶解,定容到500 mL,稀释100倍后准确移取1 mL按照上述方法测定吸光值,由回归方程计算供试液中葡萄糖质量浓度,根据w=[(ρ×d×f)/m]×100计算黄花菜叶中多糖含量,式中w为多糖含量 (%,m/m);ρ为供试液中葡萄糖质量浓度(μg/mL);d为样液的稀释因素;f为换算因素;m 为样品质量(μg)。
3.PDL供试液的配制
准确称取200 mg PDL,溶于100 mL蒸馏水配制成2 mg/mL PDL供试液。
4.PDL清除羟自由基(·OH)能力的测定
反应体系中依次加入9 mmol/L FeSO4溶液、9 mmol/L水杨酸-乙醇溶液各1mL及0.1~0.5 mL PDL供试液(空白对照组加入蒸馏水),加入8.8 mmol/L H2O2溶液1 mL启动反应,37℃反应30 min,以蒸馏水做参比溶液,在510 nm处测吸光度。[12]清除率计算公式为S(%)=[(A0-Ai)/A0]×100,式中A0为空白对照液吸光度,Ai为供试液吸光度。
5.PDL清除超氧阴离子自由基(O2-·)能力的测定
反应体系中加入0.1 mol/L Tris-HCl(pH=8.2)缓冲液4.5 mL,再加入0.1~0.5 mL PDL供试液(空白对照组加入蒸馏水),用蒸馏水定容至8 mL,混匀后于25℃水浴中反应10 min,加入预热至25℃的6 mmol/L邻苯三酚溶液0.1 mL,计时摇匀,准确反应3 min后,加入8 mol/L HCl溶液0.5 mL终止反应,以蒸馏水做参比溶液,在325 nm处测定吸光度。[13]清除率计算公式同上。
6.PDL抑制LPO能力的测定
按照参考文献[14]制备10%(V/V)肝组织匀浆。反应体系中加入1 mL生理盐水、1 mL肝组织匀浆,再加入0.1~0.5 mL PDL供试液(空白对照组加入蒸馏水)、80%(V/V)CCl4-酒精溶液0.5 mL,混匀后置于37℃水浴中反应40 min,立即加入100 g/L三氯醋酸溶液1 mL混匀,3 500 r/min离心10 min。取上清液2 mL,加入5 g/L硫代巴比妥酸(TBA)显色剂2 mL,混匀后于沸水浴中煮沸15 min,冰浴中速冷至室温后,以蒸馏水做参比溶液,在535 nm处测定吸光度。[14]抑制率计算公式同上。
二、结果与分析
(一)单因素试验结果
1.液固比对PDL提取率的影响
采用70℃热水浸提2 h,改变液固比,考察不同液固比对多糖提取率的影响,结果见图1。
如图1所示,随着液固比增加,多糖提取率不断增大,直至液固比达到35∶1后,不再增大并趋于回落。鉴于后续的浓缩工艺,所以选择液固比为35∶1为宜。
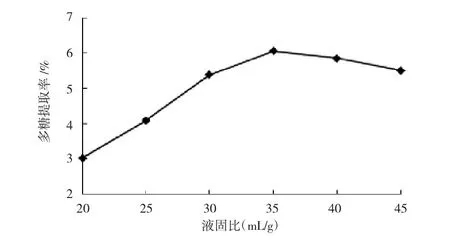
图1 液固比对多糖提取率的影响
2.浸提时间对PDL提取率的影响
采用浸提温度70℃,液固比35∶1,改变浸提时间,考察不同浸提时间对多糖提取率的影响,结果见图2。
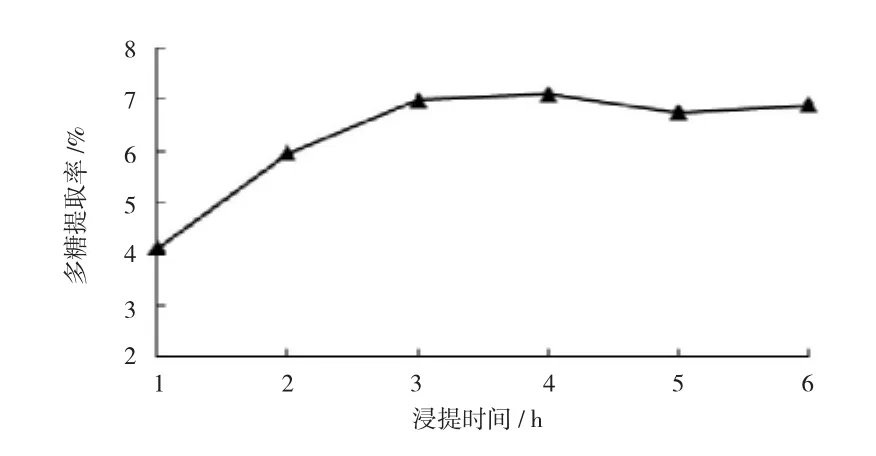
图2 浸提时间对多糖提取率的影响
如图2所示,当浸提时间在2~4 h时,多糖提取率缓慢增大,4 h后回落并趋于稳定。为了缩短工时,减少能耗,浸提时间以选择3 h为宜。
3.浸提温度对PDL提取率的影响
采用液固比35∶1,改变浸提温度,热水浸提3h,考察不同浸提温度对多糖提取率的影响,结果见图3。
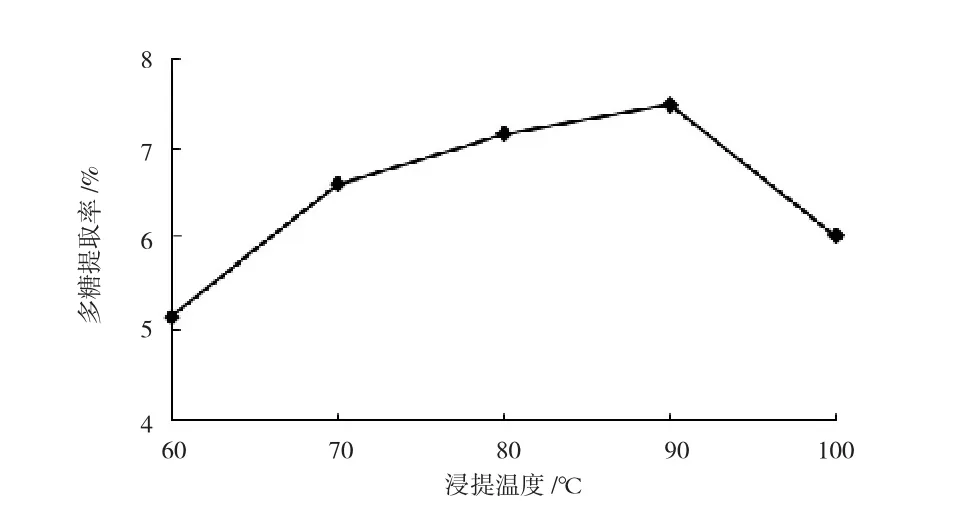
图3 浸提温度对多糖提取率的影响
图3所示,随着浸提温度升高,多糖提取率不断增大,90℃时达到最大值,温度继续升高反而显著下降。由此推测,高温对PDL的结构与活性有一定影响,所以90℃是多糖浸提的合适温度。
4.浸提次数对PDL提取率的影响
采用浸提温度90℃,液固比35∶1,浸提时间3h,改变浸提次数,考察不同浸提次数对多糖提取率的影响,结果见图4。
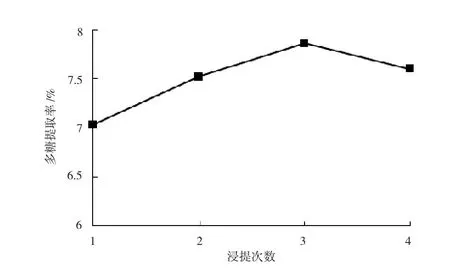
图4 浸提次数对多糖提取率的影响
图4所示,第1次浸提到的多糖最多,随着次数的增加,每次浸提到的多糖质量越来越少,至第4次浸提到的多糖总质量反而有所下降。由此推测,持续高温下浸提可能会造成PDL降解。从经济角度考虑,浸提次数应不超过3次。
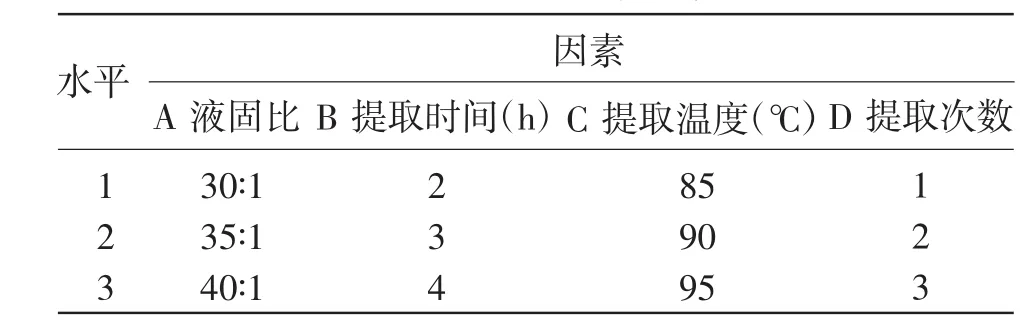
表1 正交试验因素水平表
(二)正交试验结果
根据单因素试验的结果,确定因素水平见表1。正交试验方案及结果见表2。
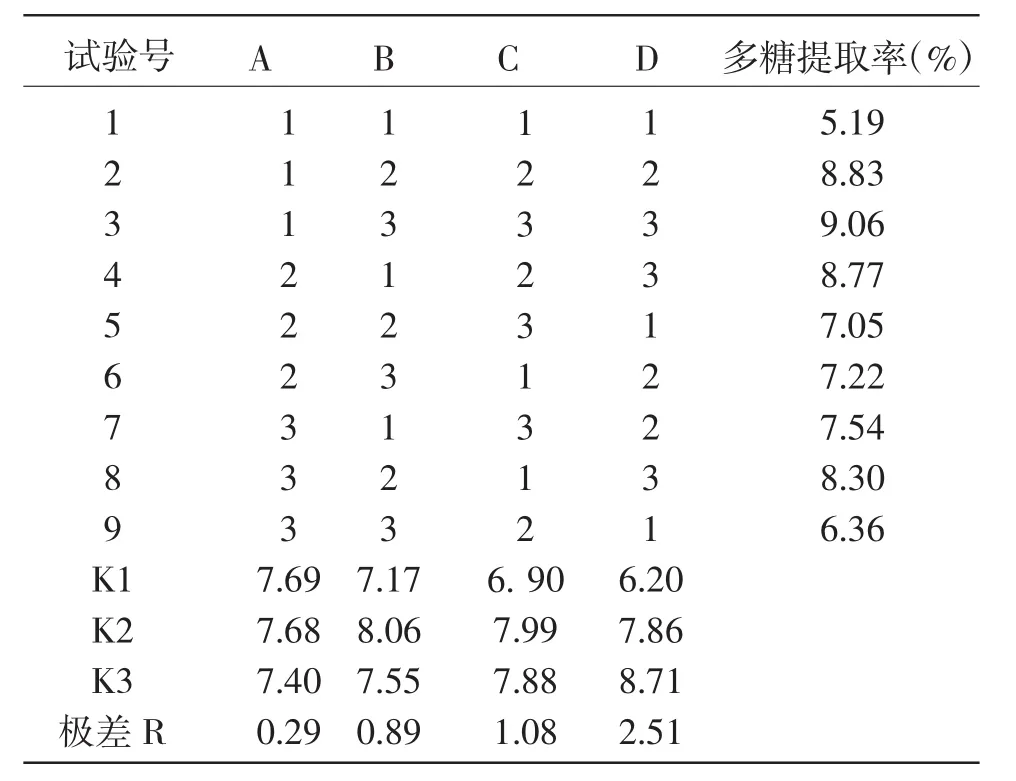
表2 正交试验方案及结果
由表2可知,根据极差R值分析结果,4个因素对多糖提取率的影响次序为提取次数(D)>提取温度(C)>提取时间(B)>液固比(A)。PDL浸提工艺参数的最佳组合为A1B2C2D3,即提取温度90℃,提取时间3 h,液固比30:1,提取3次。按照此最佳组合条件进行浸提工艺的验证试验,结果显示多糖提取率为 9.13%(RSD=2.45%,n=3)。
(三)样品中多糖含量测定
上述所得粗制PDL和PDL的供试液分别测得吸光值,代入公式计算得粗制PDL和PDL的多糖含 量 分 别 为 10.49%(RSD=2.77% ,n=3)、6.05%(RSD=3.30%,n=3)。由此表明,粗制PDL在经过除蛋白、脱色等纯化工艺过程中,其多糖含量有所损失。
(四)PDL对羟自由基(·OH)的清除效果
Fenton反应体系中H2O2与Fe2+混合产生·OH,加入水杨酸捕捉·OH生成有色物质。PDL可抑制H2O2引发·OH生成,通过测定有色物质的积累量,可表征PDL对·OH的清除效果。如图5所示,PDL质量与·OH的清除率存在正相关,但其最大清除率仅为19.45%,清除效果偏低。
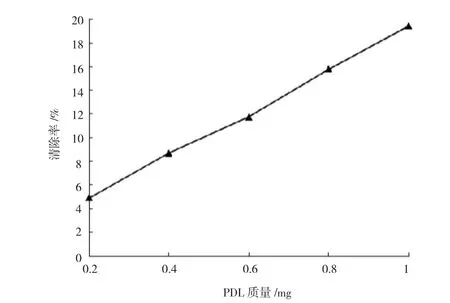
图5 PDL对·OH的清除效果
(五)PDL对超氧阴离子自由基(O2-·)的清除效果
邻苯三酚在碱性条件下自氧化释放O2-·,并生成带色中间产物。PDL可抑制邻苯三酚自氧化生成O2-·,通过测定带色中间产物的积累量,可表征PDL对O2-·的清除效果。图6所示,PDL对O2-·具有一定的清除效果,并呈量效效应。PDL对O2-·的最大清除率达到55.31%,清除效果较为明显。
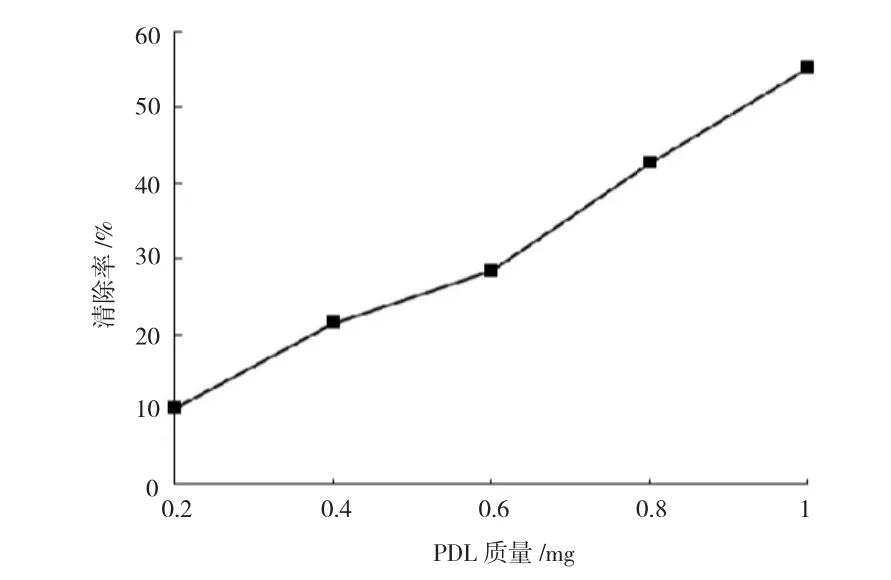
图6 PDL对O2-·的清除效果
(六)PDL对LPO的抑制效果
在CCl4-酒精溶液诱导下,小鼠肝组织中脂质发生过氧化反应产生过氧化物丙二醛,可与显色剂反应生成有色产物。丙二醛生成量可表征脂质过氧化反应的程度。PDL可抑制脂质过氧化反应生成丙二醛,通过测定有色产物的积累量,可表征PDL对脂质过氧化反应的抑制效果。结果见图7。图7所示,PDL可抑制丙二醛的生成,表明PDL可抑制CCl4-酒精溶液所诱导的肝组织脂质过氧化反应,且呈量效效应。PDL对LPO的最大抑制率为42.17%,抑制效果较为明显。
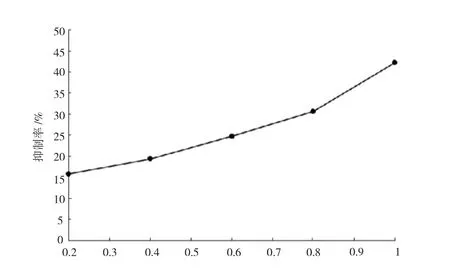
图7 PDL对LPO的抑制效果
综上,PDL对3种自由基的最大清除效果比较可知,O2-·(55.31%)>LPO(42.17%)>·OH(19.45%),均未超过60%。由此推断,PDL对自由基的清除效果不显著。
三、结 论
PDL浸提工艺参数为提取温度90℃,提取时间3 h,液固比30∶1,提取3次。按此浸提,多糖提取率为9.13%,多糖含量为6.05%。
PDL对3种自由基的清除效果不显著,且黄花菜叶中PDL含量较低,表明叶子作为光合作用的营养器官,其中的多糖大都是贮存性多糖,抗氧化活性不强。
关于黄花菜其它器官如花和根中多糖的含量及生物活性的研究有待于开展,其结果可与本研究进行比较与探讨。
[1]张西露,粟建文,叶英林.祁东县黄花菜产业发展现状及对策分析[J].湖南农业科学,2013(15):148-151.
[2]南京中医药大学.中药大辞典[Z].上海:上海科学技术出版社,2006:1947-1948.
[3]韩志平,张春业,张海,等.黄花菜和3种食用菌营养价值的研究[J].山西大同大学学报(自然科学版),2013(5):63-65.
[4]叶涛,叶湘漓,贺建华.植物多糖功能与作用机理的研究进展[J].农产品加工·学刊,2012(1):22-23.
[5]周静华,左绍远.植物多糖生物学活性研究进展[J].大理学院学报,2012(6):35-37.
[6]周秀梅,王秀兰,沈楠.黄花菜粗黄酮提取工艺优化[J].中国医药科学,2013(15):59-62.
[7]白雪松,杜鹃,刘新迪.黄花菜根中总黄酮的超声提取工艺研究[J].安徽农业科学,2012(12):7108-7109.
[8]周向军,高义霞,张继.黄花菜多酚提取工艺及抗氧化作用的研究[J].作物杂志,2012(1):68-72.
[9]胡喜兰,许瑞波,陈宇.牛蒡叶多糖的提取及生物活性研究[J].食品科学,2013(2):78-82.
[10]王辰龙,张子奇,王曼,等.黑木耳多糖的提取分离及体外抗凝血作用研究[J].食品工业科技,2013(9):238-241.
[11]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,2006:11-12.
[12]刘航,国旭丹,马雨洁,等.超声波辅助提取苦荞麦多糖工艺优化及其体外抗氧化研究[J].食品科学,2013(14):45-50.
[13]邵平,刘佳,王欧丽,等.铜藻多糖微波辅提工艺优化及其抗氧化活性研究[J].核农学报,2014(6):1062-1069.
[14]黄朋纳,黄清松.海藻多糖抗氧化作用的实验研究[J].宜春学院学报,2012(4):106-108.

