血糖、血脂异常对老年痴呆患者认知状况的影响
宋 红,付 霞,陈 博
(1.沈阳医学院附属第二医院神经内二科,沈阳110013;2.辽宁大学医院内科,沈阳110036;3.沈阳医学院附属第二医院神经内科,沈阳110013)
血糖、血脂异常与老年痴呆的关系是近几年临床研究的重点,越来越多的研究证实它们之间存在密切的因果关系[1],但研究结果并不一致。在此背景下,笔者将145例老年痴呆患者的血糖、血脂水平与非痴呆老年人对比,分析它们之间的关系,并进一步研究了血糖、血脂异常病程与老年痴呆认知损伤程度的关系。研究取得了相应的观察结果,现报道如下。
1 资料与方法
1.1 一般资料 收集本院2011年3月至2013年11月就诊的老年痴呆患者145例。纳入标准:(1)年龄60岁以上;(2)符合美国《精神疾病诊断和统计手册》第4版(DSM-Ⅳ)痴呆诊断标准[2],确诊为老年性痴呆;排除标准:(1)抑郁症、精神分裂症、慢性乙醇中毒、头部外伤、中枢神经系统感染继发性痴呆等;(2)抑郁患者,汉密尔顿抑郁量表评分高于16分者;(3)心、肝、肾、血液、内分泌等系统严重疾患及癫痫患者;(4)经颅脑核磁检查存在血管性痴呆、额叶性痴呆的相关病理表现;(5)近期未使用维生素类及降脂类药物。将全部老年痴呆患者设为观察组,采用简明精神状态检查量表(MMSE)对观察组病例评估,并将得分18分以下设为低认知组,共64例,其中男37例,女27例,病程2~17年,平均(8.60±6.57)年;得分达18分以上者设为高认知组,共81例,其中男48例,女33例,病程3~18年,平均(9.10±7.15)年。选择同期医院查体的非痴呆老年人100例为对照组,入选者无神经及精神疾病病史,亦无使用降脂药物及维生素等药物。对照组也采用MMSE量表进行评估。低认知组和高认知组病程差异无统计学意义(P>0.05),各组性别、年龄、受教育年限两两比较,差异均无统计学意义(P均>0.05),具有可比性。
1.2 方法
1.2.1 检测指标 所有纳入研究者均在清晨空腹安静状态下采取静脉血4mL,常规分离出血清之后检测。空腹血糖(FBG)水平采用己糖激酶法测定,三酰甘油(TG)采用氧化酶法测定,总胆固醇(TC)采用CHOD-PAP法测定,高密度脂蛋白(HDL-C)和低密度脂蛋白胆固醇(LDL-C)采用一步酶法测定。所有标本均在7170A全自动生化分析仪器上测定,操作过程严格按照说明书要求进行。
1.2.2 临床病史采集 主要采集纳入研究者是否存在有糖尿病、高脂血症病史,并记录临床确诊时间。新诊糖尿病的诊断标准采用1999年WHO推荐的诊断标准[2];新诊高脂血症的诊断标准见参考文献[3]。
1.3 统计学处理 采用SPSS17.0统计软件进行分析,计量资料以±s表示,采用t检验,使用Pearson分析相关性。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组 MMSE评分及FBG、TC、TG、HDL-C、LDL-C水平比较 观察组与对照组 MMSE评分及FBG、TC、TG、LDL-C比较,差异均有统计学意义(P<0.05);高认知组与低认知组FBG、TC、TG、LDL-C比较,差异均有统计学意义(P<0.05);HDL-C在各组间的比较,差异无统计学意义(P>0.05),见表1。
表1 观察组和对照组纳入时FPG、TC、TG、HDL-C、LDL-C水平比较(±s)

表1 观察组和对照组纳入时FPG、TC、TG、HDL-C、LDL-C水平比较(±s)
*P<0.05,与对照组比较;#P<0.05,与低认知组比较。
组别 n MMSE评分(分) FBG(mmol/L) TG(mmol/L) TC(mmol/L) HDL-C(mmol/L) LDL-C(mmol/L)观察组 145 17.83±4.24* 6.13±1.45* 1.73±1.33* 5.41±1.43* 1.31±0.38 3.26±0.74*低认知组 64 14.77±3.18 6.41±1.73 2.16±0.63 5.72±1.42 1.24±0.32 3.50±0.81高认知组 81 20.25±2.16# 5.91±1.28# 1.39±0.91# 5.16±2.13# 1.36±0.41 3.07±0.65#对照组 100 28.39±1.26 5.26±0.51 1.22±0.69 4.86±2.57 1.33±0.68*2.63±0.91
2.2 各组糖尿病、高脂血症病例检出率比较 观察组共检出糖尿病67例(46.21%),高脂血症73例(50.35%),对照组检出糖尿病病例19例(19.00%),高脂血症28例(28.00%),观察组糖尿病检出率、高脂血症检出率与对照组比较,差异均有统计学意义(P<0.05);高认知组糖尿病检出31例(38.27%),高脂血症检出33例(40.74%),低认知组糖尿病检出36例(56.25%),高脂血症检出40例(62.50%),高认知组糖尿病检出率、高脂血症检出率与低认知组比较,差异均有统计学意义(P<0.05),见表2。
2.3 各组确诊糖尿病、高脂血症者相关疾病病程与MMSE评分比较 观察组中糖尿病、高脂血症病例的病程及MMSE评分与对照组同类病例相同指标比较,差异均有统计学意义(P<0.05);高认知组中糖尿病、高脂血症病例的病程及MMSE评分与低认知组中同类病例相同指标比较,差异均有统计学意义(P<0.05),见表3。

表2 各组糖尿病、高脂血症病例检出率比较[n(%)]
表3 各确诊糖尿病、高脂血症者相关疾病病程与MMSE评分比较(±s)
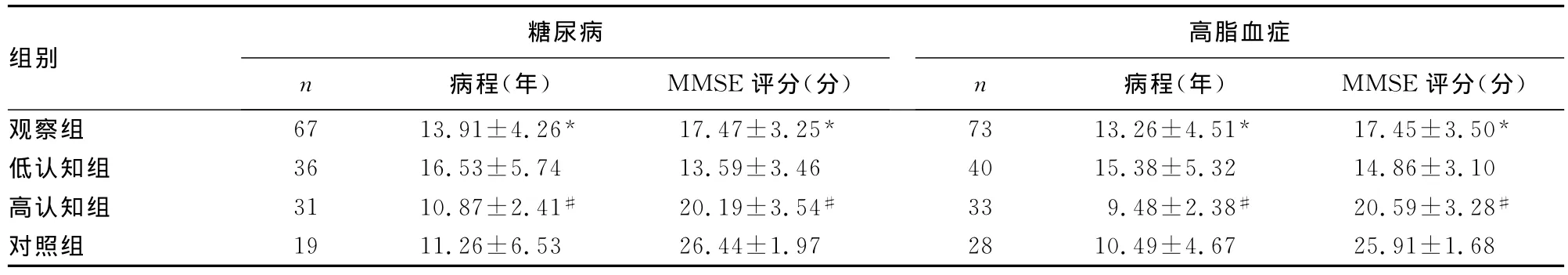
表3 各确诊糖尿病、高脂血症者相关疾病病程与MMSE评分比较(±s)
*:P<0.05与对照组比较;#:P<0.05,与低认知组比较。
组别糖尿病n 病程(年) MMSE评分(分)高脂血症n 病程(年) MMSE评分(分)观察组 67 13.91±4.26* 17.47±3.25* 73 13.26±4.51* 17.45±3.50*低认知组 36 16.53±5.74 13.59±3.46 40 15.38±5.32 14.86±3.10高认知组 31 10.87±2.41# 20.19±3.54# 33 9.48±2.38# 20.59±3.28#对照组 19 11.26±6.53 26.44±1.97 28 10.49±4.67 25.91±1.68
3 讨 论
老年痴呆以进行性加重的认知障碍、记忆减退及人格改变为主要临床特征[4],其病理机制主要是脑细胞外的β淀粉样蛋白(Aβ)沉积、老年斑块形成和脑神经细胞内的纤维缠结[5-6],而前者与血糖、血脂异常存在密切的关系。脑血管疾病是老年痴呆的危险因素,近年的研究发现[7]脑血管疾病不单是血管性痴呆的主要病因,其在阿尔茨海默病发生过程中也起到了重要的作用,尤其是与脑血管疾病密切相关的血脂、血糖异常更是起到了重要作用,不断有新的研究[8]证实阿尔茨海默病与血糖、血脂异常存在相关性。临床上,老年痴呆基本分为血管性痴呆和阿尔茨海默病两型,这足以体现老年痴呆与血糖、血脂异常的密切关系。
从宏观而言,血糖、血脂异常诱发脑血管疾病。随着斑块的脱落或阻塞血管,造成脑梗死区及斑块区局部炎症、血管内皮功能损伤、脂质沉积等,这一系列因素是老年性痴呆进展的病理基础[9]。而从微观来看,脂质会促进Aβ分泌,而Aβ沉积形成斑块是老年痴呆的主要病理机制,而此处所言的脂质与血清中胆固醇密切相关;有研究[10]显示,当降低胆固醇后Aβ的前体蛋白(APP)被大量内吞噬进细胞分解,可减少Aβ的细胞外存在。从这两方面可见,老年痴呆与血脂存在密切关系。血脂与血糖的关系目前已很明了,糖尿病与高脂血症有着共同的病理基础,均有胰岛素抵抗[11],临床上半数糖尿病患者合并高脂血症,糖与脂类的代谢关系也无需多言。即使在健康老年人群中,血糖的正常波动也影响着血脂,有研究显示,健康老年人血糖与TG呈正相关,与HDL-C呈负相关,由此可见控制血糖有助于调节血脂,而无论血脂是否达到病态水平[12-13]。
虽然血脑屏障阻止了血脂自由进入脑部,且脑内存在着独立合成脂类的途径,但血清脂类水平还是对脑部脂类水平有一定的影响,有研究[14]从他汀类药物使用后痴呆发病率降低推测血脂降低会影响脑内脂类的代谢,并以此证明脑内脂类水平与血脂水平呈正相关。糖尿病患者痴呆发病率的高不应只是单纯血糖异常导致痴呆的发生,血糖进入脑部远较血脂容易,脑部血糖高水平下局部糖代谢紊乱引起的脂代谢紊乱对脑神经的损伤更应受到重视,但受制于目前的研究水平,很难对脑组织内高水平葡萄糖对脂类代谢的影响进行直接测定,但从已有的文献[15-16]来看这种不利影响是存在的。血糖、血脂水平越异常,脑部脂类代谢受到的影响越大,则对认知的损伤越为严重。本研究中,观察组与对照组血糖、血脂水平的不同证明了痴呆发生与这二者有密切关系,而观察组糖尿病、高脂血症的发生率显著高于对照组,以及低认知组上述两种疾病的发生率显著高于高认知组也可推测出血糖、血脂异常加大了发生老年痴呆的风险。痴呆的发生、发展是长期的过程,在这个发病过程中很难做到对血糖、血脂指标的长期追踪监测,但本研究分析高认知组和低认知组中糖尿病、高脂血症病例的病程可见,前者的病程均较短,由此可以做出如下推论,即血糖、血脂异常病程与痴呆的严重程度具有相关性。当然本研究的结论并不认同糖尿病、高脂血症患者随着病程的延长必然发生老年痴呆,这一点从对照组的相关数据分析可以看出,与研究结论并不冲突。
从本研究的结果来看,血糖、血脂升高与老年痴呆的关系密切,前者为因后者为果,接近主流观点,但正如前言所述,目前仍有不同的研究结果,如卢艳慧等[4]研究认为糖尿病患者夜间低血糖会增加老年痴呆的发生风险,这主要考虑与脑供能不足导致脑细胞凋亡有关。那么到底是高血糖导致痴呆的危险性大,还是低血糖导致痴呆的风险更高呢,本研究未对夜间血糖进行监测而系统监测了空腹血糖,立足于此得到的结论倾向于支持前者。再如黄常洪等[6]研究认为老年痴呆患者与健康对照组比较血脂各指标诸如 TC、TG、LDL-C、HDL-C均明显降低(P<0.05),他认为老年痴呆患者因代谢水平降低导致了血脂水平也相应下降,这似乎也有一定的道理,但这不单与本研究中老年痴呆者血脂升高有异,且血脂异常与老年痴呆之间的因果关系也完全颠倒了。消弭这些分歧需要继续深入研究,并且在继续深入研究的过程中可进一步拓展研究血糖、血脂异常程度是否与痴呆的程度具有相关性,这需要长期的监测这些指标方可。
综上所述,血糖、血脂异常与老年痴呆的发生关系密切,且糖、脂异常持续时间越长认知损伤越严重。研究结果提示临床控制血糖、血脂异常对预防老年痴呆的发生有重要意义,糖尿病、高脂血症患者更应重视这一点。
[1]韩玮,刘厚林.老年轻度认知功能障碍血脂及血浆同型半胱氨酸水平的临床研究[J].按摩与康复医学,2013,4(9):13-14.
[2]Montalto G,Cervello M,Giannitrapani L,et al.Risk factors and natural history of hepatocellular carcinoma epidemiology[J].Ann N Y Acad Sci,2002(963):13-20.
[3]田华.高脂血症[J].河北中医,2009,31(4):638-640.
[4]卢艳慧,陆菊明,王淑玉,等.老年人群代谢异常与认知功能的相关性研究[J].中华老年心脑血管病杂志,2011,13(12):1073-1075.
[5]Ansado J,Collins L,Joubert S,et al.Interhemispheric coupling improves the brain′s ability to perform low cognitive demand tasks in Alzheimer′s disease and high cognitive demand tasks in normal aging[J].Neuropsychology,2013,27(4):464-480.
[6]黄常洪,李光清,唐珂,等.老年痴呆患者的血脂水平分析[J].检验医学与临床,2011,8(16):1925-1926.
[7]刘震宇.老年痴呆患者认知状况与血糖、血脂含量的相关性[J].中国老年学杂志,2014,34(4):1046-1047.
[8]Li F,Wang F,Jia J.Evaluating the prevalence of dementia in hospitalized older adults and effects of comorbid dementia on patients hospital course[J].Aging Clin Exp Res,2013,25(12):393-401.
[9]朱红莲,潘志红,王根发,等.轻度认知功能障碍患者血脂代谢的变化[J].上海交通大学学报:医学版,2008,28(5):516-517.
[10]Raditsis AV,Milojevic J,Melacini G.Aβassociation inhibition by transFerrin[J].Biophys J,2013,105(2):473-480.
[11]黄德弘,刘孟渊.阿尔茨海默病和血管性痴呆患者血脂、血糖及尿酸水平的变化[J].广东医学,2013,34(4):587-589.
[12]敖忠梅.老年人健康体检血糖与血脂关系的研究[J].中国继续医学教育,2014,6(1):42.
[13]陈敏,班永宏.成人空腹血糖与血脂及血尿酸的关系[J].中国慢性病预防与控制,2010,18(6):593-594.
[14]Wilcock DM,Griffin WS.Down′s syndrome,neuroinflamm,and Alzheimer neuropathogenesis[J].J Neuroinflammation,2013,10(6):84-87.
[15]Szoeke C,Rowe C,Villemagne VL,et al.The association of Aβ amyloid and composite cognitive measures in healthy older adults and MCI[J].Int Psychogeriatr,2013,18(7):1-11.
[16]Zhao LN,Mu Y,Chew LY.Heme prevents amyloid beta peptide aggregation through hydrophobic interaction based on molecular dynamics simulation[J].Phys Chem Phys,2013,15(33):14098-14106.

