CCR5 在慢性乙型肝炎中的研究进展①
乔 兵 孙学华 张 鑫 周振华 李 曼 高月求
(上海中医药大学附属曙光医院,上海市中医临床重点实验室,上海 201203)
趋化因子受体5(CCR5)是一类趋化因子受体,它之所以现在受到世界医学界的日益关注,主要由于十几年前它作为HIV 的辅助受体之一[1],CCR5基因编码区32 bp 片段的缺失(即CCR5Δ32)导致其不表达在T 细胞表面,从而能够阻止HIV 感染[2]。研究发现CCR5 作为一个免疫反应的调节因子受体主要通过调节炎症[3],调整免疫细胞的运动及其功能而发挥重要作用[4-8]。CCR5 及其配体能够吸引效应T 细胞进入肝脏并且调节炎性细胞分泌的炎性细胞因子如IFN-γ 和细胞表面分子FasL等,这就为研究T 细胞介导的肝脏炎症性疾病,如自身免疫性肝炎(AIH)以及HCV、HBV 等引起的病毒性肝病提供了可能的治疗靶点和方向[9,10]。本文主要针对CCR5 在慢乙肝研究领域中的一些研究进展进行阐述。
1 CCR5 趋化因子受体及其配体
趋化因子是一类具有相似分子结构的细胞因子超家族,根据N 端保守序列的前2 半胱氨酸残基的排列分布状况,分为4 类:C、CC、CXC、CX3C[11]。趋化因子通过趋化因子受体介导而促使免疫细胞的迁徙和募集,激活调节炎症反应的作用。趋化因子受体属于七次跨膜蛋白偶联受体超家族,其中CCR5属于CC 族趋化因子受体家族。
人类的CCR5 基因位于3p21.31,与另4 个趋化因子受体CCR1、CCR2a、CCR2b、CCR3 的编码基因共同位于3p 区域(如图1)。其编码的蛋白是1 个含有352 个氨基酸的跨膜蛋白,分子量为40.6 kD(CCR5 的结构如图2)。CCR5 主要表达于NKT 细胞、CD4+T 细胞、CD8+T 细胞以及巨噬细胞及树突状细胞(DC)等免疫细胞[4-8],它的主要配体有CCL3/MIP-1α、CCL4/MIP-1β 以 及CCL5/RANTES等[12],在炎症反应中主要调节Th1类免疫反应[8,13,14]。
2 CCR5 的信号传导通路
CCR5 作为7 次跨膜蛋白,其主要信号传导通路有GPCR 经典信号通路:当CCR5 与相应配体结合后异源三聚体Gap 蛋白被激活,形成ATP-Gα 复合物并与亚单位分离,Gaα 亚基激活磷脂酶C(PLC),水解4,5-二磷酸脂肌醇,产生第二信使1,4,5-三磷酸肌醇(IP3)和二酰甘油(DAG),促使细胞外Ca2+内浸和胞内Ca2+释放。提高钙蛋白对Ca2+的敏感性;Giα 亚基介导上述反应并激活CCR5的末端磷酸化,激活转录因子NF-kB 的P65 亚基并调控基质金属蛋白酶9(MMP-9)转录,同时可以激活磷脂酰肌醇-3-激酶(PI3K),激活后通过磷酸化Akt,IkB 和P65 活化转录因子NF-kB,还可以通过雷帕霉素靶蛋白(mTOR),p70s6k1 和4E-BP1 调控mRNA 的转录和细胞生长[15-17]。CCR5 通过其配体CCL4 结合后介导的相关粘附聚焦酪氨酸激酶(RAFTK)磷酸化,并通过细胞骨架蛋白paxillin激活MAPK 信号转导通路[17,18]。JAK-STAT 信号转导通路,在PMIT 细胞中,CCR5 酪氨酸残基快速磷酸化后,JAK2、JAK3 被激活;在HEK293 细胞中发生JAK1,STAT5 磷酸化;Molt-4,Jurkat T 细胞中,STAT1 同源二聚体及STAT1/ STAT3 异源二聚体形成等[18-20]。
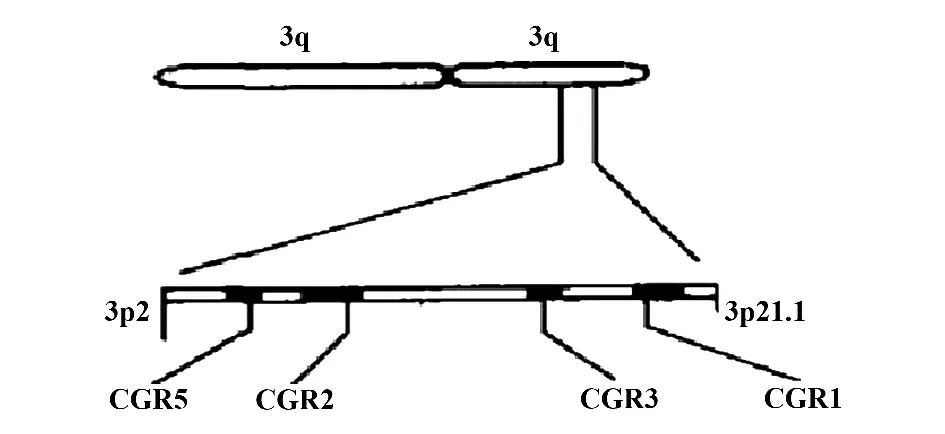
图1 CCR5 在3 号染色体上的分布Fig.1 Distribution of CCR5 on chromosome 3
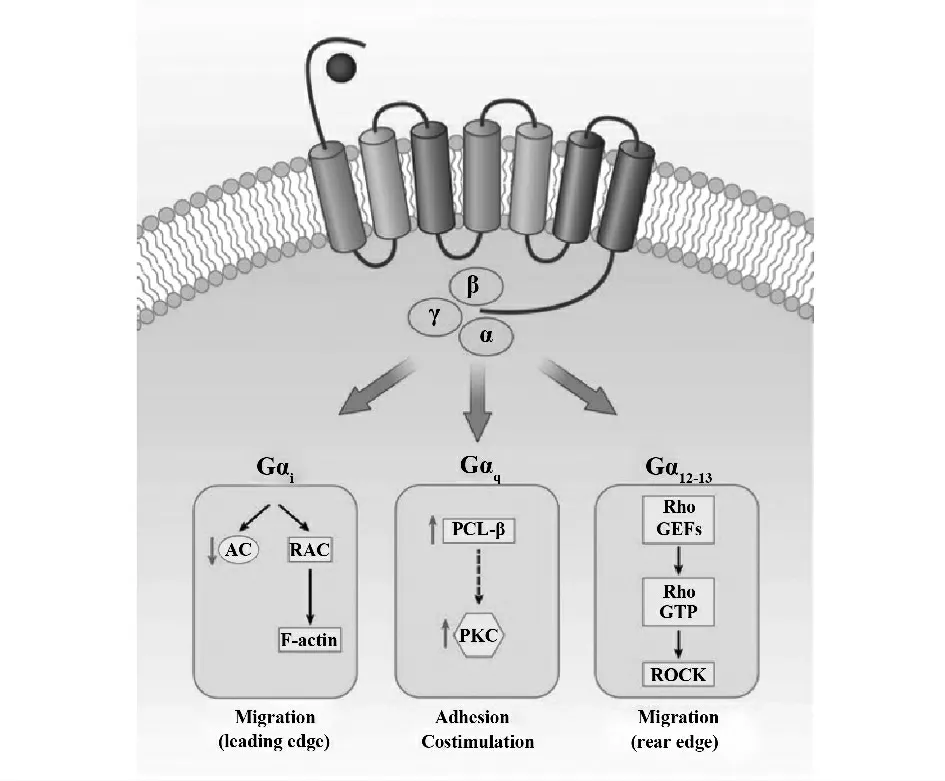
图2 CCR5 分子示意图Fig.2 Schematic representation of molecular CCR5
3 CCR5 与慢性乙型肝炎
HBV 感染导致肝组织中大量炎性细胞聚集,趋化因子及其受体在其中起到了重要的作用。CCR5诱导免疫细胞,主要是T 细胞、NK 细胞、单核巨噬细胞等的趋化,从而调节它们的免疫功能。HBV 引发的慢乙肝(CHB)以Th1 细胞炎性反应为主,而Th1 细胞高表达其受体CCR5 和CXCR3 等[8,21,22]。
Ahmadabadi[23]研究发现伊朗东南部慢乙肝患者外周血CD8+T 细胞上的CCR5 表达明显降低,提示了它们进入肝脏的能力明显降低,肝细胞对HBV病毒的清除作用被打乱。另一项Mirzaee[24]通过观察63 例慢乙肝患者和96 例健康对照组发现在外周血NK 细胞上的CCR5 明显降低,血清RANTES 明显减少。Ahn 等[25]研究发现CCR5 59029G/CCR5 59353T 在乙肝急性期病毒清除中有一定作用。Holst[26]研究发现对于炎症细胞浸润和病毒控制,CCR5 和CXCR3 必不可少,CCR5-/-小鼠T 细胞反应增强,肝脏由CD8+T 细胞介导的免疫反应增强,肝脏微小血管脂肪性变明显增加。同样Moreno[27]研究发现ConA 小鼠模型中CCR5-/-缺失导致T 细胞介导的炎症增强,导致肝脏中CCR5 配体增多以及单核细胞的浸润,揭示CCR5 能够调节肝脏免疫反应的严重性程度。CCR5 在NK 细胞的增殖和运动中也起着重要作用,研究表明,与野生型C57BL/6J 小鼠相比,CCR5 基因敲除的C57BL/6J 小鼠的NK 细胞的增殖以及运动活化都有明显降低。NK细胞是小鼠先天免疫的重要细胞,在HBV 感染初期对病毒的清除起着重要作用[28]。但也有研究表明ConA 诱导的B6129PE2/J-CCR5KO 的小鼠的肝炎模型中,分泌IFN-γ 的NK 细胞数量增多,肝脏炎症反应严重,当清除NK 细胞或者使用CCR1/CCR5 阻断剂时能够使炎症明显减轻[29]。
CCR5 在ATM(Adipose tissue macrophage)的召集和极化中起着关键性作用,ATM 是肝脏中促炎性因子如TNF-α 和IL-6 的重要来源,并且与炎症和胰岛素抵抗有着潜在联系[30]。
Ajuebor 等[31]研究发现CCL3 基因敲除小鼠在ConA 诱导后,肝脏炎症损伤明显减少,并且在使用CCR1/CCR5 拮抗剂后,肝脏炎症明显减轻,CD4+T细胞数量明显减少,由此可见CCL3 是ConA 诱导的肝脏炎症中一种重要的促炎因子。慰秀清等[32]研究发现,CHB 患者肝组织中CCR5 的配体CCL5 的表达量明显高于正常肝组织,在炎性反应严重的区域中更为明显。CHB 患者肝脏炎症局部及血清中TNF-α 增高,TNF-α 能够增强HepG2 的CCL5 表达,因此TNF-α 诱导的CCL5 表达增高可能是其参与肝脏炎症反应的途径之一[33]。因此阻断CCL5 及其受体CCR1,CCR3 和CCR5 能够明显减轻慢性炎症和纤维化,减少肿瘤发生[34]。
4 CCR5 与肝纤维化及肝细胞癌
4.1 CCR5 与肝纤维化 众所周知,肝纤维化及肝硬化起源于肝脏内的慢性炎症,其中心环节就是HSC 细胞的增殖和活化,CCR5 及其配体通过调节不同免疫细胞的浸润及活化,来参与肝脏肝纤维化的形成及消除[35],Zimmermann[36]对226 例慢性肝病患者及184 例正常对照者研究发现当肝脏慢性炎症时,大量非典型CD14+CD16+单核巨噬细胞高表达CCR1+CCR2+CCR5+浸润肝脏,引起肝脏持续炎症及HSC 细胞活化。Seki 等[36]研究发现在慢性肝纤维化患者肝脏中CCL5、CCR1 及CCR5 的表达明显增加,CCR5 主要通过氧化还原及PI3K 途径促进HSC 细胞迁徙,当使用35K(一种广谱的CCR 族抑制剂)时,肝脏的纤维化程度明显减轻。另一项研究发现MET-CCL5(一种CCL5 受体拮抗剂)能够有效减轻肝纤维化程度[38]。
4.2 CCR5 与肝细胞癌 由于CCR5 及其配体在免疫细胞的粘附以及内皮迁移方面有着重要作用,有研究显示,肿瘤组织中趋化因子(CCL2、CCL3、CCL4、CCL5)及其受体(CCR5 及CXCR3)的表达增高,并且对HepG2 细胞系的研究进一步证实,并发现这些可能跟IFN-γ 相关[39,40]。另一项研究也显示CCR5 在基于持续炎症导致的肝细胞癌的发生过程中起着关键性的作用[41]。Iida 等[42]研究表明CCR1 和CCR5 及其配体CCL3 在肿瘤内树突状细胞的聚集和由自杀基因调控的肿瘤免疫诱导的肿瘤细胞凋亡有相当重要的作用。Tsai[43]研究证实CCL5 基因多态性(CCL5-28,CCL5-403)和CCR5 基因多态性及其协同作用能够增加肝细胞癌的易感性。
5 CCR5 分子拮抗剂
5.1 CCR5 分子拮抗剂 CCR5 在炎症、肿瘤、自身免疫病中的重要作用,使的其及其配体的拮抗剂研究成为国内外研究的热点[44,45]。针对CCR5 的拮抗剂可分为以下四类:①CCR5 的天然配体及其修饰产物,如NNY-RANTES,氨羟戊烷-RANTES、HCC-1、vMIP-2 等;②单克隆抗体,如PRO140、mAb004、2D7等;③肽类化合物,如T20、Peptide T、V1 等;④小分子CCR5 拮抗剂,如Maraviroc、Vicriroc、GW873140/AK-220、TAK-220、TAK-52 等,小分子CCR5 拮抗剂具有易于合成,成本低,口服利用度好等优点[46-48]。
马拉维罗(maraviroc)是唯一一个FDA 批准上市的一类CCR5 拮抗剂类药物[49-52],可与其他种类抗逆转录药物联用,用于治疗CCR5-tropic HIV-1 阳性、且对HIV 药物耐药的成年HIV 患者[53-56]。近来研究表明马拉维罗能降低肝细胞癌小鼠的死亡率,肝纤维化程度,主要是通过减少炎性细胞因子的释放,减少细胞坏死等,并且能够通过P38 和ERK 通路,抑制HSC 的活化[57,58];还能够减轻非酒精性脂肪性肝病模型小鼠肝内脂肪沉积,减轻体重,降低肝脏甘油三酯的量[59]。
5.2 CCR5 拮抗剂的副作用 由于CCR 类受体在体内广泛存在,且与多种配体间的相互作用介导炎症反应及影响免疫细胞的功能等的作用,使得趋化因子受体拮抗剂的使用范围受到一定限制,并承受一定的风险。进入一期临床的aplaviroc 被报道一些患者出现了肝毒性,而小剂量的vicriviroc 不能达到预期的治疗效果且部分患者患上了淋巴瘤[60],因此作为唯一上市的CCR5 类拮抗剂maraviroc 并不推荐作为治疗HIV 的一线药物[61]。
6 展望
随着对CCR5 及其配体的研究深入,人们对CCR5 在慢乙肝的发生发展过程中的作用的认识越来越多,趋化因子及其受体在人体免疫反应的作用是广泛而又复杂的,具有重要治疗前景的CCR5 及其配体作为治疗慢乙肝药物的靶点是现在国内外慢乙肝研究领域的热点,怎样充分利用其阻断剂在免疫反应中积极作用,减少因为阻断它而带来副反应将是下一步研究的重点。
[1]Locati M,Murphy PM.Chemokines and chemokine receptors:biology and clinical relevance in inflammation and AIDS[J].Annual Rev Med,1999,50:425-440.
[2]Alkhatib G,Combadiere C,Broder CC,et al.CC CKR5:a Rantes,MIP-1alpha,MIP-1beta receptor as a fusion cofactor for macrophage-tropic HIV-1[J].Sci,1996,272(5270):1955-1958.
[3]Sshroder C,Pierson RN,3RD,Nguyen BN,et al.CCR5 blockade modulates inflammation and alloimmunity in primates[J].J Immunol,2007,179(4):2289-2299.
[4]Charo IF,Ransohoff RM.The many roles of chemokines and chemokine receptors in inflammation[J].New Engl J Med,2006,354(6):610-621.
[5]Ajubor MN,Swain MG.Role of chemokines and chemokine receptors in the gastrointestinal tract[J].Immunology,2002,105(2):137-143.
[6]Zlotnik A,Yoshie O.Chemokines:a new classification system and their role in immunity[J].Immunity,2000,12(2):121-127.
[7]Ajuebor MN,Aspinall AI,Zhou F,et al.Lack of chemokine receptor CCR5 promotes murine fulminant liver failure by preventing the apoptosis of activated CD1d-restricted NKT cells[J].J Immunol,2005,174(12):8027-8037.
[8]Loetscher P,Uguccioni M,Bordoli L,et al.CCR5 is characteristic of Th1 lymphocytes[J].Nature,1998,391(6665):344-345.
[9]Dela Tribonniere X,Yazdanpanah Y,Reynes J.CCR5 antagonists:a new class of antiretrovirals[J].Med Maladies Infect,2008,38(Suppl 1):S1-S6.
[10]Ness TL,Kunkel SL,Hogaboam CM.CCR5 antagonists:the answer to inflammatory disease?[J].Expert Opinion on Therapeutic Patents,2006,16(8):1051-1065.
[11]Kakinuma T,Hwang ST.Chemokines,chemokine receptors,and cancer metastasis[J].J Leuko Biol,2006,79(4):639-651.
[12]Samson M,Labbe O,Mollereau C,et al.Molecular cloning and functional expression of a new human CC-chemokine receptor gene[J].Biochemistry,1996,35(11):3362-337.
[13]Shields PL,Morland CM,Salmon M,et al.Chemokine and chemokine receptor interactions provide a mechanism for selective T cell recruitment to specific liver compartments within hepatitis C-infected liver[J].J Immunol,1999,163(11):6236-6243.
[14]Nanki T,Lipsky PE.Lack of correlation between chemokine receptor and T(h)1/T(h)2 cytokine expression by individual memory T cells[J].Inter Immunol,2000,12(12):1659-1667.
[15]Chuang JY,Yang WH,Chen HT,et al.CCL5/CCR5 axis promotes the motility of human oral cancer cells[J].J Cell Physi,2009,220(2):418-426.
[16]Huang CY,Fong YC,Lee CY,et al.CCL5 increases lung cancer migration via PI3K,Akt and NF-kappaB pathways[J].Bioche Pharmacol,2009,77(5):794-803.
[17]Murooka TT,Rahbar R,Fish EN.CCL5 promotes proliferation of MCF-7 cells through mTOR-dependent mRNA translation[J].Biochem Biophysic Res Commu,2009,387(2):381-386.
[18]Mellado M,Deana AM,Moreno MC,et al.A potential immune escape mechanism by melanoma cells through the activation of chemokine-induced T cell death[J].Cur Biol:CB,2001,11(9):691-696.
[19]Wong M,Uddin S,Majchrzak B,et al.Rantes activates Jak2 and Jak3 to regulate engagement of multiple signaling pathways in T cells[J].J Biol Chem,2001,276(14):11427-11431.
[20]Wong M,Fish EN.RANTES and MIP-1alpha activate stats in T cells[J].J Biol Chemi,1998,273(1):309-314.
[21]Qin S,Rottman JB,Myers P,et al.The chemokine receptors CXCR3 and CCR5 mark subsets of T cells associated with certain inflammatory reactions[J].J Clin Invest,1998,101(4):746-754.
[22]Bonecchi R,Bianchi G,Bordignon PP,et al.Differential expression of chemokine receptors and chemotactic responsiveness of type 1 T helper cells (Th1s)and Th2s[J].J Exp Med,1998,187(1):129-134.
[23]Ahmadabadi BN,Hassanshahi G,Khoramdelazad H,et al.Downregulation of CCR5 expression on the peripheral blood CD8+T cells of southeastern Iranian patients with chronic hepatitis B infection[J].Inflammation,2013,36(1):136-140.
[24]Mirzaee V,Shahriari J,Hajghani M.CCR5 on the NK cells and its ligand (RANTES)expressions are disrupted in south-eastern iranian patients with chronic hepatitis B infection[J].Iranian Red Crescent Med J,2014,16(4):e12458.
[25]Ahn SH,Kimdo Y,Chang HY,et al.Association of genetic variations in CCR5 and its ligand,RANTES with clearance of hepatitis B virus in Korea[J].J Med Virol,2006,78(12):1564-1571.
[26]Holst PJ,Orskov C,Qvortrup K,et al.CCR5 and CXCR3 are dispensable for liver infiltration,but CCR5 protects against virus-induced T-cell-mediated hepatic steatosis[J].J Virol,2007,81(18):10101-12.
[27]Moreno C,Gustot T,Nicaise C,et al.CCR5 deficiency exacerbates T-cell-mediated hepatitis in mice[J].Hepology,2005,42(4):854-862.
[28]Weiss ID,Shoham H,Wald O,et al.Ccr5 deficiency regulates the proliferation and trafficking of natural killer cells under physiological conditions[J].Cytokine,2011,54(3):249-257.
[29]Ajuebor MN,Wondimu Z,Hogaboam CM,et al.CCR5 deficiency drives enhanced natural killer cell trafficking to and activation within the liver in murine T cell-mediated hepatitis[J].Am J Pathol,2007,170(6):1975-1988.
[30]Kitade H,Sawamoto K,Nagashimada M,et al.CCR5 plays a critical role in obesity-induced adipose tissue inflammation and insulin resistance by regulating both macrophage recruitment and M1/M2 status[J].Diabetes,2012,61(7):1680-1690.
[31]Ajuebor MN,Hogaboam CM,Le T,et al.CCL3/MIP-1alpha is pro-inflammatory in murine T cell-mediated hepatitis by recruiting CCR1-expressing CD4(+)T cells to the liver[J].Eur J Immunol,2004,34(10):2907-918.
[32]尉秀清,文卓夫,郑丰平.CC 类趋化因子配体5 水平与慢性乙型病毒性肝脏炎症程度的关系-附64 例检测分析[J].新医学,2006,37(4):123-125
[33]Kiki I,Yilmaz O,Erdem F,et al.Tumour necrosis factor-alpha levels in hepatitis B virus-related chronic active hepatitis and liver cirrhosis and its relationship to Knodell and Child-Pugh scores[J].Inter J Clin Prac,2006,60(9):1075-1079.
[34]Marques RE,Guabiraba R,Russo RC,et al.Targeting CCL5 in inflammation[J].Exp Opion Ther Targets,2013,17 (12):1439-14360.
[35]Karlmark KR,Wasmuth HE,Trautwein C,et al.Chemokine-directed immune cell infiltration in acute and chronic liver disease[J].Expert Rev Gastro Hepatol,2008,2(2):233-242.
[36]Zimmermann HW,Seidler S,Nattermann J,et al.Functional contribution of elevated circulating and hepatic non-classical CD14CD16 monocytes to inflammation and human liver fibrosis[J].PloS One,2010,5(6):e11049.
[37]Seki E,DE Minicis S,Gwak GY,et al.CCR1 and CCR5 promote hepatic fibrosis in mice[J].J Clin Invest,2009,119 (7):1858-1870.
[38]Berres ML,Koenen RR,Rueland A,et al.Antagonism of the chemokine Ccl5 ameliorates experimental liver fibrosis in mice[J].J Clin Investi,2010,120(11):4129-4140.
[39]Yoong KF,Afford SC,Jones R,et al.Expression and function of CXC and CC chemokines in human malignant liver tumors:a role for human monokine induced by gamma-interferon in lymphocyte recruitment to hepatocellular carcinoma[J].Hepatology,1999,30(1):100-111.
[40]Liu Y,Poon RT,Hughes J,et al.Chemokine receptors support infiltration of lymphocyte subpopulations in human hepatocellular carcinoma[J].Clin Immunol,2005,114(2):174-182.
[41]Barashi N,Weiss ID,Wald O,et al.Inflammation-induced hepatocellular carcinoma is dependent on CCR5 in mice[J].Hepology,2013,58(3):1021-1030.
[42]Iida N,Nakamoto Y,Baba T,et al.Tumor cell apoptosis induces tumor-specific immunity in a CC chemokine receptor 1-and 5-dependent manner in mice[J].J Leuk Biol,2008,84 (4):1001-1010.
[43]Tsai HT,Yang SF,Chen DR,et al.CCL5-28,CCL5-403,and CCR5 genetic polymorphisms and their synergic effect with alcohol and tobacco consumptions increase susceptibility to hepatocellular carcinoma[J].Med Onco,2012,29(4):2771-2779.
[44]Boesecke C,Pett SL.Clinical studies with chemokine receptor-5(CCR5)-inhibitors[J].Cur Op in HIV and AIDS,2012,7(5):456-462.
[45]Zimmermann HW,Tacke F.Modification of chemokine pathways and immune cell infiltration as a novel therapeutic approach in liver inflammation and fibrosis[J].Inflam & Allergy Drug Targets,2011,10(6):509-536.
[46]Heredia A,Latinovic O,Gallo RC,et al.Reduction of CCR5 with low-dose rapamycin enhances the antiviral activity of vicriviroc against both sensitive and drug-resistant HIV-1[J].Proc Nat Acad Sci USA,2008,105(51):20476-20481.
[47]Lenz JC,Rockstros JK.Vicriviroc,a new CC-chemokine receptor 5 inhibitor for treatment of HIV:properties,promises and challenges[J].Exp Opi on Drug Meta & Toxicol,2010,6 (9):1139-1150.
[48]Klibanov OM.Vicriviroc,a CCR5 receptor antagonist for the potential treatment of HIV infection[J].Cur Opi Investi Drugs,2009,10(8):845-859.
[49]Proudfoot AE,Power CA,Schwarz MK.Anti-chemokine small molecule drugs:a promising future?[J].Expert Opin Investig Drugs,2010,19(3):345-355.
[50]Alcami J.Conclusionsand perspectives.Maraviroc[J].Enferm Infecc Microbi Clin,2008,26(Suppl 11):49-54.
[51]Troia-Cancio P,Asmuth DM.Lessons from maraviroc clinical trials[J].Exp Review Anti-infective Ther,2011,9(6):649-651.
[52]Leal M,Camacho A,Genebat M,et al.At what time and with which combinations should maraviroc be indicated in the new antiretroviral treatment scenario?[J].Enferm Infec Microbio Clin,2008,26(Suppl 11):34-39.
[53]Moreno S,Hernandez B,Gutierrez C,et al.Maraviroc efficacy in clinical studies on the development of the molecule[J].Enferm Infec Microbio Clin,2008,26(Suppl 11):17-22.
[54]Chidiac C,Katlama C,Yeni P.Maraviroc:clinical trials results[J].Med Malad Infect,2008,38(Suppl 1):S17-S23.
[55]Emmelkamp JM,Rockstroh JK.Maraviroc,risks and benefits:a review of the clinical literature[J].Exp Opi Drug Safety,2008,7(5):559-569.
[56]Lieberman-Blum SS,Fung HB,Bandres JC.Maraviroc:a CCR5-receptor antagonist for the treatment of HIV-1 infection[J].Clin Ther,2008,30(7):1228-1250.
[57]Ochoa-Callejero L,Perez-Martinez L,Rubio-Mediavilla S,et al.Maraviroc,a CCR5 antagonist,prevents development of hepatocellular carcinoma in a mouse model[J].PloS One,2013,8(1):e53992.
[58]Westrop SJ,Moyle G,Jackson A,et al.CCR5 antagonism impacts vaccination response and immune profile in HIV-1 infection[J].Mole Med,2012,18:1240-12408.
[59]Perez-Martinez L,Perez-Matute P,Aguilera-Lizarraga J,et al.Maraviroc,a CCR5 antagonist,ameliorates the development of hepatic steatosis in a mouse model of non-alcoholic fatty liver disease(NAFLD)[J].J Antimicrob Chemother,2014,69 (7):1903-1910.
[60]Emmelkamp JM,Rockstroh JK.CCR5 antagonists:comparison of efficacy,side effects,pharmacokinetics and interactions-review of the literature[J].Eur J Med Res,2007,12(9):409-417.
[61]Maraviroc first-line therapy for HIV infection.Too risky[J].Prescrire Int,2010,19(110):252-254.