结膜上皮细胞在角膜基质中转化为角膜上皮样细胞的研究
程建霞 徐海涛 左 兰 黄鑫宇 杜园园 (吉林大学第二医院 眼眶眼整形科,长春 130000)
结膜和角膜上皮细胞来源于不同的细胞系,正常情况下,分化成熟的结膜和角膜上皮细胞表达不同的角蛋白,即角膜上皮细胞表达CK3/CK12 蛋白,而结膜上皮细胞表达CK4/CK13 蛋白。而且,Ck12和Ck13 分别代表终末分化的角膜和结膜上皮细胞,角膜缘干细胞或早期发育角膜细胞不表达CK4和CK13 蛋白[1]。
眼表上皮细胞分化除由其干细胞系所决定外,是否会受到其下基质环境的影响,即成体干细胞是否具有可塑性分化潜能,目前说法不一。如文献报道,将成年鼠角膜上皮细胞与胚胎鼠生发真皮共培养后,角膜上皮细胞发生转分化,产生毛囊和皮脂腺样结构[2]。也有研究者证实,当结膜上皮细胞生长覆盖在角膜基质表面,虽然可观察到表现出不同程度的角膜上皮细胞形态学特点,但并不产生Ck12蛋白表达[3]。同样,当结膜上皮细胞与角膜基质细胞共培养,可以观察到低水平的Ck3 蛋白表达,但不产生Ck12 蛋白表达[3]。当结膜上皮细胞在人羊膜上培养,同样没有发生角膜上皮样细胞的转化。有学者从结膜上皮细胞中发现少量Ck12 蛋白阳性表达角膜样上皮细胞,所以认为决定细胞命运的是原始细胞来源,而不是其基质环境[4]。
针对上述问题,我们通过检测植入角膜基质中结膜上皮细胞Ck3、Ck12 和Ck4 蛋白表达的改变,研究和检测角膜基质对结膜上皮细胞基因和蛋白表达的影响。
1 材料与方法
1.1 实验试剂 包括1∶ 1 DMEM 和Ham F12 混合液,补充体积分数10% 胎牛血清,10 μg/L 人表皮细胞生长因子(Epidermal growth factor,EGF),5 mg/L 胰岛素,0.5 mg/L 氢化可的松,0.1 nmol/L霍乱毒素,100 ×103U/L 青霉素,100 mg/L 链霉素。鼠单克隆抗体Muc5AC 购自Abcam Ltd (Cambridge,CB4 0FW,UK);FITC-交联羊抗鼠IgG 抗体(A lexa-488-labled;Invitrogen,Carlsbad),CA 鼠单克隆抗体Ck13,Ck4,Ck14,Ck3,Muc5AC;羊单克隆抗体Ck12;FITC-交联羊抗鼠IgG 抗体与驴抗羊IgG 抗体(Alexa-488-labled);DAPI 封 固 剂(Burlingame,CA),OCT 胶(OCT,Leica Instrument GmbH,Germany)。
1.2 实验动物 健康新西兰大白兔20 只,体重2~2.5 kg,将其分为4 个实验组,分别为正常对照组、3 d 动物模型、10 d 动物模型及20 d 动物模型,每组各5 只。
1.3 兔结膜上皮细胞分离及培养 选定的上述新西兰大白兔全身麻醉后,眼局部消毒,摘取双眼上穹窿部结膜上皮组织(5 ×5 mm2),用生理盐水洗涤三次(含100 U/ml 青霉素和100 μg/ml 链霉素),将其切分成1 ×1 mm2大小组织块平贴于培养皿中,加入含10%胎牛血清培养液后放入37℃孵育箱中,隔日换液。日常于倒置显微镜下观察细胞贴壁、伸展及细胞生长情况。组织块培养5~7 d,弃去细胞培养液及结膜组织块,用0.25%Trypsin 消化后离心并收集,放置在冰盒里以备进行下一步自体角膜基质移植用。
1.4 结膜上皮细胞在角膜基质中转化的实验动物模型建立 将实验兔全身麻醉,用刮匙将颞侧半部角膜上皮彻底刮除,用0.9%生理盐水冲洗该部角膜基质,在距角膜缘2~3 mm 的去上皮的角膜基质层作一长2.0 mm 平行于角膜缘深达一半角膜基质的切口,由该切口向角膜中央方向作一扇形板层隧道,将收集的结膜上皮细胞(6 ×105)放入该角膜基质板层隧道中。术毕托百士眼膏涂眼预防感染。每日用裂隙灯显微镜观察角膜情况。
1.5 实验样本采集 实验兔全身麻醉后。将移植有结膜上皮细胞部分的整片角膜组织取下包埋于OCT 胶中,分别进行H&E 染色及免疫荧光染色。拟行PCR 检测的标本则先用刀片彻底刮除角膜上皮细胞、角膜内皮细胞及后弹力膜,用直径2 mm2的环钻切取结膜上皮细胞最密集部位的角膜基质,并立即放入-1 500℃冰箱中保存。
1.6 荧光免疫组化分析 将组织样本切成5 mm厚的超薄组织切片置于载玻片上,室温下放置半小时,待组织切片稍干后分别进行常规H&E 染色及免疫荧光染色。
1.7 Real-time PCR 分析 采用Tq-PCR 检测细胞角蛋白-3、细胞角蛋白-4,波形蛋白基因的表达。应用Trizol 试剂(Invitrogen)从冰冻组织中提取总RNA,cDNA 随机引物采用cDNA 试剂盒(Invitrogen)按说明书准备,采用PRISM 7700 序列和Taq-Man 基因表达试剂盒(Applied Biosystems)应用适当的稀释cDNA 逆转录PCR。引物从AB 公司订购。每次实验均采用无逆转录酶的逆转录反应作为cDNA 的阴性对照,无cDNA 的PCR 作为PCR 反应的阴性对照,β-肌动蛋白作为内参。
2 结果
2.1 兔结膜上皮细胞组织块培养形态及蛋白表达培养第24~48 h,组织块边缘即有结膜上皮细胞爬出,第5~7 天时,细胞铺满培养瓶底,并汇合成单层。这时Ck14 即基底细胞标记蛋白几乎表达于所有的细胞中,而只有部分细胞Ck4 染色呈阳性,并可见少数细胞Ck3 染色阳性细胞。而Ck3 和Ck12在所有培养细胞中染色均呈阴性。这个结果提示,所培养的该阶段细胞为结膜上皮基底细胞。
2.2 植入角膜基质的结膜上皮细胞形态及免疫组化分析 植入术后第2 天角膜上皮高度水肿混浊,第3 天角膜上皮水肿逐渐减退,植入1~2 周时结膜上皮细胞在角膜基质间呈灰白色,清晰可见(图1)。

图1 结膜上皮细胞植入角膜基质后兔眼成像Fig.1 Micrograph of rabbit eye after implantation of cultured conjunctival epithelial cells
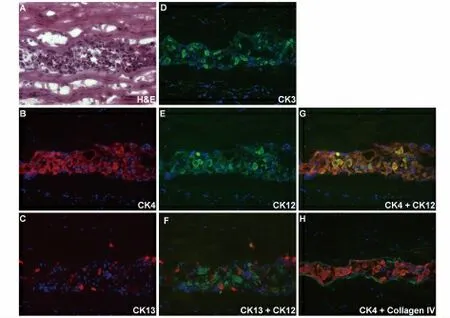
图2 结膜上皮细胞植入第1 阶段细胞形态及免疫荧光结果Fig.2 Immunohistochemical analysis of implanted conjunctival epithelial cells at Phase I
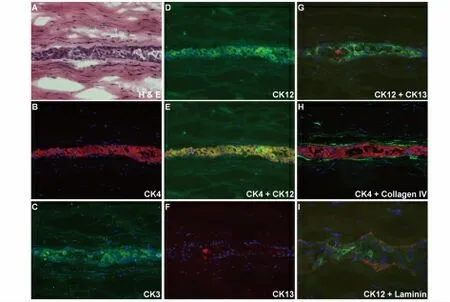
图3 结膜上皮细胞植入第2 阶段细胞形态及免疫荧光结果Fig.3 Immunohistochemical analysis of implanted conjunctival epithelial cells at Phase Ⅱ

图4 结膜上皮细胞植入前后不同阶段Ck3 和Ck4 基因表达结果,β-肌动蛋白作为内参Fig.4 Quantitative PCR analysis of CK3 and CK4 gene expression in conjunctival epithelial cells before and after implantation at different Phases Note:βactin was used as internal control for the calculation of δCt
第1 阶段:结膜上皮细胞在角膜基质内的聚集期H&E 染色结果显示被移植的结膜上皮细胞在角膜基质内聚集在一起,呈不规则排列(图2A)。几乎所有植入的结膜上皮细胞均有Ck4 阳性表达(图2B),少量细胞Ck3 和Ck12 表达阳性(图2D,2E),Ck4/Ck12 双染结果显示,所有Ck12 表达阳性细胞同时也表达Ck4 蛋白(图2G),虽然所培养的结膜上皮细胞无Ck13 表达,但其阳性表达细胞散在分布于所植入的结膜上皮细胞当中,然而Ck12/Ck13双重染色结果显示二者无共表达(图2C)。Ck4 阳性细胞与其周围的角膜基质之间呈现CollagenIV 阳性染色(图2F)。Ck12 阳性细胞周围未见Laminin染色(图2H)
第2 阶段:上皮样结构形成期 结膜上皮细胞植入后1 周至10 d,H&E 染色结果显示植入的结膜上皮细胞排列规则,形成2~3 层细胞层,呈现上皮样结构(3A)。CollagenIV 和Laminin 连续性表达于植入上皮细胞周围(图3H,3I),提示新的基底膜的产生。几乎所有移植细胞均呈现Ck4、Ck3 和Ck12 阳性表达(图3B、3C 和3D);Ck4/Ck12 双重染色结果示二者呈现共表达现象(图3E);Ck13 阳性表达较第1 阶段减少且Ck13 和Ck12 之间无共表达现象(图3F,3G)第3 阶段:细胞衰退期 植入术后3 周,植入的结膜上皮细胞开始退化、死亡,但是残存的细胞仍可被Ck3、Ck12、Ck4 染色,CollagenIV 和Laminin 连续性表达于其周围。
2.3 角蛋白基因表达的定量分析 定量PCR 检测结果显示,3 个阶段中所有植入细胞CK3 和Ck4 基因表达均呈阳性。将α-actin 作为内部控制,计算植入角膜基质的结膜上皮细胞CK3 和Ck4 基因转录并与培养的结膜上皮细胞进行比较(图4)。在植入第1 阶段,与植入前培养的结膜上皮细胞比较,Ck4基因表达降低而Ck3 基因表达则升高;植入第2 阶段,角膜基质中的结膜上皮细胞Ck4 基因表达逐渐下降,而Ck3 基因表达略有上升;而植入第3 阶段因许多植入细胞开始衰退,Ck3 基因表达不再增加。
3 讨论
关于上皮细胞分化有两方面问题值得我们关注,即是否上皮细胞的分化是从胚胎期或初生期开始,并呈程序性及不可逆性发展,以及是否这些上皮细胞生长和分化受它们各自的基质所影响。我们将培养的成体兔眼结膜上皮细胞移植入自体角膜板层基质中,结膜上皮细胞分化会一步一步地发生转变,而且这种转变同时伴随着基因表达的改变。
首先,我们证实了结膜上皮细胞可在植入兔角膜基质中形成上皮样结构并存活3 周,植入的结膜上皮细胞可呈现Ck3 和Ck12 阳性表达且随着植入时间延长其阳性表达细胞数量逐渐增加。同时因植入的细胞Ck4 蛋白仍呈阳性表达,说明这些细胞依旧保留结膜上皮细胞特点。因此我们证明植入角膜基质的结膜上皮细胞呈现角、结膜上皮细胞共同特点。
另外,植入角膜基质中结膜上皮细胞Ck3 蛋白表达增加。据文献报道[5],通过Western blot 凝胶电泳显示兔结膜上皮细胞Ck3 可呈低水平表达,当结膜上皮细胞培养在羊膜上时这种Ck3 表达则明显增加[3]。我们实验结果与之次相符,即在培养的兔结膜上皮细胞中可检测到少量Ck3 表达细胞,进而大多数植入角膜基质中7 天后的结膜上皮细胞其Ck3 呈阳性表达。我们没有观察到植入细胞的增殖,所以不支持Ck3 阳性表达细胞增加为初始Ck3阳性细胞分裂增殖而来。另外,PCR 检测结果显示植入角膜基质的结膜上皮细胞Ck3 基因表达较培养的结膜上皮细胞增加,该结果支持植入结膜上皮细胞在角膜基质环境作用下Ck3 表达增加。通过以往文献报道,培养的结膜上皮细胞可检测Ck3 阳性细胞,而Ck12 则检测不到[3,5]。
Kurpakus[6]研究发现,当将牛结膜上皮细胞培养在角膜基底膜上,可出现Ck12 阳性细胞表达。同样,在培养的兔结膜上皮细胞荧光免疫组化染色Ck12 表达完全呈阴性,而绝大多数植入的结膜上皮细胞Ck12 蛋白表达呈阳性,因Ck12 为终末分化的角膜上皮细胞标记物,我们研究证实角膜基质环境可以诱导结膜上皮细胞转化为角膜样上皮细胞。同样与Ck3 和Ck12 表达相似,当结膜上皮细胞植入角膜基质后其Ck4 表达明显下降,但仍持续存在与植入上皮细胞中。在植入第2 阶段,出现CK3/CK12/CK4 蛋白共表达现象,提示植入细胞呈现角、结膜上皮细胞共有特性。
通过实验进一步证实角膜基质通过作用于低分化的结膜上皮细胞使其发生转化。因为培养的结膜上皮细胞通过免疫组化分析证实其Ck14 蛋白表达阳性而Ck13 蛋白表达阴性,符合基底细胞蛋白表达特点[7]。这种培养的结膜上皮细胞角蛋白表达特点可能是因为我们所用培养液更有利于细胞增殖而不是分化。其次,我们没有发现植入的上皮细胞共表达Ck12 和Ck13,提示二者之间不存在共有蛋白表达现象。然而,因我们实验中Ck13 蛋白表达量很少,所以我们可能还需要更多实验进一步证实此观点。此外,由于抗体产品的限制,我们无法检测Ck13 和Ck3 共表达情况,以证实是否成熟的结膜上皮细胞能够在角膜基质诱导下发生转化。
关于上皮细胞在特殊基质环境中转分化及相关机制,以往文献也有报道[8]。如将成人角膜上皮细胞植入到胚胎真皮层中,角膜上皮细胞发生转化并形成上皮和毛囊组织[2]。也有研究者观察到角膜缘干细胞损伤后,覆盖于角膜基质的结膜上皮细胞呈现角膜上皮特点[9]。但也有人反对此观点,认为这些具有角膜样上皮特点的细胞仍来源于残存的角膜缘干细胞[10]。所以,对于角膜基质表面的结膜上皮细胞转化为角膜样上皮细胞目前还没有更理想的角膜重建证据[11]。实际上,这些有关结膜上皮细胞在角膜基质表面生长、分化及转化的动物模型设计很容易受其他因素影响,如新生血管、泪膜和血液携带的炎症因子及暴露的空气,可能会干扰结膜上皮细胞向角膜上皮细胞方向转化的能力。所以我们实验设计排除了这些干扰因素,单纯研究角膜基质单一诱导环境对于结膜上皮细胞转化作用。
以往研究证实,气液交界面是促进结膜上皮细胞分层和分化的关键因素[12]。研究中发现,虽然在植入第2 和第3 阶段结膜上皮细胞周围可以观察到基底膜形成,但植入的结膜上皮细胞在角膜基质中很少增殖和分层。另外,虽然Ck13 在培养的结膜上皮细胞中无表达,但在植入的角膜基质细胞中可减少量表达,考虑因缺乏空气限制了植入上皮细胞的分化和分层。但这种独立的诱导环境同时也排除了细胞转化的干扰因素。
总之,我们的研究结果显示,结膜上皮细胞可以在角膜基质环境诱导下发生横向转化,表达角膜上皮样细胞特点。我们该实验的成功为成体干细胞可塑性研究提供了又一有力证据,显示了用结膜干细胞代替角膜缘干细胞应用于临床的潜在前景,为组织工程化角膜上皮构建提供了更充沛的种子来源。
[1]Chen Z,CS de Paiva,Luo L,et al.Characterization of putative stem cell phenotype in human limbal epithelia[J].Stem Cells,2004,22(3):355-366.
[2]Pearton DJ,Yang Y,Dhouailly D.Transdifferentiation of corneal epithelium into epidermis occurs by means of a multistep process triggered by dermal developmental signals[J].Proc Natl Acad Sci USA,2005,102(10):3714-3719.
[3]Chen WY,Mui MM,Kao WW,et al.Conjunctival epithelial cells do not transdifferentiate in organotypic cultures:expression of K12 keratin is restricted to corneal epithelium[J].Curr Eye Res,1994,13(10):765-778.
[4]Kawasaki S,Tanioka H,Yamasaki K,et al.Clusters of corneal epithelial cells reside ectopically in human conjunctival epithelium[J].Invest Ophthalmol Vis Sci,2006,47(4):1359-1367.
[5]Wei ZG,Wu RL,Lavker RM,et al.In vitro growth and differentiation of rabbit bulbar,fornix,and palpebral conjunctival epithelia.Implications on conjunctival epithelial transdifferentiation and stem cells[J].Invest Ophthalmol Vis Sci,1993,34 (15):1814-1828.
[6]Kurpakus MA,Stock EL,Jones JC.The role of the basement membrane in differential expression of keratin proteins in epithelial cells[J].Dev Biol,1992,150(2):243-255.
[7]Hudson DL.Keratins as markers of epithelial cells[J].Methods Mol Biol,2002,188:157-167.
[8]Lee SP,Savard CE,Kuver R.Gallbladder epithelial cells that engraft in mouse liver can differentiate into hepatocyte-like cells[J].Am J Pathol,2009,174(3):842-853.
[9]Dua HS,Miri A,Alomar T,et al.The role of limbal stem cells in corneal epithelial maintenance:testing the dogma[J].Ophthalmology,2009,116(5):856-863.
[10]Dua HS.The conjunctiva in corneal epithelial wound healing.Br J Ophthalmol,1998,82(12):1407-1411.
[11]Hatch KM,Dana R.The structure and function of the limbal stem cell and the disease states associated with limbal stem cell deficiency[J].Int Ophthalmol Clin,2009,49(1):43-52.
[12]Ang LP,Cheng ZY,Beuerman RW,et al.The development of a serum-free derived bioengineered conjunctival epithelial equivalent using an ultrathin poly(epsilon-caprolactone)membrane substrate[J].Invest Ophthalmol Vis Sci,2006,47(1):105-112.