多巴胺能神经营养因子真核表达、纯化及多克隆抗体制备①
王立正 王子璇 朱 瑞 刘镇天 于 彬 于湘晖 赵兴红
(吉林大学生命科学学院艾滋病疫苗国家工程实验室,长春 130012)
帕金森病(Parkinson's disease,PD)是目前世界上第二大神经退行性疾病,在50 岁以上人群中患病率显著上升[1-3]。PD 最重要的病理特征是黑质致密部多巴能神经元大量减少[4]。神经营养因子是一类能促进神经元生长并对其有保护作用的分泌性蛋白,近年来大多数被证明对多巴胺能神经元具有保护作用,并在动物实验结果中得到证明[5,6]。脑多巴胺能神经营养因子(Cerebral dopamine neurotrophic factor,CDNF)是属于MANF 家族的一类神经营养因子[7],于2007 年由Lindholm 等[8]首次发现,并在动物水平上说明CDNF 蛋白可以保护及修复多巴胺能神经元,具有治疗帕金森病的应用前景。
本研究通过构建真核表达质粒pVR1012-CDNF-his,转染至真核细胞HEK 293T 中进行蛋白表达,收取上清进行镍柱亲和层析纯化,以获得纯度较高的CDNF 蛋白。为方便进一步对CDNF 功能机制及其在帕金森病中的应用进行研究。使用纯化的蛋白免疫动物,制备出特异性较好的多克隆抗体,方便之后研究中CDNF 蛋白的鉴定及发挥生物功能过程中与其他蛋白相互作用探究。
1 材料与方法
1.1 材料 VR1012 载体及pAAV-CDNF 质粒为本实验室保存;SalⅠ限制性内切酶、BamHⅠ限制性内切酶及T4 连接酶购自TaKaRa 公司;CDNF 多抗购自Abcam 公司;Ni-NTA agarose、预染蛋白Marker 及Anti-his 单抗购自Invitrogen 公司;MTT 购自Biosharp 公司;DMEM 细胞培养液及小牛血清白蛋白(FBS)购自Hyclone 公司;NBT、BCIP、AP 标记山羊抗兔IgG 及AP 标记山羊抗鼠IgG 购自鼎国生物科技有限责任公司。
1.2 pVR1012-CDNF-his 构建 使用引物(正向引物:5'-CCTAGCGTCGACATGTGGTGCGCGAGCCC-3';反向引物:5'-GTAATGGATCCTCAATGGTGATGGTGATGATGGAGCTCTGTTTTGGGGTG-3'),以pAA V-CDNF 为模板通过PCR 扩增出带有his 标签碱基序列的CDNF-his 目的片段。具体PCR 程序设置为:98℃下预变性5 min;进入30 个循环的扩增程序:98℃下变性30 s,55℃下退火30 s,72℃下延伸1 min;30 个循环程序结束后72℃再延伸10 min;最后降温至4℃完成PCR。扩增出的目的片段两端带有SalⅠ及BamHⅠ两个限制性内切酶酶切位点。按照酶切、胶回收、连接、转化、挑单克隆、质粒抽提等步骤,构建pVR1012-CDNF-his。
1.3 CDNF 真核表达 预先传代HEK 293T 细胞,待细胞生长至细胞培养瓶底面积的70%~80%时,换成不含FBS 的DMEM 培养基,使用PEI 为转染试剂,将pVR1012-CDNF-his 质粒转入细胞,4~6 h 后换成含10% FBS 的DMEM 培养基,72 h 后收取上清进行纯化。
1.4 CDNF 纯化、SDS-PAGE 检测及Western blot 鉴定 收取的上清过0.45 μm 滤膜后进行镍柱亲和层析,摸索洗脱条件,最终确定使用25、50、70、90 mmol/L 咪唑浓度洗脱液按照从低咪唑浓度到高咪唑浓度对CNDF-his 蛋白梯度洗脱。SDS-PAGE 检测蛋白纯度,考马斯亮蓝染色结果用Quantity one 进行灰度分析,估算目的蛋白纯度。Western blot 对蛋白进行鉴定。
1.5 MTT 法检测CDNF 蛋白生物活性 96 孔板中按照1 ×105个细胞/孔铺PC12 细胞,含2% FBS 的DMEM 培养基培养12 h 后,换成不含FBS 的DMEM培养基,6-OHDA 加入孔中,同时加入CDNF 蛋白使得最终每孔中6-OHDA 浓度为200 μmol/L,CDNF蛋白浓度呈系列梯度,孵育24 h,加入MTT,孵育4 h,酶标仪单波长OD490nm 进行读板。导出数据,分析。
1.6 多克隆抗体制备及鉴定 选取3 月龄健康新西兰大白兔,免疫前取2 ml 血制备血清做阴性对照,-80℃保存。初次免疫使用500 μg 蛋白与弗氏完全佐剂等体积混合液,间隔两周后进行第二次免疫,使用200 μg 蛋白与弗氏不完全佐剂等体积混合液,再间隔三周使用200 μg 蛋白与弗氏不完全佐剂等比混合液进行第三次免疫,1 周后心脏采血制备血清通过Western blot 鉴定多克隆抗体。免疫时注射方法为背部多点注射。采用的血清制备方法为:全血4℃放置过夜,4℃离心机3 000 r/min 离心20 min 后吸取上清至新的离心管,再次4℃离心机3 000 r/min 离心20 min,收取上清即获得血清。
2 结果
2.1 pVR1012-CDNF-his 构建 按照图1 所示设计构建质粒,构建得到质粒进行双酶切鉴定,结果显示成功将目的片段构建入载体。进行测序,结果显示目的片段无突变,完全与预期序列匹配。
2.2 CDNF 蛋白纯化SDS-PAGE 分析及Western blot 鉴定 CDNF 蛋白在20 个细胞培养瓶(225 cm2)的HEK 293T 细胞中(总培养基量为500 ml)大量表达之后,收取上清进行镍柱亲和层析,蛋白与镍柱结合后,摸索洗脱条件,SDS-PAGE 结果显示(见图2),在50 mmol/L 咪唑浓度的洗脱液洗脱时已经可以洗脱下目的蛋白。对电泳条带进行灰度分析,结果显示70 mmol/L 及90 mmol/L 咪唑浓度洗脱液洗脱得到的蛋白纯度在90%以上。最终将蛋白浓缩至约1 mg/ml 的浓度,分装后-80℃保存。500 ml 上清可以纯化出约1 mg 蛋白。使用Western blot 对纯化的蛋白进行鉴定,结果显示(见图3),所获得的CDNF 蛋白正确性得到验证。
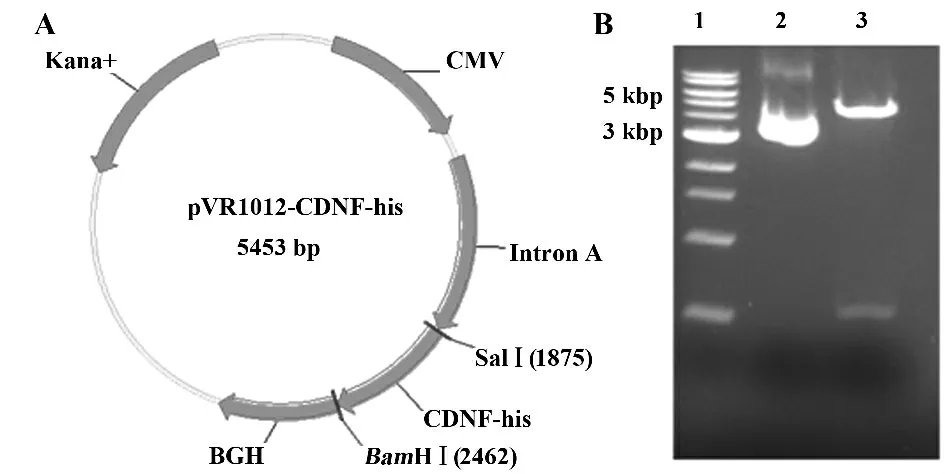
图1 pVR1012-CDNF-his 图谱及质粒酶切鉴定分析Fig.1 pVR1012-CDNF-his map and plasmid's restriction enzyme digestion analysis

图2 SDS-PAGE 分析蛋白纯化情况Fig.2 SDS-PAGE analysis for protein purification
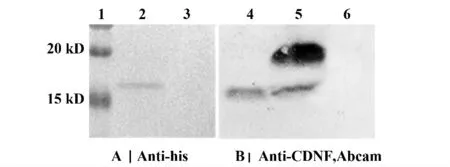
图3 纯化得到的CDNF 蛋白Western blot 鉴定Fig.3 Western blot analysis for CDNF protein after purification
2.3 CDNF 生物活性鉴定 通过实验摸索6-OHDA在200 μmol/L 浓度下对PC12 细胞能起到较好的杀伤效果,因此选择此浓度作为杀伤浓度,评价纯化得到的CDNF 对PC12 是否具有保护作用。MTT 结果显示(见图4),随着CDNF 浓度的升高,PC12 细胞存活率呈上升趋势,说明所纯化获得的蛋白具有良好的生物活性。
2.4 多克隆抗体鉴定 免疫过程中及免疫后取血制备血清,使用Western blot 来检测多克隆抗体。结果显示(见图5):二免后新西兰兔体内已产生CDNF 特异性抗体,三免起到了免疫加强效果,兔体内产生了更多的多克隆抗体。因此,CDNF 兔多克隆抗体成功制备。
3 讨论
CDNF 作为一种近年来发现的新型神经营养因子对多巴胺能神经元具有保护作用,因此具有治疗帕金森病的良好前景。在对其进行研究过程中,一般均通过昆虫杆状病毒表达系统进行表达及后续纯化[8,11]。杆状病毒表达系统具有表达量高且质量好(可一定程度保证蛋白正确折叠及糖基化修饰等)以及可放大生产等优点[9,10]。但目前市售的杆状病毒表达试剂盒价格较高,且一般实验室研究蛋白需求量较小,所以杆状病毒表达系统用于纯化蛋白不适用于常规实验室。本研究旨在探索出一种成本较低,适合于“蛋白需求量小”的蛋白表达纯化体系,使用该体系获得具有生物活性的CDNF 蛋白。
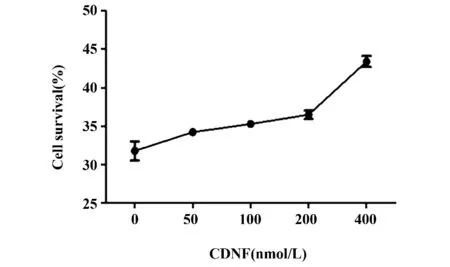
图4 CDNF 生物活性鉴定MTT 结果Fig.4 MTT results for biological activity identification
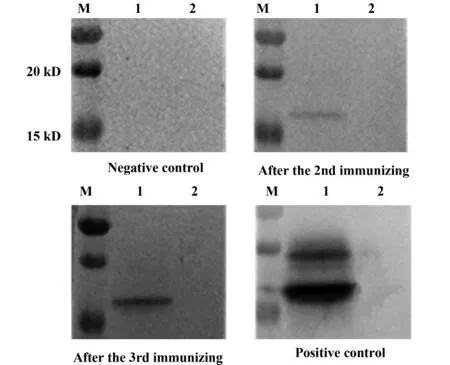
图5 多克隆抗体Western blot 检测结果Fig.5 Western blot for polyclonal antibodies analysis
HEK 293T 细胞是常用的哺乳动物细胞,且表达质粒转染后表达效果较好。镍柱亲和层析是携带有his 标签蛋白的常用纯化手段。因此本研究联合“HEK 293T 细胞表达蛋白”与“镍柱亲和层析”,进行目的蛋白CDNF 的表达纯化。首先,从本实验室已有的pAAV-CDNF 上通过PCR 手段扩增出CDNF表达序列:3'端带有6 ×his 标签序列的片段,进而构建入VR1012 真核表达载体,在真核细胞HEK 293T中成功大量表达出C 端带有6 ×his 标签的CDNF蛋白。同时,由于构建入载体的CDNF 基因片段5'端具有调控表达蛋白分泌的信号肽,故细胞内存在未剪切信号肽的未成熟CDNF 蛋白及剪切掉信号肽的成熟CDNF 蛋白两种形式。为只获得成熟的CDNF 蛋白,故只收取上清进行镍柱亲和层析,获得了纯度较高的成熟的CDNF 蛋白。
有研究报道,CDNF 在6-OHDA 介导的PC12 损伤过程中通过抑制影响Caspase 3 及Bcl-2/Bax 相关的凋亡通路或抑制JNK 信号通路起到保护多巴胺能神经元的作用[11,12]。基于此,采用MTT 法检验纯化获得的蛋白对神经细胞是否具有保护作用。因此,采用MTT 法检验纯化获得的蛋白是否具有保护作用。MTT 结果显示,获得的CDNF 蛋白对PC12细胞具有很好的保护效果。
若进一步研究CDNF 在帕金森病等疾病中的应用或对其相关机理进行研究,CDNF 的抗体必不可少。若将CDNF 蛋白应用到帕金森病的治疗中,CDNF 在脑部的含量及分布情况需要通过WB 或免疫组织化学染色的方法进行分析,这两种方法必不可少CDNF 的抗体[8,13,14];若研究CDNF 蛋白的保护机理,CDNF 的抗体则可用于一系列含有CDNF目的片段的重组质粒的表达鉴定及用于探究CDNF相互作用蛋白的实验中。因此,本文获得纯度较高的CDNF 蛋白后,用其免疫动物,成功刺激新西兰大白兔产生特异性抗体,经Western blot 进行鉴定,制备获得的多克隆抗体与CDNF 蛋白具有很好的结合特异性,且在1∶1 000 使用时获得较好的蛋白显色效果。至此,CNDF 蛋白的兔多克隆抗体成功制备。
综上所述,本研究成功建立相比较杆状病毒表达系统成本较低、操作较简单、更适用于实验室研究的“HEK 293T 细胞表达,镍柱亲和层析纯化”的蛋白表达纯化体系,获得具有生物活性的CDNF 蛋白,并成功制备了特异性较好的CDNF 多克隆抗体。为进一步研究CDNF 的功能、应用及保护机制等方面奠定了基础。
[1]Olanow,C.W,Stern,M.B.and Sethi,K,et al.Incidence of Parkinson's disease:variation by age,gender,and race/ethnicity[J].Am J Epidemiol,2003,157(11):1015-1022.
[2]Olanow CW,Stern MB,Sethi K.The scientific and clinical basis for the treatment of Parkinson disease[J].Neurology,2009,72(21 Suppl 4):S1-S136.
[3]Calabrese VP.Projected number of people with Parkinson disease in the most populous nations,2005 through 2030[J].Neurology,2007,69(2):223-224.
[4]Welchko RM,Leveque XT,Dunbar GL,et al.Genetic rat models of Parkinson's disease[J].Parkinsons Dis,2012,2012:128356.
[5]Ciesielska A,Mittermeyer G,Hadaczek P,et al.Anterograde axonal transport of AAV2-GDNF in rat basal ganglia[J].Mol Ther,2011,19(5):922-927.
[6]Allen SJ,Watson JJ,Shoemark DK,et al.GDNF,NGF and BDNF as therapeutic options for neurodegeneration[J].Pharmacol Ther,2013,138(2):155-175.
[7]Lindholm P,Saarma M.Novel CDNF/MANF family of neurotrophic factors[J].Dev Neurobiol,2010,70(5):360-371.
[8]Lindholm P,Voutilainen MH,Lauren J,et al.Novel neurotrophic factor CDNF protects and rescues midbrain dopamine neurons in vivo[J].Nature,2007,448(7149):73-77.
[9]Richard B,Hitchman,Robert D,et al.Baculovirus expression systems for recombinant protein production in insect cells[J].Recent Patents Biotechnol,2009,3:46-54.
[10]Ailor E,Betenbaugh MJ.Modifying secretion and posttranslational processing in insect cells[J].Curr Opin Biotechno,1999,10(2):142-145.
[11]Mei JM,Niu CS.Effects of CDNF on 6-OHDA-induced apoptosis in PC12 cells via modulation of Bcl-2/Bax and caspase-3 activation[J].Neurol Sci,2014,35(8):1275-1280.
[12]Zhao H,Cheng L,Liu Y,et al.Mechanisms of anti-inflammatory property of conserved dopamine neurotrophic factor:inhibition of JNK signaling in lipopolysaccharide-induced microglia[J].J Mol Neurosci,2014,52(2):186-192.
[13]Merja H.Voutilainen,Susanne Bäck,Johan Peränen,et al.Chronic infusion of CDNF prevents 6-OHDA-induced deficits in a rat model of Parkinson' s disease[J].Exp Neurol,2011,228:99-108.
[14]Ren X,Zhang T,Gong X,et al.AAV2-mediated striatum delivery of human CDNF prevents the deterioration of midbrain dopamine neurons in a 6-hydroxydopamine induced parkinsonian rat model[J].Exp Neurol,2013,248:148-156.