ZZ 亲和肽-碱性磷酸酶融合蛋白的制备与初步应用①
鲍如梦 赵爽佳 薛 敏 杨洪鸣 唐金宝 (潍坊医学院药学院,潍坊 261053)
葡萄球菌A 蛋白(Staphylococcal protein A,SpA)是金黄色葡萄球菌(Staphylococcus aureus)细胞壁分离出的一种单一多肽链,具有E、D、A、B 和C 5 个高度同源的IgG 结合结构域[1],可与兔、人、鼠等多种哺乳动物血清中IgG 抗体的Fc 段非特异性结合(对马、羊等IgG 无亲和力),且这种结合不影响其Fab 片段与抗原特异性结合的免疫活性[2,3]。利用这一特性,以各种标记物(如碱性磷酸酶、过氧化物酶、异硫氰酸荧光素等)标记SpA,在免疫测定实验中得到大量应用,被称为“广泛二抗”[4,5]。近来研究发现SpA 的5 个高度同源的IgG 结合结构域中,也与某些IgG 的Fab 段结合[如人IgG1 的F(ab')2],而以人工修饰的ZZ 结构域(ZZ-domain)代替其5 个结构域,仅保留了与IgG 抗体Fc 段结合的性能[6,7],使ZZ 结构域作为亲和试剂参与免疫反应更为有利。本研究将来自SpA ZZ 结构域的ZZ亲和肽基因与碱性磷酸酶(Alkaline phosphatase,AP)基因重组,利用大肠杆菌表达,制备一种既具有与IgG 抗体结合活性又具碱性磷酸酶活性的融合蛋白,为构建一种特异、简便和快速的新型免疫亲和试剂提供实验依据。
1 材料与方法
1.1 材料 pEZZ 18 载体购自Amersham 公司;pDAP2 质粒由华中科技大学沈关心教授惠赠;E-.coli DH5α 由本实验室保存;各种工具酶为TaKaRa公司或MBI 公司产品;PCR 扩增试剂盒购自TaKa-Ra 公司;HisTrap Chelating HP 购自Amersham Biosciences;质粒抽提试剂盒购自Omiga 公司;羊、兔IgG 抗体购自BBI 公司;兔抗鼠MMP-2、羊抗兔IgGAP 均购自武汉博士德生物工程有限公司;BCIP/NBT 碱性磷酸酶购自碧云天公司;其他生化及化学试剂为进口或国产分析纯。
1.2 方法
1.2.1 ZZ-AP 融合蛋白表达载体的构建 根据AP基因序列设计引物(F1:5'-GCTAGAGCTCACCAGAAATGCCTGTTCT-3',含Sac I 内切酶位点;R1:5'-GCTACTGCAGTTAATGGTGATGGTGATGGT-3',含Pst I 内切酶位点)以pDAP2 为模板,PCR 扩增AP 基因并克隆至pEZZ18 质粒Sac I/Pst I 酶切位点,获得pEZZ-AP 质粒。将该质粒转化至感受态菌E.coli DH5α,涂布于LB/Amp(氨苄浓度为100 μg/ml)平板,37℃过夜培养,挑选阳性单克隆菌落接于5 mL LB/Amp 液体培养基,37℃过夜培养,小量提取质粒作Sac I 和Pst I 双酶切验证并委托上海生工测序。
1.2.2 ZZ-AP 融合蛋白的表达与纯化 pEZZ-AP/E.coli DH5α 工程菌过夜培养后,以1/10 的接种量接于50 ml 新鲜的LB/Amp(氨苄浓度为100 μg/ml)液体培养基中转培养,37℃振荡过夜培养后,6 000 r/min离心10 min,弃菌液,含咪唑20 mmol/L的0.1 mmol/L TBS(Tris 100 mmol/L,NaCl 0.5 mmol/L,pH7.5)溶液重悬菌体,反复冻融直至菌液变得黏稠,6 000 r/min 离心30 min,取上清12%SDS-PAGE 分析,将上清以1 ml/min 流速通过His-Trap 层析柱,以含咪唑250 mmol/L 的0.1 mmol/L TBS 溶液洗脱并收集洗脱组分,Millipore 超滤离心管(分子截留量10 kD)8 000 r/min 离心,脱盐浓缩至合适体积,收集液进行SDS-PAGE 分析。
1.2.3 ZZ-AP 融合蛋白生物学活性检测
1.2.3.1 Western blot 羊IgG(分子量约150 kD)、兔IgG(分子量约160 kD)经12% 的非还原SDSPAGE 分离后,转至NC 膜,转膜结束后,经5% BSA溶液封闭30 min,浸入ZZ-AP(0.1 mg/ml)溶液37℃温育结合30 min,TBST 洗涤5 次后,加入BCIP/NBT 碱性磷酸酶显色溶液,在振荡条件下充分显色。
1.2.3.2 细胞免疫组化 本实验以转染pLIVEmIL-1β 和pLIVE-lacZ(对照)的鼠肝癌细胞Hepa1-6(Hepa1-6/IL-1β、Hepa1-6/lacZ),细胞免疫组化染色法观测各组细胞的细胞质MMP-2 表达情况。我们以ZZ-AP 融合蛋白与传统二抗(山羊抗兔IgGAP)并行分析,目的是检测ZZ-AP 作为替代标记二抗的应用效果。Hepa1-6/IL-1β、Hepa1-6/laZ 细胞经培养、固定后,0.3% Triton X-100 处理20 min 增强膜透性,正常山羊血清封闭,在被检标本上滴加兔抗鼠MMP-2 多抗液(1∶200),湿盒4℃过夜。TBS冲洗3 次后,滴加山羊抗兔IgG-AP(1∶500)及ZZAP 工作液(0.1 mg/ml),37℃温育30 min;TBS 冲洗3 次,每次10 min,BCIP/NBT 碱性磷酸酶显色;苏木素复染1 min,脱水透明,封片,显微镜观察。
2 结果
2.1 ZZ-AP 表达载体的构建及鉴定 PCR 产物琼脂糖电泳显示在1375 bp 左右有明显条带(图1),为扩增的AP 片段。对经PCR 鉴定的阳性克隆进行Sac I、Pst I 双酶切验证,琼脂糖凝胶电泳结果显示有目的基因插入(图1)。对酶切验证正确的克隆基因序列测定,测序结果表明所扩增的AP 与Genebank 所公布的基因序列一致,将AP 基因正确克隆至pEZZ18 的质粒命名为pEZZ-AP。
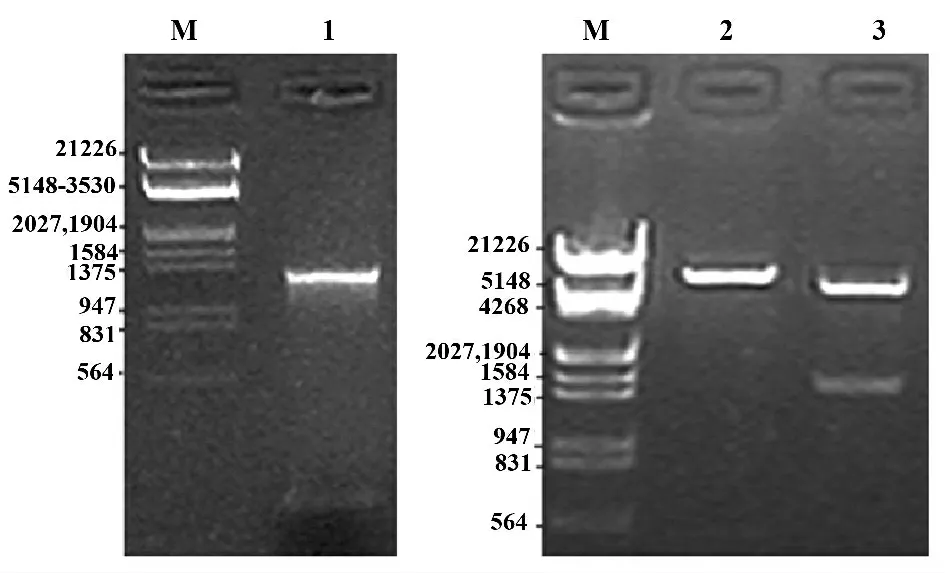
图1 PCR 产物电泳分析(左)及重组质粒pEZZ-EGFP 双酶切鉴定(右)Fig.1 Analysis of PCR product(left)and restriction enzyme of the recombinant plasmid(right)
2.2 ZZ-AP 融合蛋白的表达与纯化 含质粒pEZZ-AP 的E.coli DH5α 菌株37℃振荡培养12 h 后,取100 μl 菌液离心,对菌体进行 SDS-PAGE分析。结果显示,与对照菌株相比,pEZZ-AP/E.coli DH5α 在62 kD 左右出现明显差异条带,与ZZ-AP融合蛋白理论值相近(图2,泳道2)。通过反复冻融菌体破壁释放目的蛋白,结果显示冻融上清含有大量目的蛋白。冻融上清流通上样HisTrap 层析柱,经250 mmol/L 咪唑洗脱目的蛋白,可获得电泳纯度90%以上的ZZ-AP 融合蛋白(图2,泳道3)。
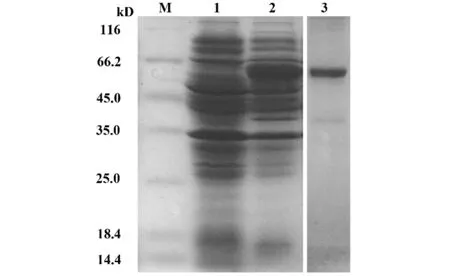
图2 12%SDS-PAGE 分析Fig.2 12% SDS-PAGE analysis
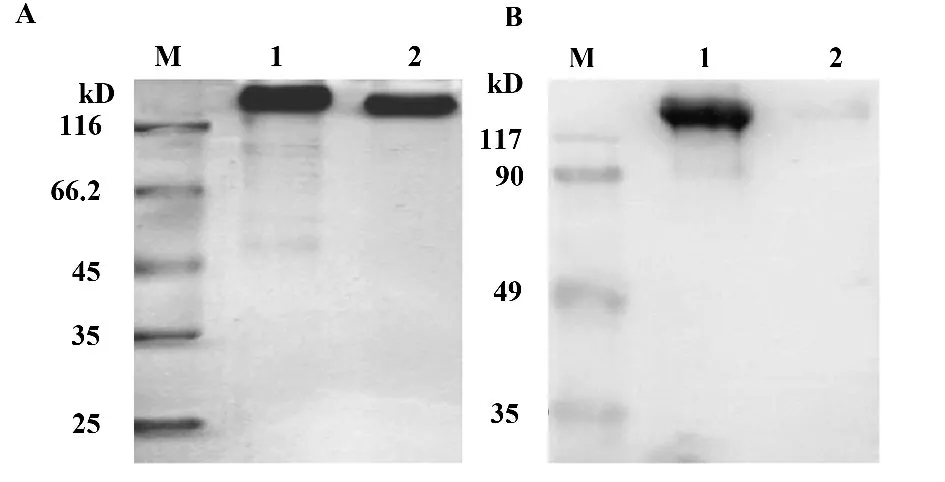
图3 非还原SDS-PAGE and Western blot 分析Fig.3 Non reducting SDS-PAGE and Western blot analysis of ZZ-AP fusion protein
2.3 ZZ-AP 融合蛋白生物学活性检测
2.3.1 Western blot 羊IgG、兔IgG 经12%的非还原SDS-PAGE 分离后转膜,加入ZZ-AP 孵育洗涤、BCIP/NBT 碱性磷酸酶显色溶液显色,结果如图3。兔IgG 条带显色而羊IgG 条带未显色,表明ZZ-AP融合蛋白可特异性结合兔IgG 抗体而不结合羊IgG,且具有碱性磷酸酶的酶学活性。
2.3.2 细胞免疫组化 在肿瘤细胞中,IL-1 能够诱导肿瘤和基质成分表达基质金属蛋白酶(MMPs)。我们以ZZ-AP代替标记二抗羊抗兔IgGAP,检测ZZ-AP 作为一种替代二抗的检测效果。图4 结果显示,Hepa1-6 细胞经苏木精染色,细胞核呈深蓝色,与细胞质明显区分。转染了pLIVE-mIL-1β的Hepa1-6 细胞加入兔抗鼠MMP-2 多抗,经二抗山羊抗兔IgG-AP 显色,可看出Hepa1-6/IL-1β 细胞浆颜色明显深于Hepa1-6/lacZ 组(对照组),ZZ-AP 检测组的显色模式及着色效果与二抗(羊抗兔IgGAP)相当。实验结果表明ZZ-AP 可代替标记二抗应用于免疫分析。
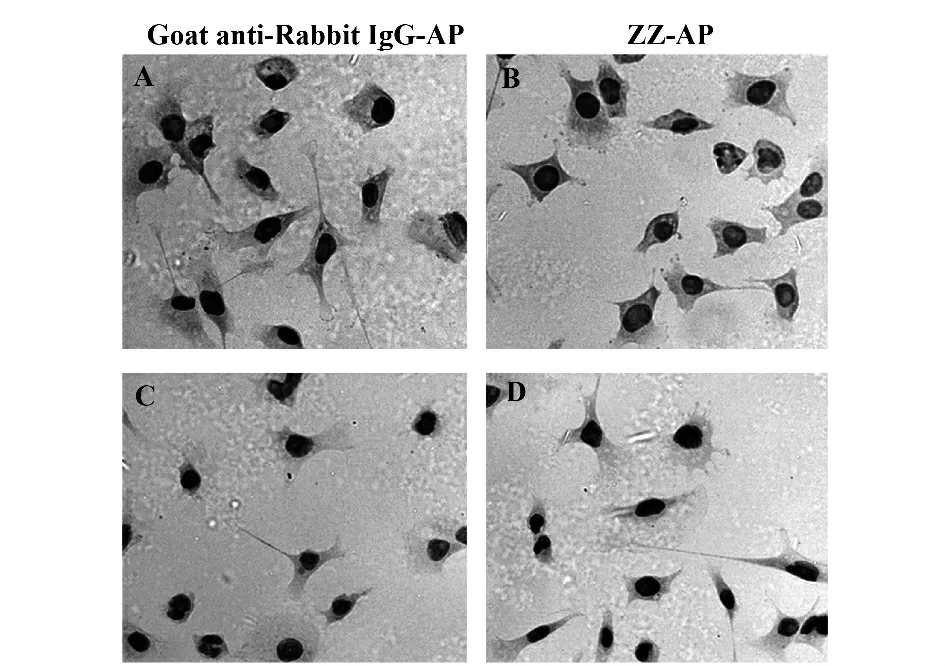
图4 细胞免疫组化检测MMP-2 (×100)Fig.4 Immunocytochemistry of MMP-2(×100)
3 讨论
开发和应用新的免疫标记物或标记方式是免疫学研究的主要方向之一,传统免疫标记方法是将标记物通过化学交联法偶联到免疫亲和试剂分子上,但这种方法有其缺点[8,9]:需要交联、纯化等多步蛋白质操作,易导致蛋白质失活,且成本高。采用基因工程方法将抗体基因和标记物基因融合表达,获得既保持抗体活性又有标记物活性的双功能蛋白质,不仅易于大量制备、成本低,而且抗体片段与标记物融合表达可最大限度地避免非特异性标记和游离标记物的存在,降低反应本底,也避免了传统标记技术中需要分离、纯化等复杂的过程[10]。目前主要研究集中在单链抗体(ScFv)与AP 融合蛋白的构建[11,12],但是每检测一种抗原就要制备相应的融合抗体,在不能或不便构建抗体-酶融合蛋白时则融合标价受阻,因此,寻找一种可结合多种一抗的抗并与酶以融合表达方式来制备免疫酶标试剂具有重要意义。本实验将碱性磷酸酶与ZZ 亲和肽融合表达,借助于ZZ 亲和肽与IgG 的Fc 段结合的广谱性,可对小分子抗体-AP 融合蛋白产生积极的补充作用,而无须每检测一种抗原而制备相应的抗体融合蛋白。由于时间及样本的关系,我们仅对ZZ-AP 融合蛋白做了初步的应用效果对比,因此,进一步拓宽其应用范围将是下一步的研究重点。
[1]Moks T,Abrahmsen L,Nilsson B,et al.Staphylococcal protein A consists of five IgG-binding domains[J].Eur J Biochem,1986,156(3):637-643.
[2]Mousli M,Turki I,Kharmachi H,et al.Recombinant single-chain Fv antibody fragment-alkaline phosphatase conjugate:a novel in vitro tool to estimate rabies viral glycoprotein antigen in vaccine manufacture[J].J Virol Methods,2007,146(1-2):246-256.
[3]Rau D,Kramer K,Hock B.Single-chain Fv antibody-alkaline phosphatase fusion proteins produced by one-step cloning as rapid detection tools for ELISA[J].J Immunoassay Immunochen,2002,23(2):129-143.
[4]Dahlbom I,Agardh D,Hansson T.Protein A and protein G ELISA for the detection of IgG autoantibodies against tissue transglutaminase in childhood celiac disease[J].Clin Chim Acta,2008,395(1-2):72-76.
[5]Yuan Y,He H,Lee LJ.Protein A-based antibody immobilization onto polymeric microdevices for enhanced sensitivity of enzymelinked immunosorbent assay [J].Biotechnol Bioeng,2009,102(3):891-901.
[6]Jansson B,Uhlen M,Nygren PA.All individual domains of staphylococcal protein A show Fab binding[J].FEMS Immunol Med Microbiol,1998,20(1):69-78.
[7]Zheng D,Aramini JM,Montelione GT.Validation of helical tilt angles in the solution NMR structure of the Z domain of Staphylococcal protein A by combined analysis of residual dipolar coupling and NOE data[J].Protein Sci,2004,13(2):549-554.
[8]Kobatake E,Iwai T,Ikariyama Y,et al.Bioluminescent immunoassay with a protein A-luciferase fusion protein[J].Anal Biochem,1993,208(2):300-305.
[9]Zhang XM,Kobatake E,Kobayashi k,et al.Genetically fused protein A-luciferse for immunological blotting analysis[J].Anal Biochem,2000,282(1):65-69.
[10]Tang JB,Zhu P,Yang HM,et al.Expression and secretion of recombinant ZZ-EGFP fusion protein by the methylotrophic yeast Pichia pastoris[J].Biotechnol Lett,2008,30(8):1409-1414.
[11]Volodin MA,Afanas'eva AV,Bokhman Iav,et al.Thermostable placental-type alkaline phosphatase in the malignantly degenerated endometrium[J].Vopr Onkol,1982,28(6):29-35.
[12]Wang SH,Zhang JB,Zhang ZP,et al.Construction of single chain variable fragment(ScFv)and BiscFv-alkaline phosphatase fusion protein for detection of Bacillus anthracis[J].Anal Chen,2006,78(4):997-1004.