microRNA-7 基因敲减对小鼠CD4 + SP 细胞胸腺发育的影响①
陶弋婧 朱顺飞 陈 超 赵娟娟 郭萌萌 张忆雄 秦娜林 徐 林
(贵州省遵义医学院免疫学教研室暨贵州省生物治疗人才基地,遵义 563000)
胸腺(Thymus)是T 淋巴细胞分化成熟的中枢免疫器官。来源于骨髓中的淋巴细胞祖细胞,在胸腺中经历复杂的阳性选择及阴性选择后,发育为成熟的T 淋巴细胞。CD4+T 细胞是成熟T 淋巴细胞的主要群体之一。近年来,已有大量文献报道,微小RNA(microRNA,miRNA)对胸腺CD4+T 细胞的发育以及功能发挥有着重要的调控作用[1-4]。如Chong 等[1]发现在Drosha-/-小鼠胸腺中,CD4+T细胞发育明显异常,提示miRNAs 的表达对于胸腺中CD4+T 细胞的发育具有重要作用。进一步研究显示,胸腺前体细胞发育至成熟CD4+T 细胞的不同阶段,特定miRNAs 分子的表达存在差异[2]。此外,Stahl 等[3]研究发现,miR-155 通过调节CD4+Th 细胞对胸腺来源的天然调节性T 细胞(naturally regulatory T cells,nTreg)抑制作用的敏感性,在后者介导的免疫耐受中发挥关键作用。这些研究均提示特定的miRNA 分子对胸腺CD4+T 细胞的发育和功能具有重要作用。因此,深入探讨特定miRNAs 分子在胸腺CD4+T 细胞发育中的作用,具有重要的理论意义。
微小RNA-7(microRNA-7,miR-7)是新近报道的miRNA 分子,其在机体组织器官发育以及多种肿瘤的发生中发挥了重要的调控作用[5-7]。新近研究表明,miR-7 同样参与了免疫细胞以及免疫器官的发育调节,如,Stumpfova 等[8]在体外培养树突状细胞(Dendritic cell,DC)中发现,miR-7 在其成熟过程中高水平表达,且在活化24 h 后持续升高。类似的,在本课题组前期研究中也发现,miR-7 在小鼠胸腺、脾脏等免疫器官中存在较高水平[9],然而,miR-7 对胸腺CD4+SP 细胞发育及功能的作用研究至今未见相关报道。因此,本研究拟利用前期建立的miR-7 基因敲减小鼠模型[10],观察miR-7 基因敲减对小鼠胸腺CD4+SP 细胞发育的影响,并初步探讨其意义,以期为后续深入研究miR-7 在免疫细胞发育和功能中的生物学作用提供重要的前期实验基础。
1 材料与方法
1.1 材料 SPF 级FVB 小鼠和miR-7KD 小鼠[9]饲养于遵义医学院生物医学实验动物中心[10];LEGEND MICRO21R 型低温离心机(Thermo);IX-51 倒置显微镜(Olympus 公司);HE 染色液(泰康医疗);GalliosAs34195 流式细胞仪(Beckman Coulter 公司);PE 标记Anti-Mouse CD4 抗体、PerCp/Cy5.5 标记Anti-Mouse CD8 抗体、PE 标记Anti-Mouse CD62L抗体、APC 标记Anti-Mouse CD44 抗体、APC 标记Anti-Mouse Ki67 抗体及相应同型对照(eBioscience公司);Fixation/permeabilization Buffer(eBioscience公司);SW-CJ-2FD 型超净工作台(苏州净化设备厂);兔抗鼠ERK1/2 抗体、兔抗鼠P-ERK1/2 抗体、兔抗鼠GAPDH 抗体以及羊抗兔IgG-HRP 标记抗体(Cell Signaling 公司);BeyoECL Plus A、B 液(碧云天公司);Propidium Iodide(eBioscience 公司);Western blot 化学发光成像仪(Carestream Health 公司)。
1.2 方法
1.2.1 小鼠胸腺体积、重量以及细胞总数的检测 将第7 代8 周龄WT 小鼠和miR-7KD 小鼠采取颈椎脱臼处死。常规解剖提取其胸腺组织。置于磷酸盐缓冲液(PBS)中清洗两次,称其重量。后将胸腺制备成单细胞悬液,并用200 目筛网将单细胞悬液进行过滤,收集细胞。1 200 r/min 离心10 min,弃上清,用细胞计数板在倒置显微镜下计数,并将剩余的单细胞悬液置于冰上,做流式备用。
1.2.2 HE 染色观察胸腺的形态学结构变化 常规解剖提取小鼠的胸腺组织,制备成石蜡切片,切片烤干后,依次投入二甲苯、乙醇、水中脱蜡至水。然后移入苏木素中浸染10 min,自来水中清洗10 min,移入乙醇中浸润5 s;然后移入伊红液中浸染2 min,70%乙醇洗涤,再进行脱水、透明处理。最后中性树胶封片,在显微镜下观察胸腺的形态学结构改变。
1.2.3 FACS 检测胸腺CD4+SP 细胞及其CD44 和CD62L 的比例 将胸腺制备成单细胞悬液,加入红细胞裂解液3 ml,冰上裂解10~15 min,PBS 洗涤后离心,弃上清,分别加入 CD4-PE、CD8-PerCp/Cy5.5、CD62L-PE、CD44-APC 荧光标记抗体各1μl,4℃避光孵育30 min。PBS 洗涤两次胞后FACS 检测。
1.2.4 FACS 检测胸腺CD4+SP 细的核抗原Ki67 的比例 CD4-PE 荧光抗体染色同1.2.3,PBS洗涤两次后弃上清,加入Fixation Buffer 200 μl,4℃避光孵育30 min,加入Permeabilization Buffer 300 μl及1 μl Ki67-APC 抗体,4℃避光孵育30 min,1 200 r/min 离心10 min,PBS 洗涤两次,FACS 上机检测。
1.2.5 PI 染色法检测CD4+SP 细胞的凋亡情况 CD4-PE 抗体染色同1.2.3,PBS 洗涤2 次后加入PI荧光染料染色,30 min 内FACS 检测。
1.2.6 小鼠胸腺总蛋白提取及Western blot 检测ERK1/2 总蛋白和P-ERK1/2 表达水平 常规解剖提取小鼠的胸腺,并将其剪碎置于冰上。加入RIPA裂解液裂解30 min,4℃12 000 r/min 离心15 min。吸取上清液,蛋白样品利用BCA 方法定量。加入5 ×上样缓冲液煮沸10 min,分装备用。胸腺蛋白提取后,根据BCA 法测得蛋白浓度加样,进行SDSPAGE 电泳,2 h;将电泳分离的蛋白22 V,30 min 电转移至PVDF 膜上,5%BSA 封闭2 h,PBST 洗膜3次,每次10 min。分别加入1∶1 000 稀释的Rabbit ERK1/2 和Rabbit P-ERK1/2,4℃孵育过夜。PBST洗膜3 次,每次10 min。加入1∶2 000 稀释的Anti-Rabbit IgG HRP-linked 孵育1 h,增强型ECL 发光试剂法检测蛋白表达情况。经Image J 软件进行灰度值测定与分析。
1.3 数据统计分析 所有实验均重复3 次以上,数据采用SPSS18.0 进行统计分析,数据以±s 表示,组间比较采用两独立样本资料的t 检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 miR-7KD 小鼠胸腺重量以及细胞总数的变化我们首先观察了WT 小鼠和miR-7KD 小鼠的胸腺大小、重量和细胞总数。如图1 所示,与WT 小鼠相比,miR-7KD 小鼠胸腺体积明显减小(图1A);并且,胸腺重量明显减轻且细胞总数显著减少(图1B和C,P<0.05),差异具有统计学意义。
2.2 miR-7KD 小鼠胸腺的病理学结构改变 我们进一步利用HE 染色观察了miR-7KD 小鼠胸腺病理学结构变化。如图2 所示,与WT 小鼠相比,miR-7KD 小鼠胸腺低倍镜下皮髓质紊乱,高倍镜下胸腺皮质区、髓质区淋巴细胞均减少,且髓质区网状细胞增多,这提示其胸腺结构发生了明显的病理性改变。
2.3 miR-7KD 小鼠胸腺CD4+SP 细胞比例及数量的变化 FACS 检测结果如图3 所示,与WT 小鼠相比,miR-7KD 小鼠胸腺中CD4+SP 细胞比例显著减少(图3A 和B,P<0.01),且细胞总数仍明显降低(图3C,P<0.01)。此外,CD4+CD8+DP细胞比例改变不显著(P >0.05),而CD8+SP 细胞比例明显降低(图3A,P<0.05)。
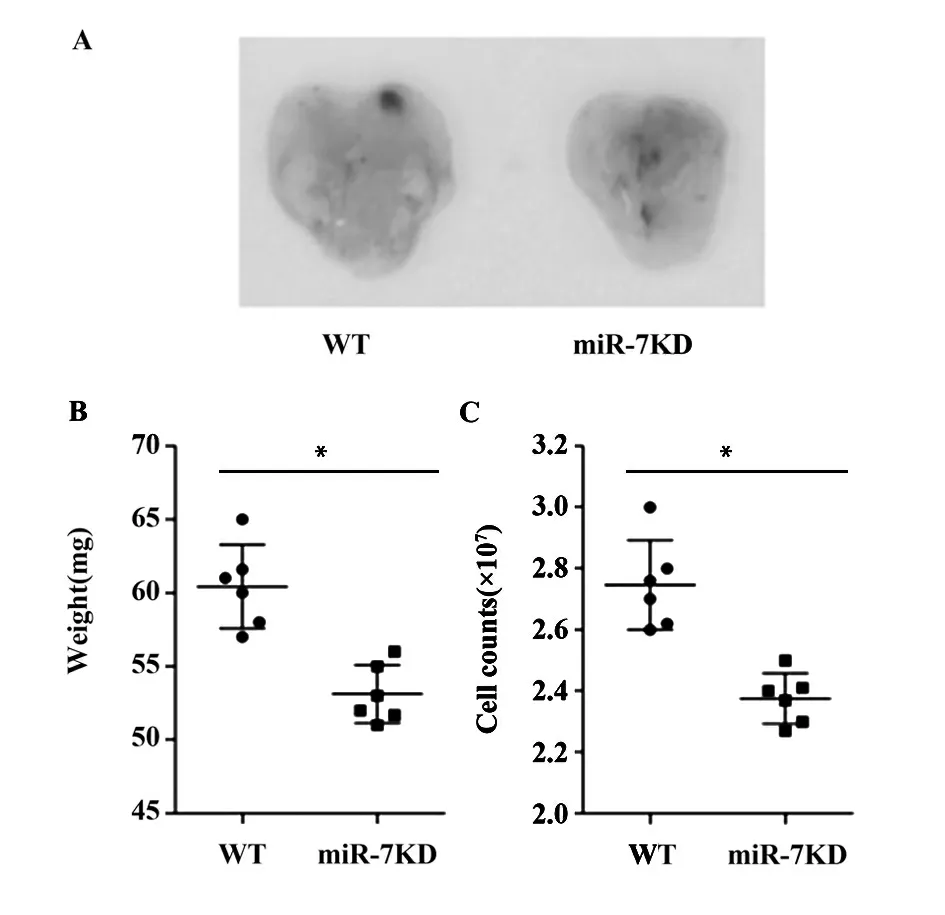
图1 miR-7KD 小鼠胸腺大小、重量以及细胞总数的变化Fig.1 Changes of volume,weight and total cell counts in miR-7KD mice
2.4 miR-7KD 小鼠胸腺CD4+SP 细胞CD44 及CD62L 表达水平的变化 我们进一步用FACS 检测CD4+SP 细胞功能相关分子CD44 及CD62L 表达水平。如图4 所示,与WT 小鼠相比,miR-7KD 小鼠胸腺CD4+SP 细胞CD44 的表达水平明显增加,而CD62L 的表达水平减少(P<0.05)。
2.5 miR-7KD 小鼠胸腺CD4+SP 细胞核抗原Ki67的表达水平变化 我们进一步观察了CD4+SP 细胞增殖变化情况。如图4 所示,与WT 小鼠相比,miR-7KD 小鼠胸腺CD4+SP 细胞的核抗原Ki67 比例明显增加(P<0.01)。

图2 miR-7KD 小鼠胸腺的形态学结构改变(白光,放大倍数)Fig.2 The pathological changes in miR-7KD mice(White,Magnification)
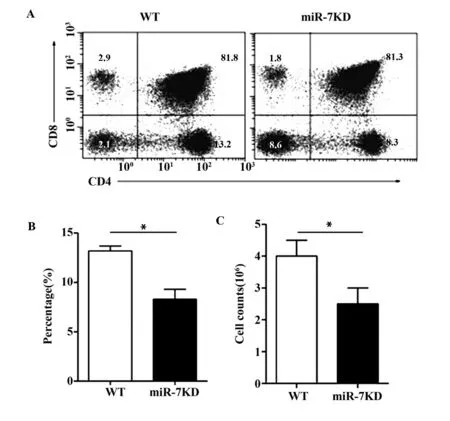
图3 miR-7KD 小鼠胸腺CD4 + SP 细胞比例及数量的变化Fig.3 Change on proportion and counts of CD4 +SP cells in miR-7KD mice
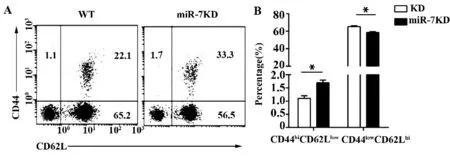
图4 miR-7KD 小鼠胸腺CD4 +SP 细胞CD44 及CD62L表达水平的变化Fig.4 Change on expression level of CD44 and CD62L in miR-7KD mice
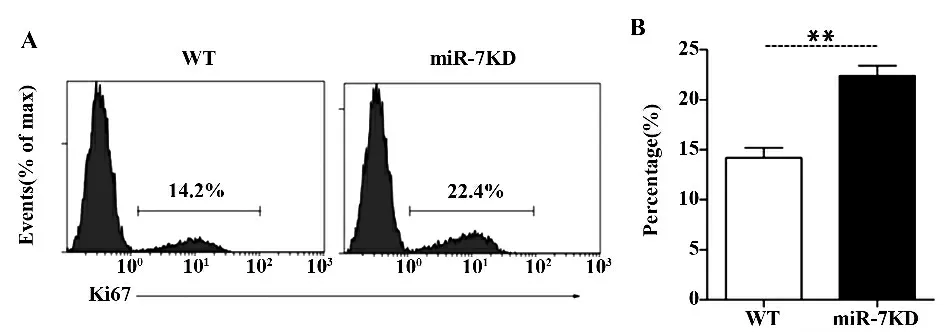
图5 miR-7KD 小鼠胸腺CD4 +SP 细胞核抗原Ki67 的表达水平变化Fig.5 Change on expression level of Ki-67 in miR-7KD mice
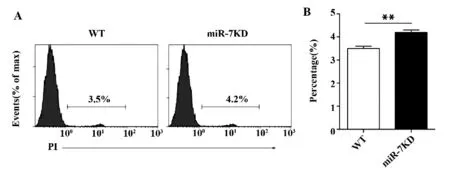
图6 miR-7KD 小鼠胸腺CD4 +SP 细胞凋亡比例变化Fig.6 Change on proportion of PI in miR-7KD mice
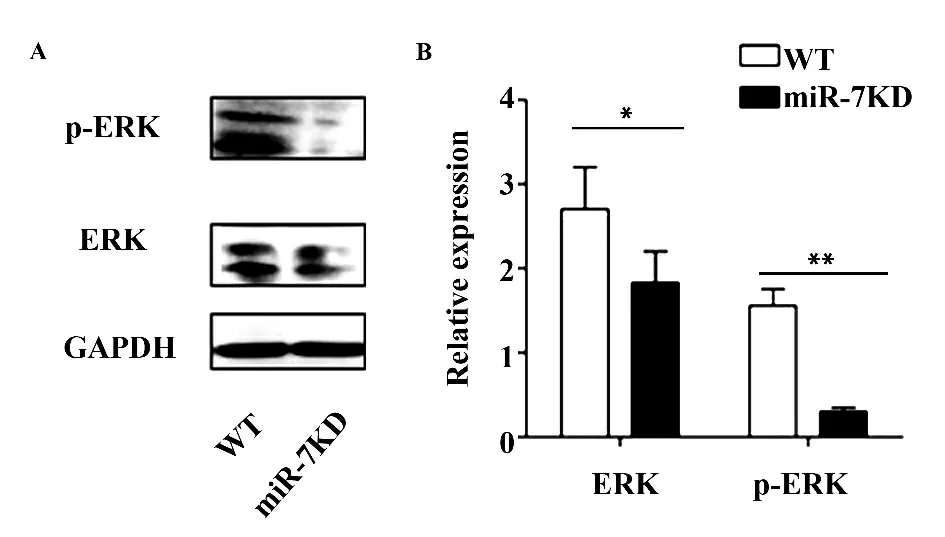
图7 miR-7KD 胸腺总ERK1/2 及P-ERK1/2 的表达水平变化Fig.7 Change on level of total ERK1/2 and phosphor-ERK1/2 in miR-7KD mice
2.6 miR-7KD 小鼠胸腺CD4+SP 细胞凋亡比例改变 我们进一步观察了CD4+SP 细胞凋亡变化情况。如图6 所示,与WT 小鼠相比,miR-7KD 小鼠胸腺CD4+SP 细胞的凋亡比例显著增加(P<0.01)。
2.7 miR-7KD 小鼠胸腺总ERK1/2 以及磷酸化-ERK1/2 蛋白的表达 最后,我们进一步利用Western blot 技术检测了miR-7KD 小鼠胸腺中总ERK1/2 以及磷酸化-ERK1/2 蛋白(P-ERK1/2)的表达变化。结果显示:与WT 小鼠相比,miR-7KD 小鼠胸腺总蛋白ERK1/2 以及P-ERK1/2 的表达水平均显著降低(P<0.05)。
3 讨论
目前,利用基因敲减/敲出(Knock down/Knock out)技术而获得基因敲减/敲出动物模型成为当今研究特定基因生物学功能的最重要技术手段之一[11]。近年来,越来越多的研究也采用此类动物模型来研究特定miRNAs 分子在免疫细胞发育、分化和功能中的作用[12-14]。如Henao 等[12]研究发现将miR-181 敲除后,小鼠胸腺自然杀伤性T 细胞(Natural killer T cells,NKTs)细胞的比例明显降低,且其功能明显异常,提示miR-181 对于NKT 细胞的发育和功能具有重要调控作用;类似地,我们前期也利用miRNA 海绵体(miRNA-sponge,miR-SP)技术构建了miR-126 的基因敲减小鼠,且发现miR-126 敲减后,可显著影响小鼠肠系膜淋巴结中T 淋巴细胞的比例和活化状态,提示miR-126 对于肠系膜淋巴结免疫细胞的组成和功能具有重要调控作用[13]。新近,我们还成功构建了miR-7 基因敲减小鼠模型[10],这为进一步深入探讨miR-7 在包括CD4+T 细胞在内的免疫细胞发育和功能中的生物学作用提供了重要的技术平台。
在本研究中,我们利用该小鼠模型首次发现miR-7 基因敲减后,小鼠胸腺的体积明显减小,且重量和细胞总数均显著降低。此外,miR-7KD 小鼠胸腺的形态学结构发生了明显的病理性改变。重要的是,我们发现miR-7KD 小鼠胸腺中CD4+SP 细胞的比例和总数均较WT 小鼠显著减少,提示miR-7 参与了CD4+SP 细胞发育过程的调控。类似地,Lykken 等[14]报道miR-181a 可以通过调节TCR 信号的强度,促进CD4+T 及CD8+T 细胞的发育进程。为了进一步探讨miR-7 基因敲减对CD4+SP 细胞胸腺发育的影响,我们检测了其相关功能分子CD44及CD62L 的表达情况。结果发现miR-7KD 小鼠胸腺CD4+SP 细胞CD44 的表达水平明显增加,而CD62L 的表达水平减少,提示miR-7 敲减改变了胸腺CD4+SP 细胞的活化状态。进一步检测显示,miR-7KD 小鼠胸腺中CD4+SP 细胞Ki67 的表达水平显著升高,而PI 阳性率也增加显著。Ki67 是一种与细胞增殖有关的核抗原,其阳性率可有效判断细胞增殖活性的高低[15]。这些结果提示miR-7 基因敲减后CD4+SP 细胞的减少可能与其体内过度活化后导致的细胞凋亡有关。Yi 等[16]研究也发现,miR-155 敲出后CD4+T 细胞比例和细胞数均显著减少,该现象与CD4+T 细胞活化、增殖功能改变有关。
胞外信号调节激酶(Extracellular signal-regulated kinase,ERK)是MAPK 家族的一员,其相关信号途径传递是组织细胞正常发育、生长以及分化的关键[17]。已有大量研究表明,包括CD4+T 细胞在内的免疫细胞的发育分化和凋亡均与ERK 信号途径的改变密切相关[18,19]。如Dillon 等[18]研究报道,敲除胸腺细胞内B-Raf 可导致胸腺细胞急剧减少,进一步检测显示DP 细胞分化为SP 细胞过程存在障碍。机制上的研究表明该效应与B-Raf 敲除引起细胞内ERK 信号通路活化显著下调有关[18]。与之对应的是,本研究中我们发现miR-7KD 小鼠胸腺DP细胞比例并未发生变化。重要的是,miR-7KD 小鼠胸腺总蛋白ERK 以及P-ERK 的表达均显著下调,据此,我们推测miR-7 可能通过改变ERK 信号途径来调控DP 细胞向CD4+SP 细胞发育,并影响该群体细胞的活化和凋亡,最终参与其发育过程。有意思的是,我们也观察到miR-7 小鼠胸腺中CD8+SP细胞比例显著减少。因此,miR-7 调控CD4+SP 细胞发育的确切机制仍有待后续研究阐明。
总之,本研究发现miR-7 敲减后可显著影响小鼠胸腺CD4+SP 细胞的发育,这为后续深入探讨miR-7 在免疫细胞的发育和功能中的作用及机制提供了前期实验基础。
[1]Chong MM,Zhang G,Cheloufi S,et al.Canonical and alternate functions of the microRNA biogenesis machinery[J].Genes Dev,2010,24(17):1951-1960.
[2]Teruel-Montoya R,Kong X,Abraham S,et al.MicroRNA expression differences in human hematopoietic cell lineages enable regulated transgene expression[J].PLoS One,2014,9(7):e102259.
[3]Stahl HF,Fauti T,Ullrich N,et al.miR-155inhibitionsensitizesCD4+Th cells for TREG mediated suppression[J].PLoS One,2009,4(9):e7158.
[4]Ghisi M,Corradin A,Basso K,et al.Modulation of microRNA expression in human T-cell development:targeting of NOTCH3 by miR-150[J].Blood,2011,117(26):7053-7062.
[5]Pollock A,Bian S,Zhang C,et al.Growth of the developing cerebral cortex is controlled by microRNA-7 through the p53 pathway[J].Cell Rep,2014,7(4):1184-1196.
[6]Oldenburger A,van Basten B,Kooistra W,et al.Interaction between Epac1 and miRNA-7 in airway smooth muscle cells[J].Naunyn Schmiedebergs Arch Pharmacol,2014,387(8):795-797.
[7]胡 燕,廖珍媛,陈 超,等.过表达microRNA-7 通过下调CGG 结合蛋白1 的表达抑制人肺癌细胞的生长[J].细胞与分子免疫学杂志,2014,30(2):125-130.
[8]Stumpfova Z,Hezova R,Meli AC,et al.MicroRNA profiling of activated and tolerogenic human dendritic cells[J].Mediators Inflamm,2014:259689.
[9]郑 静,李 颖,秦安东,等.miRNA-7 在小鼠不同组织器官中表达的检测及意义[J].遵义医学院学报,2012,35(2):91-97.
[10]朱顺飞,李永菊,陈 超,等.miRNA-7 基因敲减小鼠模型的鉴定[J].遵义医学院学报,2014,37(6):582-590.
[11]卜友泉,杨正梅,宋方洲.新基因功能研究的策略与方法[J].生命科学研究,2006,10(2):95-98.
[12]Henao-Mejia J,Williams A,Goff LA,et al.The microRNA miR-181 is a critical cellular metabolic rheostat essential for NKT cell ontogenesis and lymphocyte development and homeostasis[J].Immunity,2013,38(5):984-997.
[13]张忆雄,胡 燕,郭萌萌,等.miRNA-126 基因敲减小鼠肠系膜淋巴结T 淋巴细胞比例的变化[J].中国免疫学杂志,2014,30(9):1157-1160.
[14]Lykken EA,Li QJ.microRNAs at the regulatory frontier:an investigation into how microRNAs impact the development and effector functions of CD4 T cells[J].Immunol Res,2011,49(1-3):87-96.
[15]Denkert C,von Minckwitz G.Reply to Ki67 in breast cancer:a useful prognostic marker![J].Ann Oncol,2014,25 (2):542-543.
[16]Yi J,Wang D,Niu X,et al.MicroRNA-155 deficiency suppresses Th17 cell differen-tiation and improves locomotor recovery after spinal cord injury[J].Scand J Immunol,2015,10(2):782-793.
[17]Qi M,Elion EA.MAP kinase pathways[J].J Cell Sci,2005,118(Pt 16):3569-3572.
[18]Dillon TJ,Takahashi M,Li Y,et al.B-Raf is required for positive selection and survival of DP cells,but not for negative selection of SP cells[J].Int Immunol,2013,(4):259-269.
[19]Franz D,Contreras F,González H,et al.Dopamine receptors D3 and D5 regulate CD4(+)T-cell activation and differentiation by modulating ERK activation and cAMP production[J].J Neuroimmunol,2015,284:18-29.