海水pH对颗石藻生长以及二甲基硫产生的影响❋
于 娟, 赵丽军, 杨桂朋, 田继远, 刘 伟, 许超平
(1. 中国海洋大学海洋化学理论与工程技术教育部重点实验室,山东 青岛 266100;2. 青岛农业大学食品科学与工程学院,山东 青岛266109;3. 中国科学院海洋研究所,山东 青岛 266071)
海水pH对颗石藻生长以及二甲基硫产生的影响❋
于 娟1, 赵丽军1, 杨桂朋1, 田继远2❋❋, 刘 伟3, 许超平1
(1. 中国海洋大学海洋化学理论与工程技术教育部重点实验室,山东 青岛 266100;2. 青岛农业大学食品科学与工程学院,山东 青岛266109;3. 中国科学院海洋研究所,山东 青岛 266071)
海洋酸化是目前海洋环境所面临的严峻问题之一,而钙化藻-颗石藻(Emilianiahuxleyi)是大洋中二甲基硫(Dimethylsulfide, DMS)产生的主要藻种。本文初步研究了3种海水pH(8.1、7.9、7.7)对颗石藻生长、细胞直径以及DMS/DMSP(Dimethylsulfoniopropionate,二甲基巯基丙酸内盐)产生的影响。研究结果表明3种pH(8.1、7.9、7.7)条件下颗石藻的细胞密度、比生长率没有显著差异,颗石藻培养第10天的扫描电镜细胞形态以及藻细胞直径测定结果显示,pH=7.9和pH=7.7的颗石藻直径比pH=8.1的颗石藻直径显著降低;颗石藻DMS总量、单细胞DMS/单细胞DMSP产量在3种pH(8.1、7.9、7.7)中两两之间没有显著差异;而pH=7.7的DMSP总量显著低于pH=8.1的DMSP总量。Pearson相关分析结果表明,细胞分裂导致3种pH的单细胞DMSP含量与细胞密度、比生长率均呈负相关,3种pH的总DMS/总DMSP含量与细胞密度均呈正相关。CO2浓度升高引起的海洋酸化不仅导致pH降低,而且海水中的碳酸盐体系也会发生变化,因此本实验结果外推到现实环境时还要考虑碳酸盐体系变化对DMS产生的影响。
颗石藻; pH; DMS; DMSP
人类对化石能源的消耗导致大气CO2浓度从工业革命前的0.028kPa增加至现在的0.04kPa[1]。海洋是大气CO2最大的库之一,大约1/3大气CO2通过海气交换被海洋吸收[2],由此改变海水碳酸盐平衡并且降低海水pH。与工业革命前相比,目前海水表层pH降低了0.1个单位[3],到本世纪末估计会降低0.4个pH单位[4]。大气CO2浓度升高导致的海洋酸化对海洋生态系统尤其是钙化生物(如珊瑚、有孔虫、颗石藻等)产生了极大的威胁。
二甲基硫是一种重要的生源硫气体,DMS的释放能够形成云凝结核(Cloud Condensation Nuclei,CCN),将会对全球温室效应产生负反馈[5]。DMSP是DMS的前身,DMSP能够经DMSP裂解酶按照1∶1的比例分解成DMS和丙烯酸盐。DMSP在海洋中主要来源于浮游植物[6],而各种浮游植物的DMSP含量具有很大差别,颗石藻(Emilianiahuxleyi)和棕囊藻(Phaeocystis)是DMSP的主要生产者。DMSP的合成受许多因素的影响,如光照、盐度、温度、氮限制等[7-9]。有关浮游植物DMSP的合成或DMS的产生目前国外的研究主要涉及的浮游植物有颗石藻[7,10]、棕囊藻[11-12],包括现场实验、实验室培养和围隔实验,而国内目前主要局限于实验室培养,主要研究了各种理化因子对颗石藻、棕囊藻、赤潮藻、旋链角毛藻和小普林藻等的DMS产生的影响,并研究了藻在不同生长时期DMS/DMSP的产生规律,探讨了制约DMS/DMSP产生的影响因素[13-19]。颗石藻是一种钙化藻,是主要的碳酸盐制造者,其独特的生理生态功能对全球气候变化具有重要影响,在海洋碳循环过程中扮演着重要角色。研究表明,海洋酸化对颗石藻的生长、光合作用、钙化率等均会产生一定的影响[20-21],Gao等[21]指出,pH降低会导致颗石藻细胞大小、颗石层厚度和钙化率减小。海洋酸化对颗石藻生理生化的影响进一步影响DMS(P)产量,近几年国外学者开始关注海洋酸化对DMS(P)生物地球化学循环的影响,但研究结果并不一致,海洋酸化(或CO2浓度升高)可能会导致浮游植物DMSP浓度降低、升高或没有明显变化[22-24]。截止目前,海洋酸化对颗石藻DMS产生的影响及作用机制尚不明确。
为此,本论文研究了不同pH(8.1、7.9和7.7)条件下,颗石藻在生长周期内的生长、DMS/DMSP释放的情况,对于了解颗石藻对海洋酸化的响应以及预测碳循环、硫循环及未来全球气候变化具有深远意义。
1 材料与方法
1.1 实验藻种及藻的培养
实验所用颗石藻Emilianiahuxleyi由中国海洋大学化学化工学院海洋界面化学实验室提供。预实验结果表明人工海水培养的颗石藻生长状态优于天然海水培养的颗石藻,所以本实验采用人工海水培养颗石藻。2 000 mL三角烧瓶中加入1 500 mL人工海水在121 ℃高压灭菌20 min后加入f/2培养基,接入指数生长期的颗石藻使其接种密度大约为0.6×108cells/L,将藻液置于光照培养箱中连续培养。培养条件为:明暗周期为12 h∶12 h,光照强度为4 000 lx,温度为(15±0.5)℃,每天定时摇瓶。
1.2 pH的测定与调节
根据Hama[25]报道,在培养液中充入浓度为800×10-6和1200×10-6的CO2,15 d内培养液的pH分别在7.76~7.85和7.61~7.70范围内波动。所以,本研究设定3个pH水平(8.1、7.9、7.7),将颗石藻接入3种pH的培养液中,每天用pH计(梅特勒-托利多仪器(上海)有限公司)测定并监测培养液的pH,用0.1 moL·L-1盐酸和0.1 moL·L-1的氢氧化钠调节pH,使pH分别为7.7、7.9、8.1,使1 d的pH波动保持在0.08个pH单位。
1.3 藻细胞密度和比生长率的测定
取1 mL藻液,加入鲁戈氏碘液固定藻细胞,在光学显微镜下用血球计数板进行计数。
比生长率按以下公式计算:μ=ln(Cn/C0)/(Tn-T0),其中,μ为比生长率;Cn和C0分别代表第n和第0天的细胞密度;Tn和T0分别代表培养第n和第0天。
1.4 细胞形态的扫描电镜观察以及细胞直径的测定
颗石藻生长到第10天,将50 mL藻液离心,取藻泥用戊二醛固定,酒精梯度脱水,用100%乙酸异戊酯置换2次,放入临界点干燥仪(日立HCP-2)中干燥,再真空喷金(日立IB.3),用扫描电镜(KYKY2800B)观察并拍照。
藻细胞直径的测定:颗石藻生长到第10天,用目镜测微尺测定至少50个颗石藻的细胞直径,取其平均值。
1.5 DMS和DMSP的测定
1.5.1 藻液中DMS含量的测定 参照Yang等[26]的DMS测定方法进行测定。采用吹扫捕集-冷阱富集前处理技术,将一定体积的原藻液或者稀释后的藻液样品用玻璃注射器注入气提室,用高纯氮气将藻液中的DMS吹扫出来,经干燥管干燥后进入浸在液氮中的捕集管中浓缩,再经过沸水浴加热解析。解析出来的气体被载气携带进入气相色谱仪(GC-14B,日本岛津),最后用火焰光度检测器(FPD)进行检测。
1.5.2 藻液中DMSP含量的测定 取10 mL藻液置于40 mL棕色小瓶中并加入2 mL 10 mol·L-1的NaOH溶液,避免顶空(加蒸馏水除顶空)置于4 ℃冷藏环境下将DMSP碱解至少24 h后测定其中的DMS含量。DMSP的浓度为碱解后测得的样品瓶中DMS浓度减去未碱解藻液中测得的DMS浓度。
1.6 数据分析
颗石藻生长和DMS(P)产生实验设定3个平行样,将不同pH的细胞密度、DMS/DMSP用SPSS 11.5软件进行paired samplet-检验。
2 结果
2.1 海水pH对颗石藻细胞密度、比生长率的影响
pH=7.7和pH=7.9条件下培养的颗石藻在4~14 d之间处于指数生长期,而pH=8.1在4~12 d之间处于指数生长期。pH=7.7、pH=7.9、pH=8.1的藻细胞密度持续增加,分别在第14、14、12天达到最高值(pH=7.7,13.7×108cells/L;pH=7.9,12.2×108cells/L;pH=8.1,14.2×108cells/L),随后,颗石藻达到平台期或衰亡期,藻细胞密度保持稳定或降低(见图1A)。pH=7.7、pH=7.9、pH=8.1的藻细胞密度两两之间均没有显著差异(P>0.05)。
在0~4 d内,3种pH条件下培养的颗石藻的比生长率(μ)快速增加。pH=7.7与pH=7.9的比生长率在4~20 d中逐渐降低,而pH=8.1的比生长率在0~8 d逐渐升高,在8~20 d逐渐降低。pH=7.7、pH=7.9、pH=8.1培养的颗石藻分别在第4、4、8天时比生长率达到最大值,依次为0.323、0.368、0.314(见图1B)。pH=7.7、pH=7.9、pH=8.1的比生长率两两之间均没有显著差异(P>0.05)。
2.2 海水pH对颗石藻细胞形态和直径的影响
3种pH(7.7、7.9、8.1)处理的颗石藻扫描电镜细胞形态结果中,颗石藻呈卵球状,细胞膜外包有黏胶质外层,且表面有微小的晶体薄片(即颗石),由于黏胶质外层未完全脱落所以颗石片层结构不是很明显(见图2)。pH=7.7、pH=7.9、pH=8.1的颗石藻的平均直径依次为2.7、2.7和3.2 μm,pH=7.7和pH=7.9的颗石藻的平均直径显著低于pH=8.1的颗石藻平均直径(P<0.05)。
2.3 海水pH对颗石藻DMS与DMSP产量的影响
2.3.1 海水pH对颗石藻总DMS产量的影响 随着颗石藻培养时间的增长,总DMS产量有不断升高的趋势。pH为7.7、7.9、8.1的颗石藻的总DMS产量的变化范围为6.1~241.3、9.5~230.3、8.6~287.7 nmol·L-1(见图3A),第20天的总DMS产量分别是第0天的总DMS产量的39.6、24.2、33.5倍。总DMS产量在pH=7.7与pH=7.9、pH=7.7与pH=8.1、pH=7.9与pH=8.1之间均没有显著差异(P>0.05)。
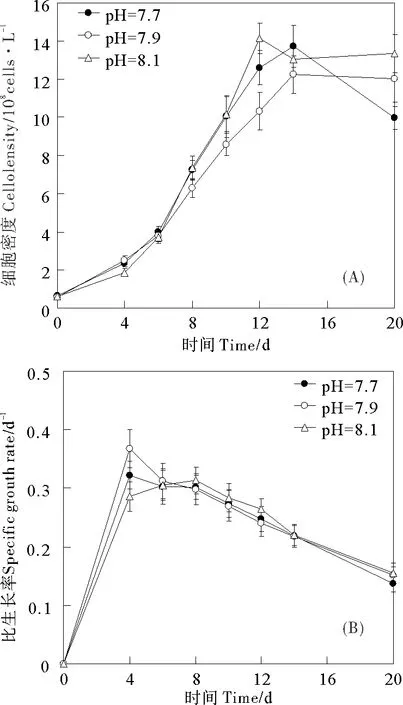
图1 3种pH下颗石藻细胞密度(A)和比生长率(B)的变化
pH为7.7、7.9、8.1条件下培养的颗石藻单细胞DMS产量变化范围依次为(0.09~0.35)、(0.05~0.19)、(0.04~0.22)×10-15mol/cell,并且在0~20 d内没有明显的变化规律,但3种pH的单细胞DMS的释放量变化趋势基本一致,都表现为衰亡期的单细胞DMS产量比对数生长期的单细胞DMS产量升高(见图3B)。单细胞DMS的释放量在3种pH两两之间均无显著差异(P>0.05)。
2.3.2 海水pH对颗石藻藻液中DMSP含量的影响 pH为7.7、7.9、8.1条件下颗石藻的总DMSP含量变化范围依次为8.1~2581.2、4.4~4 895.0、6.7~4 753.4 nmol·L-1,并且在初始阶段总DMSP含量都是持续升高,分别在第8、6、8天达到峰值,随后总DMSP浓度下降、再升高(见图4A)。颗石藻的总DMSP含量在pH=7.7与pH=7.9、pH=7.9与pH=8.1之间都没有显著差异(P>0.05),而pH=7.7的总DMSP含量显著低于pH=8.1的总DMSP含量(P<0.05)。
3种pH(7.7、7.9、8.1)条件下颗石藻单细胞DMSP含量的变化范围依次为(0.009 6~1.45)、(0.053~2.83)、(0.019~1.89)×10-15mol/cell,并且在0~6 d内逐渐降低,在第6天达到最小值,在6~20 d颗石藻单细胞释放DMSP的量呈现升高、降低、再升高的变化规律(见图4B)。颗石藻单细胞释放DMSP的量在3种pH两两之间均无显著差异(P>0.05)。

图2 3种pH培养第10天的颗石藻的扫描电镜结果
2.4 相关性分析
Pearson相关性分析结果表明,3种pH条件下单细胞DMSP含量与细胞密度、比生长率均呈负相关。其中,pH=7.7和pH=8.1时,单细胞DMSP含量与细胞密度呈显著负相关(P<0.05);pH=7.9和pH=8.1时,单细胞DMSP含量与比生长率呈显著负相关(P<0.05)。3种pH的总DMS/总DMSP含量与细胞密度均呈正相关,其中,pH=7.9时,总DMS含量与细胞密度呈极显著正相关(P<0.01)(见表1、2、3)。

图3 3种pH条件培养的颗石藻总DMS含量
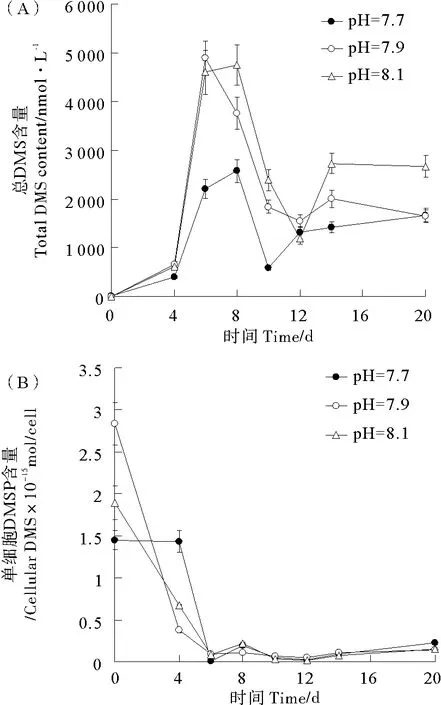
图4 3种pH条件下颗石藻总DMSP

细胞密度Celldensity比生长率Specificgrowthrate总DMSTotalDMS总DMSPTotalDMSP单细胞DMSCellularDMS单细胞DMSPCellularDMSP细胞密度Celldensity1比生长率Specificgrowthrate0.1971总DMStotalDMS0.381-0.0381总DMSPtotalDMSP0.3260.4490.2961单细胞DMSCellularDMS-0.3320.0940.560-0.2001单细胞DMSPCellularDMSP-0.769*-0.397-0.198-0.7030.5731
Note:*代表在0.05显著性水平下显著相关(双尾检验)。*Correlation is significant at the 0.05 level (2-tailed).
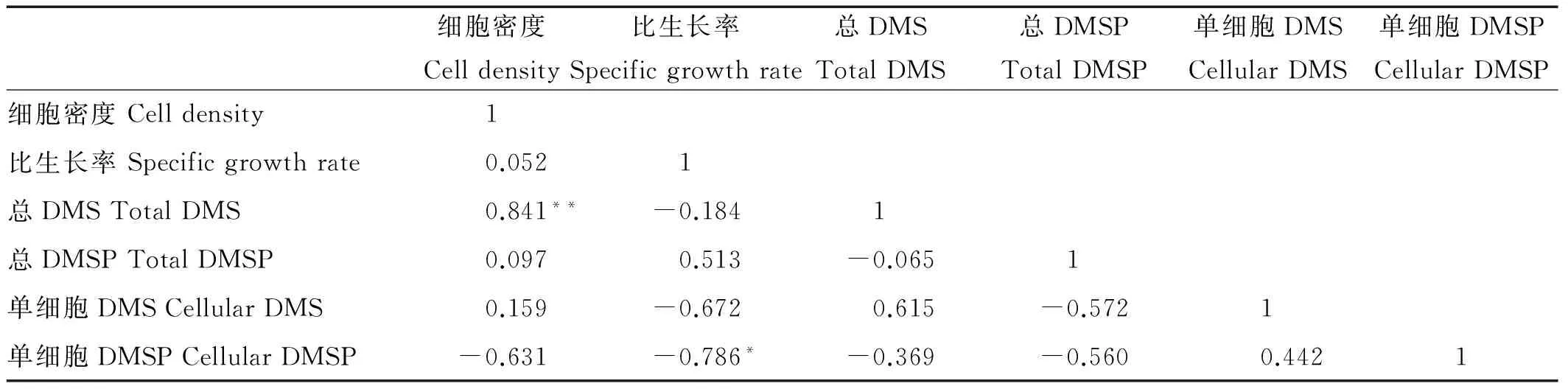
表2 pH=7.9条件下的各参数相关性分析
Note:**代表在0.01显著性水平下显著相关(双尾检验)。**Correlation is significant at the 0.01 level (2-tailed).*代表在0.05显著性水平下显著相关(双尾检验)。*Correlation is significant at the 0.05 level (2-tailed).
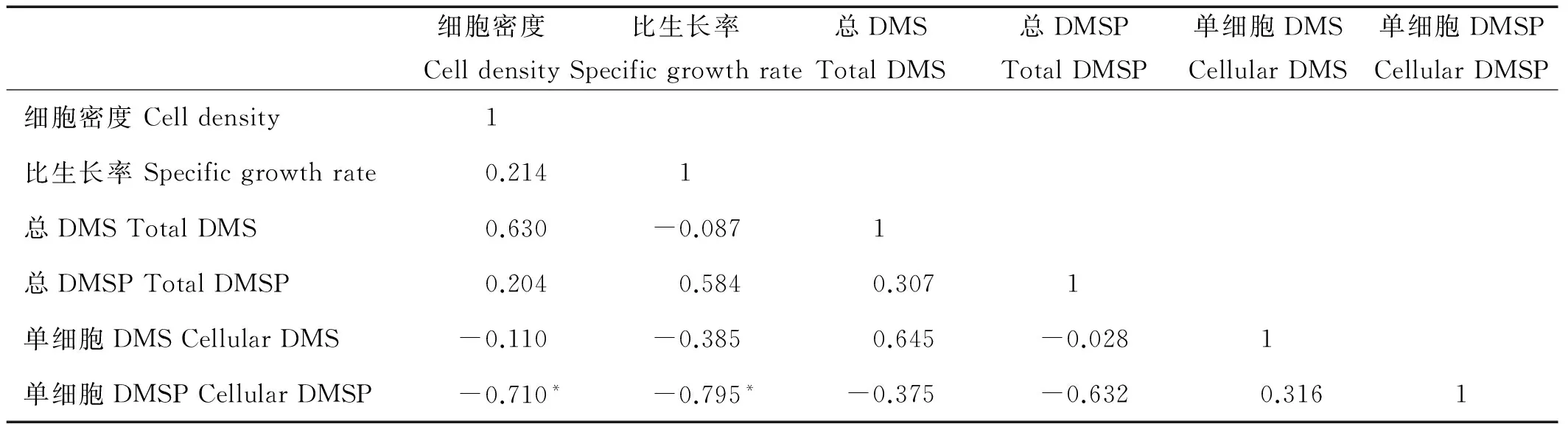
表3 pH=8.1条件下的各参数相关性分析
Note:*代表在0.05显著性水平下显著相关(双尾检验)。*Correlation is significant at the 0.05 level (2-tailed).
3 讨论
3.1 生长周期内DMS/DMSP的变化规律
结果显示颗石藻总DMS/总DMSP产量与细胞密度均呈正相关,这与以往的研究报道相吻合[7,27],后者通过连续培养和围隔实验研究表明颗石藻DMS总量与叶绿素a含量、DMSP总量与细胞密度密切相关。本文所测的3种pH(7.7、7.9、8.1)的颗石藻单细胞DMSP含量的变化范围依次为(0.009 6~1.45)、(0.053~2.83)、(0.019~1.89)×10-15mol/cell;而Steinke等[28]研究结果表明6株颗石藻的单细胞DMSP含量范围为(3.6~18.9)×10-15mol·cell-1,本文单细胞DMSP含量比Steinke等[28]报道的单细胞DMSP含量偏小的原因是不同藻种、环境条件都会对单细胞DMSP含量产生明显影响[7,29-30]。藻细胞生长阶段对DMS(P)的产量也有影响。Stefels和van Boekel[31]研究发现棕囊藻Phaeocystissp.在静止期的单细胞DMSP含量高于指数生长期。本文结果显示不同生长时期单细胞DMS产量不同,指数生长期的单细胞DMS产量少,而生长衰亡期的单细胞DMS产量多,这主要是因为细胞衰亡时,细胞壁破裂,DMSP裂解酶释放出来并间接导致DMS的产量增加。3种pH的单细胞DMSP含量与细胞密度、比生长率均呈负相关的原因可能是由于随着细胞分裂的加快,细胞密度和比生长率的增加导致单细胞DMSP含量下降。
3.2 海水pH对颗石藻生长、DMS的影响
对照组(pH未用酸碱进行调节)颗石藻藻液中的pH随时间延长,由初始值8.124逐渐升高,在第8天达到最大值(9.490),在第8~14天pH在9.490~9.429之间变化,随后降低,pH在第20天降为8.918,但仍显著高于初始值(P<0.05)(见图5)。因此,颗石藻的生长使海水中H+浓度降低、pH升高,使海水“碱化”。处理组在实验期间必须添加H+以维持恒定的pH值。这与部分颗石藻细胞表面胶质层脱落、露出钙化结构的扫描电镜结果是吻合的。
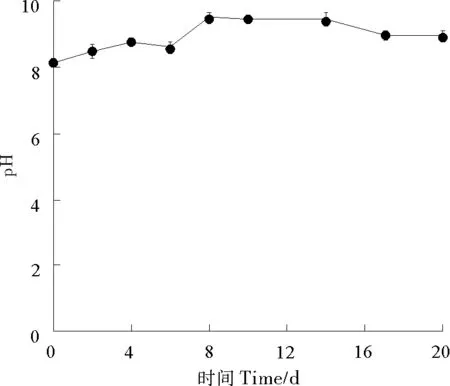
图5 对照组颗石藻藻液的pH变化
颗石藻的细胞密度和比生长率在3种pH条件下两两之间没有显著差异,说明pH变化对颗石藻的生长影响不明显。Tortell等[32]研究指出3种CO2浓度(100、350和800×10-6)对培养实验中浮游植物的生长速率没有显著差异,与本文结果相近。研究表明,CO2浓度升高对颗石藻光合作用的影响具有种间差异性,CO2浓度升高会促进颗石藻E.huxleyi的光合作用[20],而对颗石藻Calcidiscusleptoporus和Coccolithuspelagicus的光合作用没有明显影响[33]。因此,导致本实验3种pH对颗石藻的生长影响差异不显著的原因也可能与藻种不同或者仅仅是pH变化有关。本实验中的颗石藻直径与Gao等[21]测定的颗石藻直径存在差异,可能是颗石藻不同株系导致的。在本文实验中,海水酸化使颗石藻直径降低,这与Gao等[21]的结果类似,他们的研究结果表明pH=7.9和7.6时颗石藻的钙化率降低,pH=7.9和7.6的颗石层厚度比pH=8.2的颗石层厚度显著降低。
除了pH=7.7时颗石藻的总DMSP浓度显著低于pH=8.1时的总DMSP浓度(P<0.05)以外,本实验中颗石藻总DMS/单细胞DMS(P)产量在3种pH两两之间没有显著差异(P>0.05)。目前国外科学工作者对海洋酸化是否会影响DMS释放的问题一直以来存在争议,如Hopkins等[22]通过围隔实验研究表明,与低浓度CO2(380×10-6)相比,高浓度CO2(750×10-6)显著降低DMS和DMSP浓度;而Vogt等[24]发现高浓度CO2(700/1050×10-6)条件下的溶解态DMSP或DMS与浓度为350×10-6的CO2相比没有显著变化。本文研究结果与Vogt等[24]的结果基本吻合。Archer等[23]在北极水域的30 d实验结果表明,海洋酸化导致DMS浓度降低、DMSP浓度升高,从而导致DMS/DMSP比值降低。与Archer等[23]的结果不同,本文结果显示3种pH两两之间的DMS/DMSP比值没有显著变化(P>0.05),可能与实验方法不同有关。每一种酶仅在特定的、比较窄的pH范围内有活性,并且在最适pH显示最大的活性。Steinke等[28]研究表明,pH对不同株系颗石藻DMSP裂解酶活性的影响不同,E.huxleyi373/379、E.huxleyi374/1516分别在pH=6、pH=5时DMSP裂解酶活性最大,而E.huxleyi370的DMSP裂解酶活性在pH=2~8的范围内随pH升高而升高。海洋环境中的DMSP裂解酶来源于浮游植物、海洋细菌等[28,34],而海洋酸化会对浮游植物组成、细菌生物量以及生物多样性产生影响。Tortell和Morel[35]研究了CO2浓度对赤道太平洋浮游植物群落的影响,结果表明CO2浓度为150×10-6和750×10-6时浮游植物群落在培养初期多样性丰富(含有大约等生物量的硅藻、定鞭金藻、隐藻、青绿藻、甲藻),而培养3 d后浮游植物均以硅藻为优势种(生物量大约占90%),但2种CO2浓度之间的浮游植物种类组成没有显著差异。因此,不同浮游植物对海洋酸化的敏感性是不同的,海洋酸化对海洋生物的影响必然会对现实环境中DMS(P)的产量产生影响。但海洋酸化对DMS释放的影响到底是积极的还是消极的?其作用机制到底是什么?这些问题仍需在围隔实验和实验室培养方面进行深入研究并综合考虑多种因素。
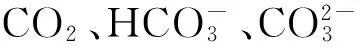
4 结论
(1)3种不同pH(7.7、7.9、8.1)对颗石藻的细胞密度、比生长率的影响没有显著差异;扫描电镜结果显示部分颗石藻细胞表面胶质层脱落、露出钙化结构,pH=7.7和pH=7.9条件下颗石藻直径显著低于pH=8.1下的颗石藻直径(P<0.05)。
(2)pH=7.7条件下颗石藻的总DMSP浓度显著低于pH=8.1下的总DMSP浓度(P<0.05);颗石藻DMS总量、单细胞DMS产量以及单细胞DMSP产量在3种pH(7.7、7.9、8.1)条件下两两之间没有显著差异(P>0.05)。本实验结果外推到现实环境时还要考虑碳酸盐体系以及食物链关系变化对DMS产生的影响。
[1] Solomon S, Qin D, Manning M, et al. Climate Change 2007: The Physical Science Basis: Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change [M]. New York: Cambridge University Press, 2007.
[2] Sabine C L, Feely R A, Gruber N, et al. The oceanic sink for anthropogenic CO2[J]. Science, 2004, 305: 367-371.
[3] Orr J C. Anthropogenic ocean acidification over the twenty-first century and its impact on calcifying organisms [J]. Nature, 2005, 437: 681-686.
[4] Caldeira K, Wickett M E. Anthropogenic carbon and ocean pH [J]. Nature, 2003, 425: 365.
[5] Charlson R J, Lovelock J E, Andreae M O, et al. Oceanic phytoplankton, atmospheric sulphur, cloud albedo and climate [J]. Nature, 1987, 326: 655-661.
[6] Kirst G O, Thiel C, Wolff H, et al. Dimethylsulfoniopropionate (DMSP) in ice algae and its possible biological role [J]. Marine Chemistry, 1991, 35: 381-388.
[7] Van Rijssel M, Gieskes W W C. Temperature, light, and the dimethylsulfoniopropionate (DMSP) content ofEmilianiahuxleyi(Prymnesiophyceae) [J]. Journal of Sea Research, 2002, 48: 17-27.
[8] Cuhel R L, Lean D R S. Influence of light intensity, light quality temperature and daylength on uptake and assimilation of carbon dioxide and sulfate by lake plankton [J]. Canadian Journal of Fisheries and Aquatic Sciences, 1987, 44: 2118-2132.
[9] Stefels J. Physiological aspects of the production and conversion of DMSP in marine algae and higher plants [J]. Journal of Sea Research, 2000, 43: 183-197.
[10] Wolfe G V, Steinke M. Grazing-activated production of dimethyl sulfide (DMS) by two clones ofEmilianiahuxleyi[J]. Limnology and Oceanography, 1996, 41(6): 1151-1160.
[11] Stefels J, Gieskes W W C, Dijkhuizen L. Biological and Environmental Chemistry of DMSP and Related Sulfonium Compounds [M]. New York: Plenum Press, 1996: 305-315.
[12] Verity P G, Brussaard C P, Nejstgaard J C, et al. Current understanding ofPhaeocystisecology and biogeochemistry, and perspectives for future research [J]. Biogeochemistry, 2007, 83: 311-330.
[13] 欧阳丽佳, 高亚辉, 林荣澄, 等. 球石藻在不同温度和盐度下产二甲基硫(DMS)的研究 [J]. 厦门大学学报, 2006, 45(sup.): 221-224.
[14] 王艳, 齐雨藻, 沈萍萍, 等. 温度和盐度对球形棕囊藻细胞DMSP产量的影响 [J]. 水生生物学报, 2003, 27(4): 367-371.
[15] 李猛, 袁东星, 林庆梅. 三种典型赤潮藻产生与消耗二甲基硫化物的速率估算 [J].应用生态学报, 2007, 18(8): 1843-1848.
[16] 朱蓉, 杨桂朋, 于娟, 等. 不同氮磷比及铁浓度对球形棕囊藻二甲基硫和二甲巯基丙酸内盐生产的影响 [J]. 中国海洋大学学报: 自然科学版, 2013, 43(10): 67-75.
[17] Shen P, Qi Y, Wang Y, Huang L.PhaeocystisglobosaScherffel, a harmful microalga, and its production of dimethylsulfoniopropionate [J]. Chinese Journal of Oceanology and Limnology, 2011, 29(4): 869-873.
[18] 高原, 朱蓉, 杨桂朋, 等. 旋链角毛藻和小普林藻对二甲基硫和二甲巯基丙酸的释放研究 [J]. 中国海洋大学报: 自然科学版, 2012, 42(12): 59-64.
[19] Zhuang G C, Yang G P, Yu J, et al. Production of DMS and DMSP in different physiological stages and salinity conditions in two marine algae [J]. Chinese Journal of Oceanology and Limnology, 2011, 29(2): 369-377.
[20] Riebesell U, Zondervan I, Rost B, et al. Reduced calcification of marine plankton in response to increased atmospheric CO2[J]. Nature, 2000, 407: 364-367.
[21] Gao K, Ruan Z, Villafane V E, et al. Ocean acidification exacerbates the effect of UV radiation on the calcifying phytoplankterEmilianiahuxleyi[J]. Limnology and Oceanography, 2009, 54(6): 1855-1862.
[22] Hopkins F E, Turner S M, Nightingale P D, et al. Ocean acidification and marine trace gas emissions [J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(2): 760-765.
[23] Archer S D, Kimmance S A, Stephens J A, et al. Contrasting responses of DMS and DMSP to ocean acidification in Arctic waters [J]. Biogeosciences Discussions, 2012, 9: 12803-12843.
[24] Vogt M, Steinke M, Turner S, et al. Dynamics of dimethylsulphoniopropionate and dimethylsulphide under different CO2concentrations during a mesocosm experiment [J]. Biogeosciences, 2008, 5: 407-419.
[25] Hama T, Kawashima S, Shimotori K, et al. Effect of ocean acidification on coastal phytoplankton composition and accompanying organic nitrogen production [J]. Journal of Oceanography, 2011, 68(1): 183-194.
[26] Yang G P, Zhang H H, Zhou L M, et al. Temporal and spatial variations of dimethylsulfide (DMS) and dimethylsulfoniopropionate (DMSP) in the East China Sea and the Yellow Sea [J]. Continental Shelf Research, 2011, 31(13): 1325-1335.
[27] Steinke M, Evans C, Lee G A, et al. Substrate kinetics of DMSP-lyases in axenic cultures and mesocosm populations ofEmilianiahuxleyi[J]. Aquatic Sciences, 2007, 69: 352-359.
[28] Steinke M, Wolfe G V, Kirst G O. Partial characterisation of dimethylsulfoniopropionate (DMSP) lyase isozymes in 6 strains ofEmilianiahuxleyi[J]. Marine Ecology Progress Series, 1998, 175: 215-225.
[29] Archer S D, Ragni M, Webster R, et al. Dimethyl sulfoniopropionate and dimethyl sulfide production in response to photoinhibition inEmilianiahuxleyi[J]. Limnology and Oceanography, 2010, 55: 1579-1589.
[30] Stefels J, van Leeuwe M A. Effects of iron and light stress on the biochemical composition of AntarcticPhaeocystissp. (Prymnesiophyceae). I. Intracellular DMSP concentrations [J]. Journal of Phycology, 1998, 34: 486-495.
[31] Stefels J, van Boekel W H M. Production of DMS from dissolved DMSP in axenic cultures of the marine phytoplankton speciesPhaeocystissp. [J]. Marine Ecology Progress Series, 1993, 97: 11-18.
[32] Tortell P D, Rau G H, Morel F M M. Inorganic carbon acquisition in coastal Pacific phytoplankton communities [J]. Limnology and Oceanography, 2000, 45(7): 1485-1500.
[33] Langer G, Geisen M, Baumann K-H, et al. Species-specific responses of calcifying algae to changing seawater carbonate chemistry [J]. Geochemistry Geophysics Geosystems, 2006, 7: Q09006.
[34] Yoch D C, Ansede J H, Rabinowitz K S. Evidence for intracellular and extracellular dimethylsulfoniopropionate (DMSP) lyases and DMSP uptake sites in two species of marine bacteria [J]. Applied and Environmental Microbiology, 1997, 63: 3182-3188.
[35] Tortell P D, Morel F M M. Sources of inorganic carbon for phytoplankton in the eastern Subtropical and Equatorial Pacific Ocean [J]. Limnology and Oceanography, 2002, 47(4): 1012-1022.
[36] Bach L T, Riebesell U, Schulz K G. Distinguishing between the effects of ocean acidification and ocean carbonation in the coccolithophoreEmilianiahuxleyi[J]. Limnology and Oceanography, 2011, 56(6): 2040-2050.
责任编辑 徐 环
The Influence of Seawater pH on the Growth and Dimethylsulfide Production ofEmilianiahuxleyi
YU Juan1, ZHAO Li-Jun1, YANG Gui-Peng1, TIAN Ji-Yuan2, LIU Wei3, XU Chao-Ping1
(1.The Key Laboratory of Marine Chemistry Theory and Technology, Ministry of Education, Ocean University of China, Qingdao 266100, China; 2.College of Food Science and Engineering, Qingdao Agricultural University, Qingdao 266009, China; 3.Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China)
Ocean acidification is one of the serious problems currently faced by marine environment, and calcifid alga-Emilianiahuxleyiis the primary alga to produce dimethylsulfide (DMS) in the ocean. This paper preliminary investigated the changes of the growth, cell diameter and the production of DMS and dimethylsulfoniopropionate (DMSP) forE.huxleyiat three levels of pH (8.1, 7.9 and 7.7). The results showed that the cell densities and specific growth rates among three pH levels had no significant effects, respectively. Cell morphology observation results in scanning electron microscopy (SEM) at day 10 and the diameter results ofE.huxleyiindicated that the diameters of pH=7.7 and pH=7.9 were obviously lower than those of pH=8.1. Total DMS, cellular DMS/cellular DMSP production ofE.huxleyiamong three pH levels (8.1, 7.9, 7.7) had no significant effects; while total DMSP concentrations of pH=7.7 were significantly lower than those of pH=8.1. Pearson correlation between cellular DMSP contents and specific growth rates/cell densities was negative, which might be due to cell lysis. There were positive correlations between total DMS/total DMSP contents and cell densities for three levels of pH. Increasing CO2not only caused the decrease of pH, but also changed the carbonate system in the seawater. Therefore, when we put these results to the natural environment, the effects of carbonate system and food chain changes on the DMS production should be considered.
Emilianiahuxleyi; pH; DMS; DMSP
国家自然科学基金创新研究群体项目(41221004);国家自然科学基金重大国际合作研究项目(41320104008);国家自然科学基金项目(41030858;41106122);山东省自然科学基金项目(ZR2011DQ005);国家海洋局近岸海域生态环境重点实验室资助项目(201306)资助
2014-01-10;
2014-03-18
于 娟(1973-),女,副教授。E-mail:yuetian@ouc.edu.cn。
❋❋ 通讯作者: E-mail: jytian_75@@qau.edu.cn
P734.5
A
1672-5174(2015)02-072-08
10.16441/j.cnki.hdxb.20140007

