益生菌和有机硒对日本鳗鲡生长性能·抗氧化水平及溶菌酶活力的影响
刘振兴,周结珊,马艳平,郝 乐,马江耀,梁志凌,柯 浩
(广东省农业科学院动物卫生研究所,广东省兽医公共卫生公共实验室,
广东省畜禽疫病防治研究重点实验室,广东广州510640)
1 材料与方法
1.1 试验材料 试验所用益生菌为广东省农业科学院动物卫生研究所水产病害研究室分离并鉴定的鳗鲡肠道源益生菌菌株:长孢娄徳酵母(Y1株)、乳明串珠菌(L1株)和枯草芽孢杆菌(B.S1株)。日本鳗鲡幼鱼及全价饲料(作为基础饲料)购自东莞市银华鳗鱼养殖有限公司。谷胱甘肽过氧化物酶(GPx)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、一氧化氮(NO)、丙二醛(MDA)和蛋白定量试剂盒(BCA法),均购自南京建成生物工程研究所。
1.2 试验方法
1.2.1 富硒酵母(Se-Y1)的制备。Y1按照1∶9接种于YEPD液体培养基(Na2SeO3浓度为20μg/ml),发酵培养36 h,制成富硒酵母Se-Y1,参照郝素娥等[6]的方法测定其生物量及菌体硒含量,并计算硒转化率。
1.2.2 养殖试验设计。选择192尾初始体重(17.60 ±3.83)g的鳗鲡,随机分为4个试验组,每组3个平行,每个平行16尾。对照组投喂基础饲料;试验Ⅰ组在基础饲料中添加终浓度分别为109cfu/g的长孢娄德酵母、乳明串球菌、枯草芽孢杆菌;试验组Ⅱ、Ⅲ的投喂饲料中乳明串珠菌、枯草芽孢杆菌含量与试验Ⅰ组相同,通过调整Se-Y1和Y1比例,使饲料中酵母总浓度为109cfu/g,有机硒含量分别为0.4和0.8 mg/kg。每天投喂2次(9:00和17:00),养殖水温24~25℃,溶氧量大于 5 mg/L,pH 7.5 ~8.5,总氨氮含量大于 0.5mg/L。
1.2.3 生长性能测定。分别于试验开始时和第45、125天计算增重率、特定生长率和饵料系数,计算公式如下:
增重率(WGR,%)=(Wt-W0)×100/W0(1)
特定生长率(SGR,%)=(ln Wt-ln W0)×100/t (2)
饵料系数(FCR)=Wf/(Wt-W0) (3)
式中,Wt为终末体质量(g),W0为初始体质量(g),Wf为饲料投喂总量(g),t为饲养天数。
1.2.4 抗氧化水平测定。于试验的第45、125天在每个平行中随机抽取3尾鳗鲡,采集肝脏和血液。肝脏采用0.86%生理盐水制备10%的匀浆,1 500×g4℃离心10 min,匀浆上清采用BCA法(鼎国生物)检测蛋白浓度,-80℃下保存;血液采集后室温放置1 h,1 500×g 4℃离心10 min分离血清,-80℃下保存。采用南京建成生物工程研究所试剂盒检测上述样品的GPx、SOD、CAT酶活以及NO、MDA水平。
1.2.5 溶菌酶活性检测。上述肝脏匀浆上清和血清样品参照肖克宇等[7]的方法检测溶菌酶活性。
1.2.6 数据处理。试验数据采用SPSS l3.0软件进行统计与分析,方差齐性时进行Duncan’s多重比较,方差非齐性则采用Tamhane’ST2法进行方差分析。
2 结果与分析
2.1 Se-Y1发酵结果 制备的富硒酵母(Se-Y1)的生物量为(6.94 ±0.22)g/L,菌体硒含量为(1 446.90 ±7.36)μg/g,其中有机硒含量为(1 377.88 ±8.53)μg/g,有机硒转化率为95.24%。
2.2 益生菌和有机硒对鳗鲡生长性能的影响 由表1可知,饲料中添加复合益生菌投喂鳗鲡后,与对照组相比,鳗鲡0~45 d的特定生长率提高113.79%,增重率提高了132.8%,饵料系数(0~45 d)降低31.53%,但是饲料中以富硒酵母形式添加有机硒后影响了这种效果。
2.3 益生菌和有机硒对鳗鲡抗氧化水平的影响 由表2可知,投喂益生菌45 d后鳗鲡肝脏组织SOD、CAT的酶活值比对照组分别提高了41.86%和84.96%,组织中MDA和NO的浓度则显著下降,这表明益生菌可以提高鳗鲡肝脏抗氧化水平,降低氧化应激;试验结束时,尽管投喂益生菌对鳗鲡肝脏SOD、CAT酶活的促进作用消失,但还是显著降低了其中的MDA水平(表3)。酵母源有机硒的添加没有进一步提高益生菌的抗氧化调节作用。此外,益生菌及有机硒的添加也没有影响鳗鲡肝脏GPx的酶活,高剂量有机硒的长期投喂(125 d)有降低GPx酶活的趋势(表3)。
2.4 益生菌和有机硒对鳗鲡血清溶菌酶活性的影响 投喂益生菌45 d后鳗鲡血清溶菌酶活性提高了145%,有机硒的添加没有进一步提高溶菌酶活性,高浓度(0.8 mg/kg)有机硒抑制了益生菌对溶菌酶活性的促进作用。试验结束时,各组鳗鲡的血清溶菌酶活性维持在较高水平,组间差异不显著(表4)。
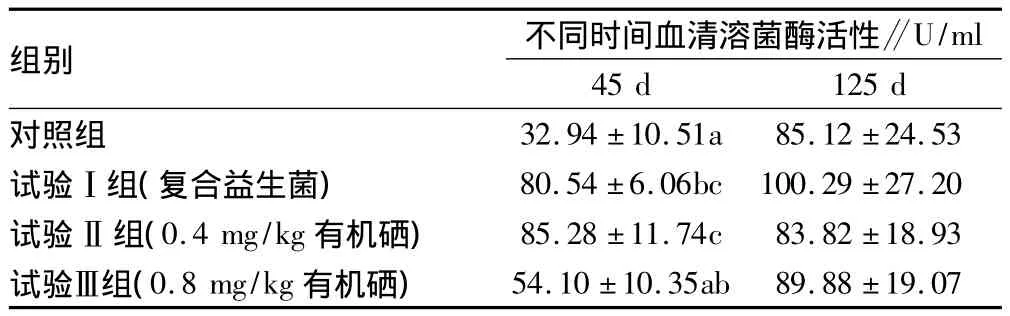
表4 日本鳗鲡肝血清溶菌酶活性的检测结果
3 讨论
在幼鳗生长早期,肠道源益生菌可以显著提高生长性能、抗氧化水平和溶菌酶活性。这可能基于以下原因:①试验采用的鳗鲡正处于稚鳗到幼鳗的发育阶段,是(由海水)进入淡水环境的初期阶段,这种理化环境的变化会影响鱼类肠道的菌群结构;在鱼类生长发育的早期,肠道也经历了不同菌群的定植与演替[8]。该研究采用的益生菌来源于成鳗肠道,属于正常菌群,投喂后促进了幼鳗肠道菌群结构的改变和/或平衡的建立。②在鱼类个体发育早期,消化道、免疫系统的发育尚未完善,尤其是肠道微生态平衡很容易受到干扰,通过投喂益生菌可以促进肠道微生态平衡的建立,发挥免疫调节等作用[9]。因此,在幼鳗生长早期,肠道源益生菌对提高幼鳗生长性能、抗氧化水平、免疫水平等发挥了积极作用。大量研究也证实,在仔鱼期投喂益生菌可以起到更好的效果[5,10-12]。
该研究中长期投喂肠道源益生菌不能显著改善鳗鲡的生长性能、抗氧化水平和溶菌酶活性。随着幼鳗对环境改变的适应,肠道菌群结构趋于稳定,益生菌对上述指标的促进作用消失。这与林煜[13]在欧洲鳗鲡益生菌免疫调节研究中的结果类似:对2年龄欧洲鳗鲡(Anguilla anguilla)投喂肠道源益生菌,不能提高吞噬活性、溶菌酶活性以及血清抗体水平,研究者认为,这是由于使用的益生菌为肠道正常菌群,因此没有表现出免疫刺激作用。
该研究中有机硒没有进一步提高益生菌的有益作用,0.8 mg/kg有机硒反而抑制了益生菌对鳗鲡特定生长率、GPx和溶菌酶活力的促进作用。一般认为,硒参与了GPx和硫氧还蛋白还原酶(Thioredoxin reductase,TR)的构成,对其酶活有促进作用;硒提高鱼类的生长性能以及抗氧化、免疫水平等在虹鳟(Oncorhynchus mykiss)、大西洋鲑(Salmo salar)、斑点叉尾鮰(Ictalurus punctatus)、异育银鲫(Carassius auratus gibelio)、鲤(Cyprinus carpio)等都得到广泛证实。上述试验中硒的添加量为0.2~0.4 mg/kg,有机硒也多以富硒酵母的形式添加[2,14]。但是很多研究也发现,硒(有机硒或无机硒)并没有提高GPx活性[15-16],过量添加有机硒甚至降低了血清GPx活性[14]。硒作为微量元素,过量添加会引起毒性效应[2,14,17]。该研究中添加 0.8 mg/kg 有机硒产生的不利影响可能是由于硒过量所致。此外,在鳗鲡不同发育阶段对硒的需求也可能存在差异,因此有必要进一步对不同发育阶段的鳗鲡有机硒需求量进行研究,0.4 mg/kg的添加剂量可以作为下一步优化有机硒添加剂量的参考值。
该研究证实了鳗鲡肠道源益生菌长孢娄徳酵母、乳明串珠菌、枯草芽孢杆菌在日本鳗鲡幼鳗生长早期可以提高其生长性能、抗氧化水平和溶菌酶活性,为生产中合理添加益生菌及节约成本提供了理论依据。
[1]MOHAPATRA S,CHAKRABORTY T,KUMAR V,et al.Aquaculture and stress management:a review of probiotic intervention[J].J Anim Physiol Anim Nutr(Berl),2013,97(3):405-430.
[2]KOUBA A,VELÍŠEK J,STARÁ A,et al.Supplementation with sodium selenite and selenium-enriched microalgae biomass show varying effects on blood enzymes activities,antioxidant response,and accumulation in common barbel(Barbus barbus)[J].Biomed Res Int,2014,http://dx.doi.org/10.1155/2014/408270.
[3]柯浩,刘振兴,曹艳林,等.富硒益生菌对罗非鱼幼鱼生长和抗氧化水平的影响[J].动物营养学报,2014,26(5):1229-1237.
[4]VERSCHUERE L,ROMBAUTG,SORGELOOSP,et al.Probiotic bacteria as biological control agents in aquaculture[J].Microbiol Mol Biol Rev,2000,64(4):655-671.
[5]LAUZON H L,GUDMUNDSDOTTIR S,STEINARSSON A,et al.Effects of bacterial treatment at early stages of Atlantic cod(Gadus morhua L.)on larval survival and development[J].JAppl Microbiol,2010,108(2):624-632.
[6]郝素娥,滕冰.硒酵母中硒含量测定方法研究[J].理化检验(化学分册),1999,35(4):151-153.
[7]肖克宇,邓时铭,向建国,等.水产动物免疫与应用[M].北京:科学出版社,2007:241-242.
[8]陈孝煊,吴志新,周文豪.鱼类消化道菌群的作用与影响因素研究进展[J].华中农业大学学报,2005,24(5):523-528.
[9]BIDHAN C D E,MEENA D K,BEHERA B K,et al.Probiotics in fish and shellfish culture:Immunomodulatory and ecophysiological responses[J].Fish Physiol Biochem,2014,40(3):921-971.
[10]LIM H J,KAPAREIKOD,SCHOTT E J,et al.Isolation and evaluation of new probiotic bacteria for use in shellfish hatcheries:I.Isolation and screening for bioactivity[J].JShellfish Res,2011,30(3):609-615.
[11]KAPAREIKOD,HYUN JL,ERIC JS,et al.Isolation and evaluation of new probiotic bacteria for use in shellfish hatcheries:II.Effects of a Vibrio sp.Probiotic candidate upon survival of oyster larvae(Crassostrea Virginica)in pilot-scale trials[J].JShellfish Res,2011 30(3):617-625.
[12]ARIGN,SUZERC,GOKVARDAR A,et al.Effectsof probiotic(Bacillus sp.)supplementation during larval development of Gilthead sea bream(Sparus aurata L.)[J].Turk J Fish Aquatic Sci,2013,13:407-414.
[13]林煜.二株鳗鲡益生菌对欧洲鳗鲡免疫应答的初步研究[J].福建水产,2006(4):44-47.
[14]COTTER PA,CRAIGSR,MCLEAN E.Hyperaccumulation of selenium in hybrid striped bass:A functional food for aquaculture?[J].Aquacult Nutr,2008,14(3):215-222.
[15]RIDER SA,DAVIESSJ,JHA A N,et al.Bioavailability of co-supplemented organic and inorganic zinc and selenium sources in a white fishmeal-based rainbow trout(Oncorhynchus mykiss)diet[J].JAnim Physiol Anim Nutr(Berl),2010,94(1):99-110.
[16]LORENTZEN M,MAAGE A,JULSHAMN K.Effects of dietary selenite or selenomethionine on tissue selenium levels of Atlantic salmon(Salmo salar)[J].Aquaculture,1994,121(4):359-367.
[17]LEMLY A D.Teratogenic effects of selenium in natural populations of freshwater fish[J].Ecotoxicol Environ Saf,1993,26(2):181-204.

