镧对刺参生长、免疫反应及抗病力的影响❋
王艳龙, 徐 玮, 汪东风, 韩丽蓉, 白 阳
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
镧对刺参生长、免疫反应及抗病力的影响❋
王艳龙, 徐 玮❋❋, 汪东风, 韩丽蓉, 白 阳
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
为研究稀土元素镧对刺参生长、免疫反应及抗病力的影响,本文在基础饲料中添加不同剂量镧,制备了5种实验饲料,饲料中镧的浓度分别为0、10、25、50和75mg/kg。以初始体重(6.72±0.01)g的仿刺参(ApostichopusjaponicasSelenka)为研究对象,用制备的饲料在室内进行8周的养殖实验。养殖实验结束后对刺参进行称重,计算特定生长率,随机选取4头解剖取样,测定刺参体腔液的相关免疫酶活性,剩余刺参通过腹腔注射刺参腐皮综合症致病菌灿烂弧菌(Vibriosplendidus)进行14d的攻毒实验。实验表明:与对照组相比,饲料中添加50mg/kg处理组的特定生长率提高了36.92%;当饲料中稀土元素镧添加量为50mg/kg时,刺参体腔细胞吞噬活性、呼吸爆发活力、酸性磷酸酶(ACP)活性和碱性磷酸酶(AKP)活性显著高于对照组;当饲料中镧添加量为10~50mg/kg时,刺参体腔细胞总超氧化物歧化酶(T-SOD)活性和总一氧化氮合酶(T-NOS)活性有升高的趋势,但是没有显著性差异;攻毒实验显示,50mg/kg处理组的刺参累计发病率显著低于对照组。研究表明,饲料中添加50mg/kg的稀土元素镧可以促进刺参生长,同时可以提高刺参的非特异性免疫酶活性。
刺参;镧;生长;免疫反应;抗病力
仿刺参(ApostichopusjaponicasSelenka)又称刺参,隶属于棘皮动物门(Echinodermate)。在中国海域分布有140多种,其中以黄、渤海刺参品质最佳。刺参体壁富含胶原蛋白、活性多糖和矿质元素等,具有很高的食用和药用价值,近年来,已经成为中国北方水产养殖的重要经济物种,但是快速扩大养殖和集约化养殖导致了刺参感染性疾病爆发,造成了巨大的经济损失。目前,用于防治病害的方式主要是使用抗生素和免疫增强剂,因为抗生素的使用会带来刺参抗药性、药物残留、污染环境等问题,因此免疫增强剂的研究正逐渐成为热点。
稀土元素(Rare Earth Elements, REE)包括镧系元素和电子结构相似的钪和钇,共有17种,其中镧、铈是目前研究相对较多的轻稀土。已有研究表明,饲料中添加镧系稀土具有促进动物生长、调节免疫反应、增强抗病力等生理作用,稀土在农作物、畜禽和渔业养殖中得到广泛应用[1-4]。稀土离子通过与细胞膜或细胞器膜结合影响膜上有关酶的活性或改变膜的通透性,进而对第二信使产生作用引起级联反应,调节细胞的信息传递系统,引起相关基因的差异表达,最终导致细胞内一系列生理、生化变化,产生“低促高抑”的生物效应,即Hormesis效应[5]。
本实验旨在探讨海参基础饲料中添加不同水平的镧对刺参生长、免疫反应和抗病力的影响,以期为稀土元素镧在棘皮动物配合饲料中的应用提供科学依据。
1 材料与方法
1.1 实验饲料
以马尾藻粉、鱼粉、小麦粉和豆粕等为基础原料,配制粗蛋白和粗脂肪含量分别为18.6%和1.1%的基础饲料(见表1)。分别在每千克基础饲料中添加0、10、25、50和75 mg镧配制出5种实验饲料。原料均粉碎过100目筛,按配比定量后混匀,然后加入适量水揉匀,经双螺旋杆挤条机(华南理工大学研制的F-II(26)型)挤压出直径为1mm的颗粒,在鼓风干燥箱中48 ℃烘干,烘干的饲料粉碎后,筛选40~80目颗粒贮存于-20 ℃冰箱待用。硝酸镧(La(NO3)3)购自上海国药集团化学试剂有限公司,经ICP-OES(VISTA-MPX,VARIAN)测得硝酸镧中镧含量为39.34%。
1.2 动物饲养与管理
实验用刺参苗购于山东省青岛市田横商业育苗场同一批培育的稚参。刺参在室内循环水系统中暂养2周,暂养期间饱食投喂实验对照组饲料,水温控制在16 ℃。分苗前,刺参饥饿24 h称重计数,挑选个体大小均匀的健康刺参分配到室内20个60 L玻璃缸中。随机分为5组,每组4个重复,每个重复17头刺参,实验刺参的初始平均体重为(6.72±0.01)g。饲养期间连续充气,控制水温(16±0.5)℃,盐度30~31,pH 7.8~8.2,溶氧不低于5 mg/L,氨氮不高于0.5 mg/L,亚硝氮不高于1 mg/L。每天根据刺参摄食情况适当调整投饵量以达到饱食投喂,投喂量为刺参体重4%~7%,投喂时间为17:00,次日8:00清理残饵和粪便,更换1/3新鲜海水,养殖试验持续8周。

表1 基础饲料配方(按干物质计)
注:1 秘鲁红鱼粉购于青岛七好生物科技有限公司;2 马尾藻粉购于山东威海金牌饲料有限公司;3 豆粕、啤酒酵母、小麦粉和大豆卵凝脂购于山东六合饲料有限公司;4 复合维生素和复合矿物盐由青岛玛斯特生物技术有限公司友情提供;5 维生素混合物(mg/kg饲料):盐酸硫胺素90;核黄素150;盐酸吡哆醇210;维生素B12 0.03;甲萘醌50;肌醇600;泛酸钙150;尼克酸600;叶酸15;生物素1.20;醋酸视黄醇32;维生素D3 12;维生素E 120;乙氧基喹啉150;6 矿物质混合物(mg/kg 饲料):碘化钾0.8;六水氯化钴(1%) 40;五水硫酸铜100;七水硫酸亚铁450;一水硫酸锌250; 一水硫酸锰60;七水硫酸镁4000。
Note: 1 Purchased from Qingdao Great Seven Biotechnology Co., Ltd.; 2 Purchased from Shandong Jinpai Feed Co. Ltd, China; 3 Purchased from Shandong Liuhe Group Co., Ltd., China; 4 Kindly provided by Qingdao Master Biotechnology Co., Ltd., China; 5 Vitamin premix (mg/kg diet): thiamin 90; riboflavin 150mg; pyridoxine HCl 210; vitamin B12 0.03; vitamin K350; inositol 600; Calcium pantothenate 150; niacin acid 600; folic acid 15; biotin 1.20; retinol acetate 32; cholecalciferol 12; a-tocopherol 120; ethoxyquin 150; 6 Mineral premix (mg/kg diet): KI 0.8; CoCl2·6H2O (1%) 40; CuSO4·5H2O 100; FeSO4·7H2O 450; ZnSO4·H2O 250; MnSO4·H2O 60; MgSO4·7H2O 4000.
1.3 样品采集及处理
8周养殖试验结束后,对实验刺参饥饿24 h,然后称重、计数。每个重复随机取4头刺参,解剖吸取体腔液测定免疫指标,剩余刺参用于攻毒试验。
刺参体腔液的采集参考赵彦翠[6]的方法,并作适当改进。按体腔液与抗凝剂(0.02 mol/L EGTA,0.048 mol/L NaCl,0.019 mol/L KCl,0.068 mol/L Tris-HCl,pH=7.6)体积比1∶1混合均匀,即抗凝体腔液。一部分抗凝体腔液用于体腔细胞计数、吞噬活性和呼吸爆发活性测定;另一部分抗凝体腔液离心10 min(3000×g,4 ℃)后,弃上清,收集的体腔细胞沉淀用等体积预冷PBS(0.01 mol/L,pH=7.4)重新悬浮。悬液用超声波细胞破碎仪(22 kHz,25×6 s,0 ℃)破碎后,离心10 min(4000×g,4 ℃),所得上清液即体腔细胞破碎上清液(CLS),CLS用于总超氧化物歧化酶(T-SOD)活力、总一氧化氮合酶(T-NOS)活力、酸性磷酸酶(ACP)活力和碱性磷酸酶(AKP)活力测定。
1.4 攻毒试验
取样剩余13头刺参用于攻毒试验,所用灿烂弧菌(Vibriosplendidus)由中国水产科学院黄海水产研究所提供。灿烂弧菌用LB固体培养基活化(28 ℃,24 h),然后接种到LB液体培养基上,28 ℃培养24 h用PBS缓冲液稀释到浓度为1×109CFU/mL(通过预实验得到刺参7d的半致死浓度LD50为1×108CFU/mL)。每头刺参通过腹腔注射0.1 mL灿烂弧菌活菌液,对照组和实验组刺参分别继续投喂对应的饲料,记录14 d内刺参的发病情况并统计累积发病率。
1.5 样品分析测定方法
1.5.1 刺参特定生长率 特定生长率计算公式如下:特定生长率SGR(%/d)=(lnWt-lnWo)×100%/t式中:Wo和Wt分别为刺参的初始体重和终末体重(g);t为实验天数(d)。
1.5.2 刺参体腔细胞密度 将50 μL抗凝体腔液加入到150 μL戊二醛固定液中,用血球计数板在10×40倍显微镜下直接进行体腔细胞计数,计算出刺参体腔液的细胞密度。
1.5.3 体腔细胞吞噬活性 刺参体腔细胞的吞噬活性采用吞噬中性红的方法进行测定[6],略有改动。取100 μL抗凝体腔液加入到96微孔板中,让体腔细胞贴壁30 min后,弃上清,然后加入0.03%中性红100 μL,室温静置30 min后,用PBS缓冲液洗去未被体腔细胞吞噬的中性红。最后加入100 μL细胞裂解液(冰乙酸∶无水乙醇=1∶1)裂解20 min,用全波长酶标仪540 nm下测定吸光值(OD540),结果以每106个体腔细胞的吸光值表示刺参体腔细胞吞噬活性高低。
1.5.4 体腔细胞呼吸爆发活力 参考赵彦翠[6]的方法并作适当改动,预先在96微孔板中加入50 μL 0.2%多聚赖氨酸(poly-D-lysine,Sigma),然后加入200 μL抗凝体腔液离心10 min(300×g,4 ℃),去除上清,然后加入100 μL(1 μg/mL)PMA(Phorbol myristate acetate, Sigma),温育30 min(37 ℃),然后加入100 μL 0.3%NBT(Nitroblue tetrazolium, Sigma),在37 ℃下温育30 min后,离心10 min(560×g,4 ℃),去除上清后加入200 μL 100%甲醇终止反应10 min,离心10 min(700×g,4 ℃),去除上清,再用70%甲醇反复洗涤3次,离心去上清,于室温下晾干。干燥后加入120 μL 2 mol/L KOH和140 μL DMSO(二甲基亚砜),静置20 min;用酶标仪测定630 nm下的吸光值(OD630),刺参体腔细胞呼吸爆发活力以每106个体腔细胞的吸光值表示。
1.5.5 CLS中总超氧化物歧化酶(T-SOD)的测定 使用南京建成生物工程研究所生产的总超氧化物歧化酶(T-SOD)试剂盒测定,采用黄嘌呤氧化酶法测定。CLS中SOD酶活力单位定义为每毫克样品蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD量为一个活力单位(U),SOD活力表示为U/mg蛋白。
1.5.6 CLS中总一氧化氮合酶(T-NOS)的测定 使用南京建成NOS测定试剂盒,利用NOS催化L-Arg和分子氧反应生成NO,NO与亲核性物质生成有色化合物,在530 nm波长下测定吸光值,根据吸光度大小计算NOS活力。以每毫克样品蛋白每分钟生成1 nmol NO为一个酶活力单位(U),NOS活性表示为U/mg蛋白。
1.5.7 CLS中酸性磷酸酶(ACP)的测定 采用南京建成ACP测定试剂盒,酸性磷酸酶分解磷酸苯二钠,产生游离酚和磷酸,酚在碱性溶液中与4-氨基安替吡啉作用经铁氰化钾氧化生成红色醌衍生物,根据红色深浅测定酶活力。以每克样品蛋白在37 ℃与基质作用30min产生1 mg酚为一个活力单位(U),ACP活性表示为U/g蛋白。
1.5.8 CLS中碱性磷酸酶(AKP)的测定 按照南京建成AKP测定试剂盒的操作手册,定义每克样品蛋白在37 ℃与基质作用15min产生1 mg酚为一个金氏单位,AKP活力表示为金氏单位/g蛋白。
1.5.9 体腔细胞蛋白含量的测定 采用Bradford方法通过考马斯亮蓝进行测定,以小牛血清蛋白为标准蛋白建立标准曲线。并用考马斯亮蓝进行显色,反应在96孔酶标板中进行,用酶标仪测定反应体系在595 nm下吸光值。
1.5.10 刺参累计发病率 累计发病率计算公式如下:
累计发病率(Cumulative mortality)=DT/D0×100%,
式中:D0和DT分别为攻毒过程中刺参初始头数和累计发病头数。
1.6 统计分析
采用SPSS 19.0软件对数据进行单因素方差分析(ANOVA)和多重比较,显著性水平为P<0.05。
2 结果
2.1 稀土镧对刺参生长影响
饲料中添加稀土镧能不同程度促进刺参生长,当饲料中镧的添加量为50 mg/kg时,刺参终末平均体重显著高于对照组(P<0.05),特定生长率为1.235%/d,明显高于对照组(P<0.05),10和75 mg/kg镧处理组(SGR)与对照组相比没有显著性差异(P>0.05,见表2)。
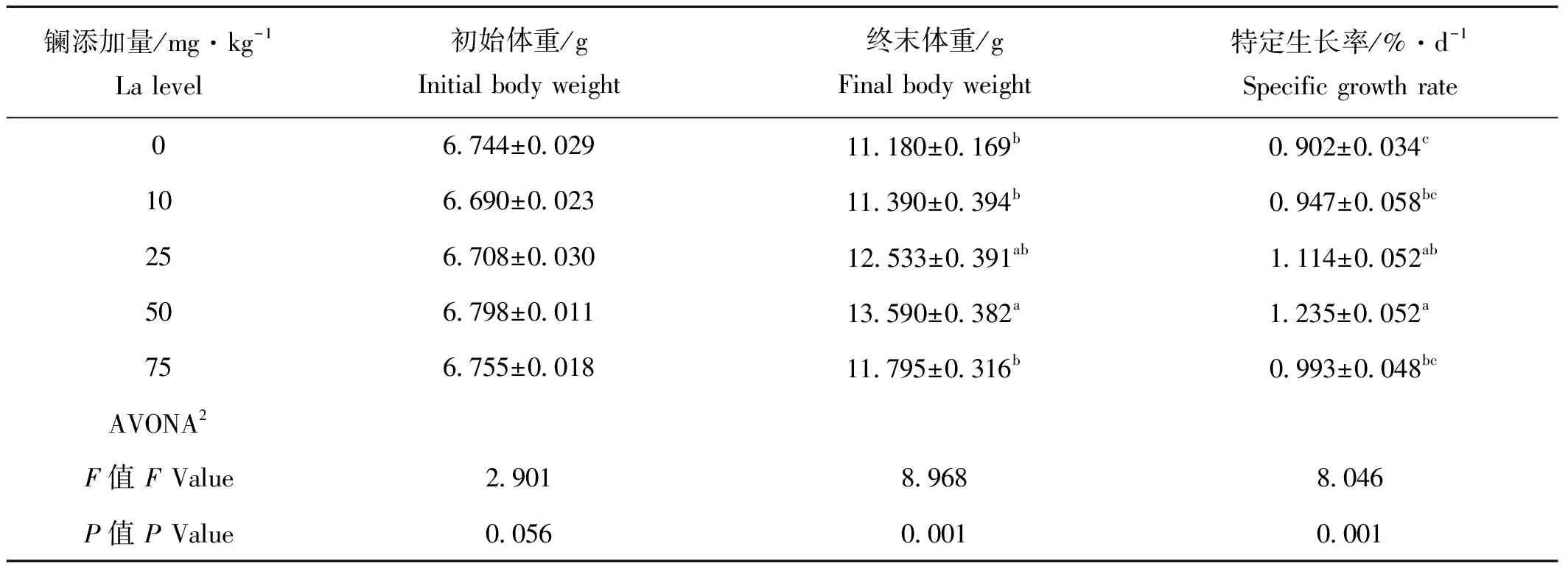
表2 饲料中添加稀土镧对刺参生长性能的影响(平均值±标准误,n=4)1
注:1.表中所给数据位为平均值及4个重复的标准误;2.ANOVA表示单因素方差;3.数值的不同上标表示组间有显著性差异(P<0.05)。
Notes: 1.Values are means and standard errors of four replicates. 2. ANOVA: One-way analysis of variance. 3. Means in the same column with different superscript letters are significantly different (P<0.05).
2.2 稀土镧对刺参免疫反应影响
与对照组相比,饲料中添加镧能不同程度提高刺参体腔细胞吞噬活性、呼吸爆发活性、T-SOD、NOS、ACP及AKP活性(见表3)。其中25 mg/kg镧添加组和50 mg/kg镧添加组的吞噬活性显著高于其它组(P<0.05),其它各处理组间没有显著性差异(P>0.05)。当镧添加量为50 mg/kg时,刺参体腔细胞呼吸爆发活性、T-SOD活性、ACP及AKP活性显著高于其它组(P<0.05);刺参体腔细胞呼吸爆发活性、T-SOD活性、ACP活性及AKP活性显著高于对照组(P<0.05),虽然其它组与对照组相比,刺参体腔细胞呼吸爆发活性和体腔液细胞ACP和AKP活性有所提高,但是没有显著性差异(P>0.05),75 mg/kg镧添加组的T-SOD活性低于对照组(P>0.05)。当饲料中添加25 mg/kg镧时,刺参体腔液NOS活性高于其它组,但是各组间没有显著性差异(P>0.05)。随着饲料中镧的添加量的升高,刺参体腔液的ACP活性有下降趋势。

表3 饲料中添加稀土镧对刺参免疫指标的影响(平均值±标准误,n=4)1
注:1.表中数据均为平均数及4个重复的标准误;2.ANONA表示单因素方差分析;3.数值的不同上标表示组间有显著性差异(P<0.05)。
Notes: 1.Values is means and standard errors of four replicates. 2. ANOVA: One-way analysis of variance. 3. Means in the same column with different superscript letters are significantly different (P<0.05).
2.3 稀土镧对刺参抗弧菌感染能力影响
经过14 d灿烂弧菌攻毒试验后结果(见图1),对照组的刺参累计发病率为58.46%,饲料中镧添加量为50 mg/kg时刺参累计发病率为36.54%,显著低于其它组(P<0.05)。10和25 mg/kg镧添加量处理组的刺参发病率均低于对照组,但是没有显著性差异(P>0.05)。
3 分析与讨论
3.1 稀土镧对刺参生长的影响
已有研究表明在陆地动物和水产动物(鱼、虾和贝等)的饲料中添加稀土元素,能促进动物生长[7-8]。稀土元素镧是稀土中的主要元素之一,镧能够促进动物的生长,例如刘颖[9]发现,低剂量La(NO3)3有促进大鼠体重增长和肝糖原合成的趋势,而高剂量时(200 mg/kg)则有抑制作用。朱伯清[10]等发现,饲料中添加30~200 mg/kg的稀土,可以促进中国东方对虾的生长,且当稀土添加量为60 mg/kg时,效果最好。王敏奇等[11]研究结果显示,添加镧使猪的日增重、饲料转化效率分别提高了13.06%(P<0.05)和6.53%(P<0.05)。郑宗云等[12]在断奶仔猪的基础日粮中添加富含镧、铈的稀土硝酸盐,结果表明,添加量为600 mg/kg时仔猪的日增重提高了28.1%。在本研究中,饲料中添加稀土元素镧为50 mg/kg时能显著促进刺参的生长,对于稀土元素促进动物生长的机制尚不确定。一种解释认为稀土离子能够通过与细胞器和细胞膜磷脂结合,参与或调节Ca2+的代谢,Ca2+作为细胞内第二信使,Ca2+的浓度变化调节着细胞伸长、细胞分裂等一系列生理生化反应[13]。

(平均数±标准误,n=4。不同字母表示4个处理间有显著差异(P<0.05)。Means ± S.E.,n=4. Different letters indicate significant (P<0.05) difference in mean accumulative morbidity among four treatments.)
图1 灿烂弧菌攻毒后刺参的累计发病率
Fig.1 Accumulative morbidity ofApostichopusjaponicas数据的福建海域Selenka after being challenged byV.splendidus
3.2 稀土镧对刺参免疫力的影响
与其它无脊柱动物相比,刺参的特异性免疫系统很不完善,但具有较为完善的非特异性免疫系统,其中对抗病原的吞噬细胞和细胞因子起主导作用。吞噬作用是机体内部防御的第一道防线,吞噬细胞可以对外源粒子进行黏附、吞噬和降解[14]。体腔吞噬细胞吞噬病原的同时会释放细胞活性氧(ROIs),其中细胞超氧阴离子(O2-)是棘皮动物的体腔细胞在吞噬侵入体内的病原微生物时产生的最先产物,因此细胞内O2-浓度被认为是定量呼吸爆发活性大小的一个指标[15]。本实验中当稀土元素镧在饲料中添加量为50 mg/kg时吞噬活性和呼吸爆发活性高于其它组,结果表明稀土元素镧有效激活刺参吞噬细胞的吞噬功能,从而改善和提高其非特异性免疫力。王宗惠等[16]研究发现,在4~125 μg/mL剂量范围内,稀土能够促进巨噬细胞特异吞噬功能,并呈剂量反应依赖关系。崔丽卿等[17]研究表明饲料中添加稀土元素能提高大菱鲆血液中性粒细胞的吞噬活性。而有关稀土提高吞噬指数的机理,Mizgerd等[18]的研究表明,稀土能够被巨噬细胞所吞噬从而促进细胞调亡。
SOD是生物体内重要的抗氧化酶类之一,SOD能够清除吞噬过程产生的高浓度O2-及生化过程中产生的氧自由基[19]。本实验结果表明,饲料中添加50 mg/kg稀土元素镧能显著提高刺参体腔液总SOD活性。刘洁等[20]研究发现低浓度Ce3+溶液处理大鼠红血球SOD时,SOD的α-螺旋含量增加,β-折叠含量减小,SOD活性升高;高浓度Ce3+处理SOD时,SOD活性下降。Y.Chen等[21]研究表明,用一定浓度La3+、Gd3+和Y3+浸浴处理金鱼18 d,金鱼肝脏SOD酶活分别提高了15.58%、16.80%和24.80%。
一氧化氮合酶(NOS)是生物体非特异性免疫系统中的重要组成部分,在病原体(细菌、病毒和寄生虫)、细胞因子(IFN、IL、TNF)、免疫刺激物(LPS,酵母聚糖)等的作用下,iNOS被诱导产生大量的NO,NO自由基通过刺激巨噬细胞诱导受感染细胞的炎症和死亡,起到对抗外援微生物的细胞毒作用[22]。碱性磷酸酶(AKP)在生物体组织内广泛存在,是一种含锌的糖蛋白,在碱性环境下(最适pH为10左右)可以催化各种醇和酚的磷酸酯进行水解反应。与之相对应的是酸性磷酸酶(ACP),一般认为ACP主要存在于吞噬细胞,位于溶酶体内,是溶酶体的标志酶[23]。本实验中,当饲料中添加50 mg/kg稀土元素镧时,刺参体腔液的ACP和AKP活性明显提高,NOS活性没有明显变化,随着镧元素浓度升高ACP和NOS活性有下降趋势。夏青[24]等研究发现,用20 mg/kg常乐稀土溶液连续灌胃大鼠,3个月后大鼠血清中ALP活性显著升高。有研究证实,硝酸镧对离体动物细胞外源性刺激表现出低剂量促进,高剂量抑制免疫功能作用[25-27]。
3.3 稀土镧对刺参抗病力的影响
刺参抗病力大小是免疫增强剂作用效果的直观体现,灿烂弧菌是刺参发生腐皮综合症的致病菌,对刺参养殖危害严重。大量研究表明稀土离子有一定的抗菌作用[28-31],同时可以提高水产动物成活率。本研究中,饲料中镧添加量为50 mg/kg时能显著降低刺参的累计发病率,这种抗病力的提升与刺参体腔液中吞噬细胞活性、SOD、ACP和AKP酶活性的提高有关。另外,刺参抗病力大小与镧添加剂量有关,高剂量稀土元素镧对刺参抗病力影响不大。
4 结语
在本实验条件下,当饲料中镧的添加量为50mg/kg时,可显著提高刺参的特定生长率同时提高刺参的非特异性免疫酶活性。表明饲料中添加适当浓度稀土镧具有促进刺参生长,提高免疫反应和抗病力生理作用。然而更高水平的镧添加量对刺参生长、免疫及抗病力影响以及稀土元素镧在刺参机体内的代谢还有待于进一步研究。
[1] He M L, Rambeck W A. Rare earth elements-a new generation of growth promoters for pigs [J]. Archives of Animal Nutrition, 2000, 53(4): 323-334.
[2] 秦俊法, 陈祥友, 李增禧. 稀土的生物学效应 [J]. 广东微量元素科学, 2002, 9(3): 1-16.
[3] 杨军, 刘向生, 王甲辰, 等. 我国稀土农用现状、发展趋势及对策 [J]. 稀土信息, 2009(4): 29-31.
[4] 江良梁, 秦宜德, 陈程, 等. 饲喂硝酸镧对大鼠生长及肝脏中几种酶活性的影响 [J]. 现代预防医学, 2007, 34(19): 3639-3641.
[5] 张信连, 杨维东, 刘洁生, 等. 稀土元素生物效应中的Hormesis现象 [J]. 生物技术, 2004, 14(6): 82-84.
[6] 赵彦翠. 刺参(ApostichopusJaponicusSelenka)多糖类免疫增强剂及微生态制剂的研究与应用 [D]. 青岛: 中国海洋大学, 2011.
[7] Rosewell D. Feeding Rare Earths to Cashmeres[C]. Canberra: ACT Australia, 1995: 37-39.
[8] Shen Q, Zhang J, Wang C. Application of Rare Earth Elements on animal production [J]. Feed Industry, 1991, 12: 21-22.
[9] 刘颖, 孙淑艳. 硝酸镧对大鼠肝脏的亚慢性毒性实验研究 [J]. 中国稀土学报, 2001, 19(2): 167-170.
[10] 朱伯清, 徐明起. 添加稀土元素的配合饲料对中国对虾生长效果的研究 [J]. 中国水产科学, 1995, 2(2): 15-22.
[11] 王敏奇, 许梓荣. 饲粮中添加镧对猪生长的影响及安全性 [J]. 中国兽医学报, 2003, 23(1): 88-90.
[12] 郑宗云. 稀土添加剂对断奶仔猪生长性能及血液生化指标的影响 [D]. 福州: 福建农林大学, 2011.
[13] 周晓波, 魏幼璋. 稀土离子与Ca2+在生物体内的相互作用机制及应用 [J]. 生命科学研究, 1999, 3(1): 30-35.
[14] 孟繁伊, 麦康森, 马洪明, 等. 棘皮动物免疫学研究进展 [J]. 生物化学与生物物理进展, 2009, 36(7): 803-809.
[15] Sritunyalucksana K, Sithisarn P, Withayachumnarnkul B, et al. Activation of prophenoloxidase, agglutinin and antibacterial activity in haemolymph of the black tiger prawn,Penaeusmonodon, by immunostimulants [J]. Fish Shellfish Immunol, 1999, 9(1): 21-30.
[16] 王宗惠, 庞新民, 苏英, 等. 稀土防癌实验及对NK细胞活力影响的观察 [J]. 卫生毒理学杂志, 1994, 8(3): 200-202.
[17] 崔丽卿, 徐玮, 汪东风.稀土对大菱鲆生长和非特异性免疫力的影响 [J]. 中国海洋大学学报(自然科学版), 2011, 41(7): 97-100.
[18] Mizgerd J P, Molina R M, Stearns R C, et al. Gadolinium in duce macrophage apoptosis [J]. Journal of Leukocyte Biology, 1996, 59(2): 189-195.
[19] Fridovich I. Superoxide dismutase. An adaptation to a paramagnetic gas [J]. J Biol Chem, 1989, 264(14): 7761-7764.
[20] 刘洁. 稀土元素对小鼠免疫和肝功能影响 [D]. 苏州: 苏州大学, 2010.
[21] Chen Y, Cao X D, Lu Y, et al. Effects of rare earth metal ions and their EDTA complexes on antioxidant enzymes of fish liver [J]. Environmental Contamination and Toxicology, 2000, 65(3): 357-365.
[22] Vital A L, Goncalo M T, Cruz M T, et al. Dexamethasone prevents granulocyte-macrophage colony-stimulating factor-induced nuclear factor-kB activation, inducible nitric oxide synthase expression and nitric oxide production in a skin dendritic cell line [J]. Mediators Inflamm, 2003, 12(2): 71-78.
[23] 常杰, 牛化欣, 张文兵. 刺参免疫系统及其免疫增强剂评价指标的研究进展 [J]. 中国饲料, 2011(6): 8-12.
[24] 夏青, 陈东, 刘玉荣, 等. 混合稀土“常乐”对大鼠肝脏代谢的影响 [J]. 毒理学杂志, 2006, 20(1): 61-62.
[25] 宋宇, 黄可欣, 李冬梅, 等. 硝酸镧对小鼠特异性抗体的形成, 淋巴细胞转化和腹腔巨噬细胞吞噬功能的影响 [J]. 吉林大学学报(医学版), 2012, 38(6): 1048-1051.
[26] 张颖, 肖颜林, 陈功, 等. 硝酸镧对大鼠免疫功能的影响 [J]. 食品与发酵科技, 2012, 48(1): 44-48.
[27] 刘小阳, 胡爱武. 硝酸镧对大鼠免疫功能的影响 [J]. 池州学院学报, 2012(6): 44-46.
[28] Z Ruming, L Yi, X Zhixiong, et al. A microcalo-rimetric method for studying the biological effects of La3+on Escherichia coli [J]. Journal of Biochemical and Biophysical Methods, 2000, 46(1-2): 1-9.
[29] Liu Peng, Xiao Hongyu, Li Xi, et al. Study on the toxic mechanism of La3+toEscherichiacoli[J]. Biological Trace Element Research, 2006, 114(1-3): 293-300.
[30] 沈雪松, 刘义, 侯安新, 等. Pr3+或La3+与克拉红霉素对大肠杆菌的协同作用 [J]. 物理化学学报, 2003, 19(6): 560-563.
[31] Liu Peng, Liu Yi, Lu Zhe xue, et al. Study on biological effect of La3+onEscherichiacoliby atomic force microscopy [J]. Journal of Inorganic Biochemistry, 2004, 98(1): 68-72.
责任编辑 朱宝象
Effects of Dietary La3+on Growth, Immunity and Disease Resistance toVibriosplendidusof Sea Cucumber,Apostichopusjaponicas
WANG Yan-Long, XU Wei, WANG Dong-Feng, HAN Li-Rong, BAI Yang
(College of Food Science and Technology, Ocean University of China, Qingdao 266003, China)
A 8-week feeding experiment was conducted to evaluate the effects of La3+on the sea cucumber(initial average weight (6.72±0.01)g). Five practical diets were formulated with graded level of La3+(0, 10, 25, 50 and 75mg/kg dry feed). At the end of the feeding experiment, sea cucumbers were weighed by tank to monitor growth.Four sea cucumbers were randomly collected for the assay of immune parameters.The remaining juveniles were injected with the pathogen bacteriaV.Splendidusand monitor the accumulative mortality rate during 14 d. The experiment result indicated that the specific growth rate of 50 mg/kg La3+group was 36.92% higher than the control group. Compare to the control,sea cucumbers fed with 50mg/kg La3+had significant higher activities of phagocytosis, respiratory burst, acid phosphatase (ACP) andalkaline phosphatase (AKP). The activity of total superoxide dismutase(T-SOD) and total nitric oxide synthase(T-NOS) of coelomocytes was tending to increase as dietary La3+increased from 10 to 50mg/kg, but there were no significant differences. The result of challenge test also showed that sea cucumbers fed with 50mg/kg La3+had significantly lower accumulative mortality compared with the control groups. In conclusion, the oral administration of La3+on the sea cucumber at a dose of 50 mg/kg can improve growth, enhance the immunity as well as increase disease resistance.
sea cucumber; La3+; growth; immune response; disease resistance
国家自然科学基金项目(31371731);山东省自然科学基金项目(ZR2009DM026)资助
2014-08-11;
2014-10-13
王艳龙(1989-),男,硕士生,研究方向为食品化学与营养。E-mail:wyl_189@126.com
❋❋ 通讯作者: E-mail:weixu@ouc.edu.cn
S968.9
A
1672-5174(2015)09-054-07
10.16441/j.cnki.hdxb.20140246

