浅谈脊髓灰质炎减毒活疫苗生产车间的工艺布置设计
张媛媛
(中国航空规划建设发展有限公司医药设计研究院,北京100120)
0 引言
随着医药领域的发展,疫苗市场不断受到关注,众多制药企业纷纷投入其中。与此同时,新版GMP的发布与实施以及国内市场与国际市场的逐步接轨,也对疫苗类产品生产车间的设计提出了更高的要求。
脊髓灰质炎(简称脊灰)是由脊灰病毒所致的急性传染病,好发于婴幼儿,又称“小儿麻痹症”。目前,虽然对这种疾病还没有有效的治疗方法,但可以通过接种疫苗进行预防。我国也在继续加强对脊灰疫苗生产的投入,并逐步向国际市场扩大,迫切需要能够满足市场需求与标准的生产设施,以确保产品的安全有效性。
本文将以某脊灰减毒活疫苗生产车间为例,在新版GMP的基础上,分析此类车间的设计理念和工艺布局设计。
1 脊灰减毒活疫苗的生产工艺流程及主要工艺设备
1.1 生产工艺流程
首先在细胞区将生产用的细胞在一定温度下进行培养,然后将毒种按比例接种于细胞,将接种毒种后的细胞置特定温度下培养,一定天数后开始收获病毒液,然后送至冷库冻存。同一细胞批生产的病毒收获液合并为一批原液,根据病毒滴度对原液进行稀释,加入稳定剂,即为半成品,半成品再经分装、包装后得成品。
1.2 生产车间的主要工艺设备
脊灰疫苗生产过程涉及的主要工艺设备包括转瓶机、细胞工厂全自动操作系统、生物反应器系统、配制系统以及分装设备等。
1.2.1 转瓶机
转瓶培养是一种传统的培养技术,其具有结构简单、投资少、技术成熟等优点,主要适合于悬浮细胞和贴壁细胞的培养,但由于其单位体积提供的细胞生长表面积小,细胞生长密度相对较低,因此仅适用于中试车间或小规模生产使用。
1.2.2 细胞工厂全自动操作系统
细胞工厂在有限的空间内利用了最大限度的培养表面,实现了细胞扩增,具有污染风险较低、节省空间、生产效率高、自动化等优点,已经逐渐在疫苗行业得到广泛应用。
1.2.3 微载体技术与生物反应器系统
微载体是一种新兴的大规模细胞培养技术,高密度的微载体大大增加了细胞培养的表面积,从而实现产能的扩大,其兼具悬浮培养和贴壁培养的优点。虽然微载体在使用过程中会受一些因素限制,但使用生物反应器系统进行微载体细胞大规模扩增已具有明显优势,诸如培养过程系统化、自动化、不易被污染等。
1.2.4 配制系统(配制罐及CIP/SIP系统)
配制罐多采用磁力搅拌式的全自动罐,外源蒸汽实罐消毒,可在线显示和记录配液罐灭菌过程数据。每个配制罐独立配置温度、转速、液位、pH测量和自动控制CIP/SIP系统,并采用可靠性强的总线自动控制系统。
在生产车间的工艺设计时,根据项目年生产能力,选择合理数量和规格的配制罐与之匹配,满足生产要求。
1.2.5 分装设备(洗、烘、灌生产联动线)
洗、烘、灌生产联动线一般由立式洗瓶机、隧道式热风循环灭菌干燥机、拉丝灌封机(安瓿瓶)或灌装压塞机(西林瓶)组成。对西林瓶而言,其后序还需配置轧盖机。
在产品生产过程中,为了更好地降低污染风险,减少人为直接参与生产过程是关键。因此,在设计时主要考虑采用具有规模化、现代化、自动化的设备,尽量减少人员操作。洗、烘、灌生产联动线可提高整个生产过程的自动化程度,让整个生产过程始终处于可控状态,保证了药物在生产过程中的安全性、可追溯性和可重复性。
2 脊灰减毒活疫苗生产车间的工艺平面设计
对于一个制药车间或厂房的设计,首先应整体考虑建筑物的位置、人、物流出入口、工艺流程的合理性、空间平面的利用率、节能生产等问题,同时应协调好工艺与建筑、消防、空调、动力等之间的关系。在满足生产要求的前提下,尽量减少洁净区(特别是无菌区)的面积以降低能耗。另外,还要考虑生产的机械化、自动化,尽量减少人员操作,把对产品的污染风险降至最低。
下面以某脊灰减毒活疫苗生产车间为例,从以下几个方面对其工艺平面设计进行分析。
2.1 工艺区划方案
根据脊灰疫苗生产工艺各工序的特殊要求及相互关系,利用纵横走廊将生产车间分设7个功能区:
生产区分为细胞区(无毒区、C级、局部A级区)、病毒区(有毒区、C级、局部A级区)、配苗区(有毒区、B级、局部A级区)、分装区(有毒区、B级、局部A级区)、外包装区(无毒区、K级区);
由于在生产过程中的细胞培养、细胞种毒后培养需要大量的细胞培养液,因此,在车间内设置一个单独的配液区(无毒区、D级区),进行培养基的配制;
每个生产区使用的大量的器具需要进行回洗、灭菌后重复使用,因此,车间还需设置统一的清洗区(无毒区、D级区)。
每一工作区设置独立的人、物流出入口,并同其他区域严格分开。
2.2 人、物流设计
新版GMP多次强调了避免混淆及交叉污染的问题,因此在进行生物制品类厂房设计时应考虑将人、洁物、污物分开。
某脊灰减毒活疫苗生产车间的分装区人、物流设计如图1所示。车间分别设计人流入口、物流入口以及污物出口。人流从厂房东北侧门厅进入,经换鞋、更衣进入K级走廊,再分别经过缓冲、一更、二更、气闸后进入各洁净生产区;物流从西北侧门厅进入,通过物流净化通道后进入生产区,分别经过细胞培养、种毒、收获、配制、分装、包装等工序;各生产区的污物统一退到南侧污物走廊,其中有毒区的污物需经本区的高压灭菌处理,通过南侧走廊运出,送至厂区污物暂存点集中处理。
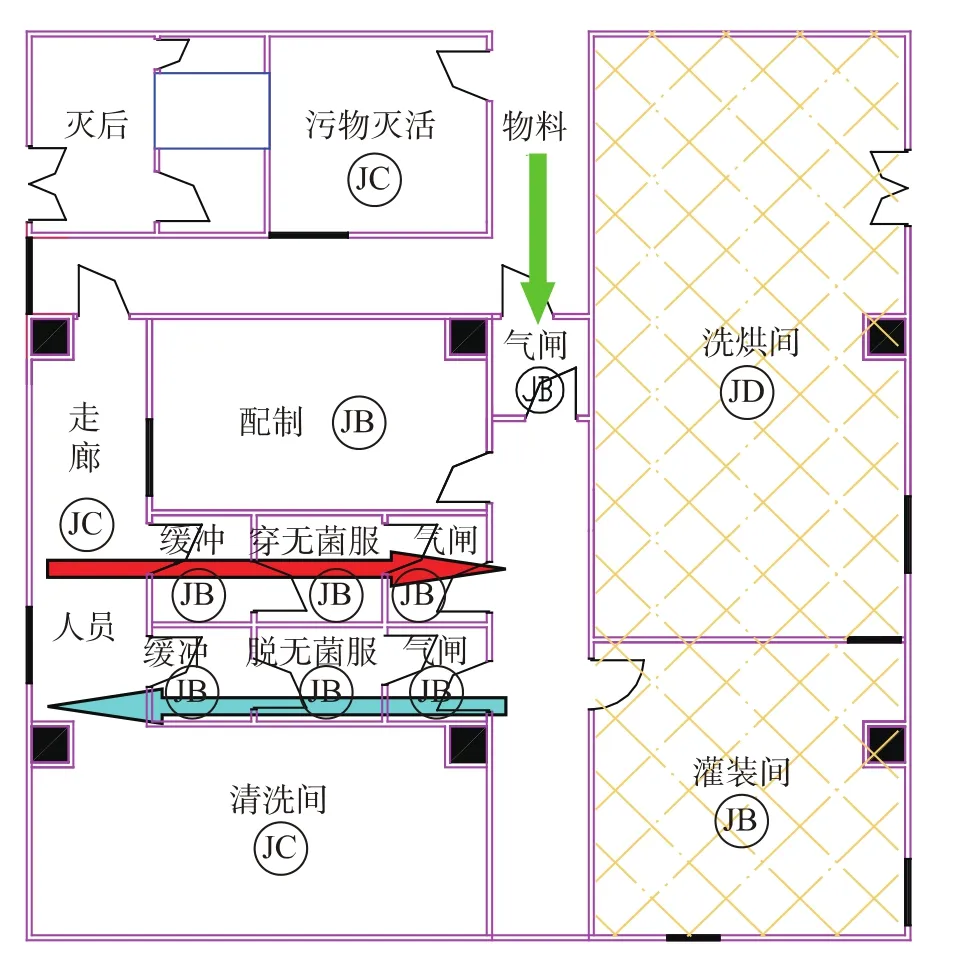
图1 某脊灰减毒活疫苗生产车间的分装区人、物流设计
2.3 核心区的控制
新版GMP对操作人员进出洁净区域有许多具体要求,其中第30条规定:“应当按照气锁方式设计更衣室,使更衣的不同阶段分开,尽可能避免工作服被微生物和微粒污染;更衣室应当有足够的换气次数,更衣室后段的静态级别应当与其相应的洁净区级别相同;必要时,可将进入和离开洁净区的更衣间分开设置;操作人员进出无菌生产核心区,必须遵循严格的更衣程序。”
对于脊灰减毒活疫苗生产车间,分装区作为整个车间的核心区域,应单独设置人、物流入口,必要时应设计人员退出通道。如图1所示中的物料通过北侧气闸进入分装区,工作人员通过缓冲、穿无菌服、气闸进入,退出人员则经过气闸、脱无菌服、缓冲退出分装区,这样可以有效避免人、物交叉以及进入和离开分装区人员的相互交叉。
根据新版GMP对风险控制的要求,考虑到轧盖过程中可能有铝屑产生,从而增加对制品的污染风险,因此设计时将轧盖操作区与灌装区严格分开,分装区和轧盖区均采用B+A空调系统,轧盖区相对灌装区负压,轧盖人员设置单独更衣,小瓶由灌装至轧盖过程中全程A级送风进行环境保护。
2.4 有毒区、无毒区的控制
由于脊灰减毒活疫苗生产车间的病毒区、配苗区及分装区均为有毒区,因此,在设计时应考虑有毒区的控制问题。
有毒区人员进入需要经过前缓、更衣、后缓进入,并将后缓设为气闸。洁净更衣的核心是“污”和“净”的分离,以避免干净的工作服在更衣过程中被微生物和微粒污染。由于操作人员退出时衣服上所带的微粒和微生物会污染更衣区,或者生产操作时产生的有害物质通过更衣区外溢,因此有必要设置回更。然而,并不是所有的无菌生产区都必须设置退出通道,应根据风险分析结果判断是否需要设置退出通道。对于图1所示的车间有毒区人员的退出,由于条件限制,没有单独设置人员退出通道,设计时将后缓设为气闸,相对负压,以隔开有毒区和无毒区。
有毒区物流进入需要经过外清、缓冲进入,缓冲间设为气闸。若生产车间内有毒区与无毒区之间需要传递,则在有毒区与无毒区之间设置物流气闸进行控制。
3 结语
医药洁净厂房的工艺设计,从宏观上考虑既要满足工艺需求、生产能力需求,同时也要考虑投资成本与运行费用等问题,尽可能为甲方节省投资,节省运行成本。在具体设计时,应严格按照新版GMP要求进行洁净分区,使人、物流走向清晰合理,避免对核心区的干扰。按照工艺流程顺序布置,尽量使得物料路径短,避免物料往返及交叉污染。另外,还应根据生物疫苗的自身特性,即活毒、死毒以及毒性强弱确定车间生物安全等级,合理进行有毒、无毒区域划分以及对有毒区进行控制,尽可能降低生产过程的污染风险以及生产车间对外界环境的污染。
[1]医药工业洁净厂房设计规范(2010年修订)[S].
[2]王志祥.制药工程学[M].化学工业出版社,2003.
[3]张延龄,张晖.疫苗学[M].科学出版社,2004.

