育真熄风汤对拟帕金森小鼠脑内nNOS和iNOS的影响*
卢思英,党晓伟,李 建,张世琴,秦博文,商亚珍
(1.河北承德护理职业学院,河北承德067000;2.河北承德医学院中药研究所,河北承德067000)
帕金森病(PD)是世界卫生组织确定的疑难疾病之一。研究表明,一氧化氮(NO)作为中枢神经系统内的细胞递质和信使分子,参与了帕金森等神经退行性疾病的病理过程。而一氧化氮合酶(NOS)作为NO生成的关键限速酶,可间接反映NO对DA神经元的影响。自拟配方育真熄风汤(Yuzhenxifeng decoction,YZXFD)在临床中应用多年,但其作用机理一直未有研究。本实验目的希望通过动物实验,研究其对PD小鼠脑内神经型一氧化氮合酶(neuronal nitric oxide synthase,nNOS)和诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)的影响,探讨中药复方YZXFD对帕金森病的作用机理。
1 材料与方法
1.1 材料
1.1.1 实验动物 采用C57/BL健康雄性小鼠90只,6~7周龄,SPF级,体质量18~20g。购于北京华阜康生物科技股份有限公司,合格证号为SCXK京2009-2004。
1.1.2 仪器与试剂 BH-2型OLYMPUS显微镜及摄像装置(日本),美多巴(每片含苄丝肼50mg+左旋多巴200mg,上海,罗氏公司),MPTP(1-methyl-4-pheny-1,2,3,6-tetrahydropyridine,美国,Sigma公司),兔抗小鼠nNOS抗体、iNOS抗体(北京博奥森生物技术有限公司)。
1.1.3 药物制备 中药配方YZXFD以生黄芪、熟地、龟板为君药,包含多种中药成分[1],生药总量275g制成中药汤剂。根据药理学方法制成高、中、低3个药物治疗浓度,相当于生药量分别 为 143.00g/kg、71.50g/kg、35.75g/kg[1];造 模 药MPTP采用生理盐水配制成浓度为0.33%的溶液;美多巴阳性对照药采用CMC溶解配制成浓度为12.5mg/mL的溶液。
1.2 方法
1.2.1 PD小鼠模型建立 造模采用 MPTP(30mg·kg-1·d-1)诱导模型,腹腔注射,每日1次,连续5d[2]。造模前1d,筛选能连续游泳1min的健康小鼠做为实验对象,以消除小鼠的运动能力差异。
1.2.2 动物分组与给药 为达到药物有效浓度,中药治疗各组小鼠从首次注射MPTP前3d开始分别给予不同浓度的YZXFD灌胃给药(10mL/kg);阳性对照组小鼠给予美多巴(10mL/kg)灌胃;空白和模型对照组给予生理盐水灌胃(10 mL/kg),持续28d。
1.2.3 行为学检测 游泳实验:自制20cm×30cm×20cm规格的水箱,控制水温28~30℃。放入受试小鼠,观察并记录小鼠1min内游泳状态。能够连续不断游泳的小鼠计3.0分;大部分时间游泳仅偶尔漂浮者计2.5分;漂浮时间超过30s的计2.0分;偶尔游泳的计1.5分;漂浮在一边仅偶尔用后肢游动的计1.0分[2]。
1.2.4 组织形态学观察 实验第14、28天随机选取各组小鼠处死制成切片,常规4.0%多聚甲醛透心灌注固定,根据小鼠大脑图谱黑质位置做冠状石蜡切片,片厚5um。采用尼氏体染色(0.2%的硫堇溶液浸洗30min)观察多巴胺神经元组织形态和数量的改变。
1.2.5 nNOS、iNOS染色 采用SABC免疫组织化学法染色:常规3%H2O2灭活内源性酶;枸橼酸盐微波煮沸修复;一抗分别用1∶150兔抗小鼠nNOS、iNOS。阴性对照以PBS代替一抗进行染色。
1.3 统计学处理 采用SPSS 13.0统计软件对数据进行分析处理,计量资料以x±s表示,组间比较采用t检验,计数资料采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 行为学检测 注射MPTP 5~10min后,小鼠即出现肢体震颤、竖毛、竖尾及跳窜等典型动作,持续20~30min后,小鼠活动明显减少,动作迟缓,甚至匍匐不动,符合PD小鼠模型行为学表现[1]。游泳试验结果显示,模型对照组小鼠游泳时间较空白对照组游泳时间缩短,且随着用药时间的延长而逐渐降低,尤其从第3天开始差异有统计学意义(P<0.05),显示PD造模成功。中药治疗组与模型对照组比较,小鼠游泳能力有所改善,评分增加,尤其以YZXFD高剂量治疗组改善明显,差异有统计学意义(P<0.05)[3]。
2.2 YZXFD对各组小鼠中脑黑质DA神经元数目的影响结果显示,空白对照组小鼠黑质致密部DA神经元内尼氏体分布均匀,神经元胞体饱满整齐,呈带状分布,数量密集;模型对照组神经元带状分布松散,残存神经元形态各异[4],与空白对照组比较,神经元数量明显降低(P<0.01),见表1;中药治疗组神经元数量较模型对照组增多,神经元胞体较饱满,结构较清晰。2.3 YZXFD对各组小鼠中脑黑质nNOS、iNOS的影响
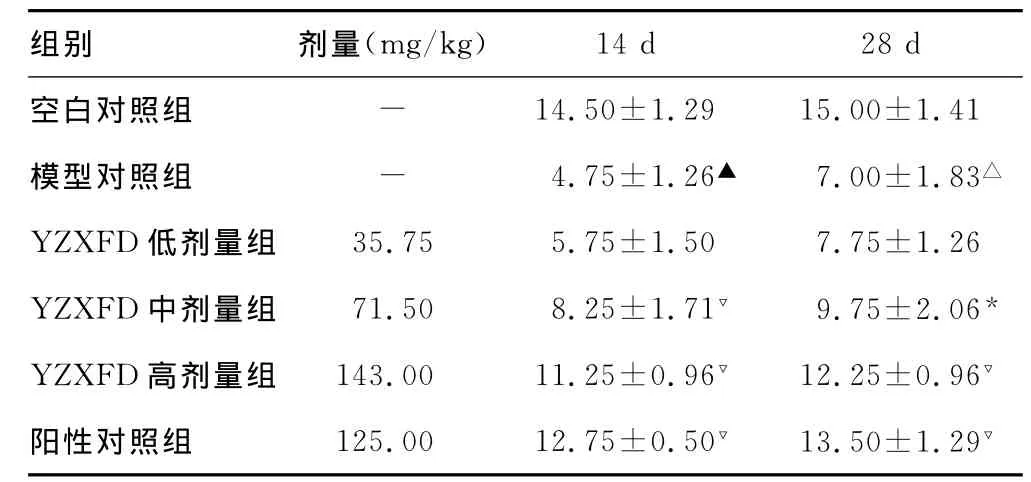
表1 YZXFD对PD模型小鼠SN中尼氏体染色DA神经元细胞数目的影响(x±s,n=15)

表2 YZXFD对PD模型小鼠SN中nNOS、iNOS蛋白表达的影响(x±s,n=15)
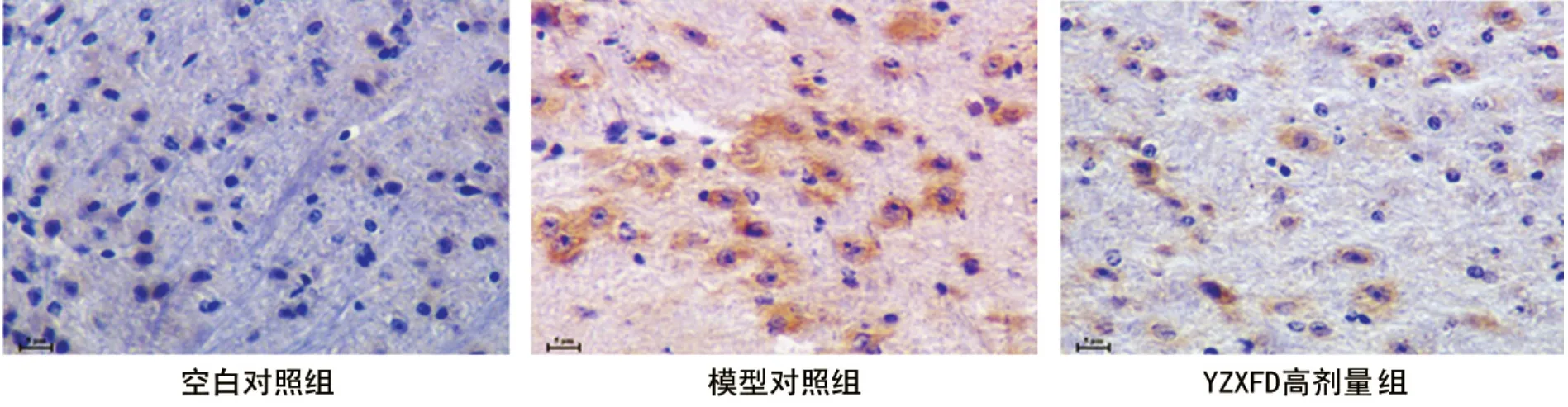
图1 实验第14天黑质内nNOS免疫组织化学法蛋白表达(SABC法,×400,scale bar=5μm)
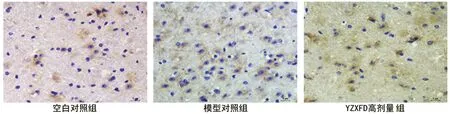
图2 实验第14天黑质内iNOS免疫组织化学法蛋白表达(SABC法,×400,scale bar=5μm)
nNOS、iNOS免疫反应阳性细胞,均表现为较为粗大的棕黄色颗粒,主要为胞质表达。与空白对照组比较,模型对照组nNOS和iNOS蛋白含量都显著增多(P<0.05),见图1、2。中药治疗组及阳性对照组较模型对照组nNOS和iNOS蛋白含量减少,尤其以YZXFD高剂量组减少明显,差异有统计学意义(P<0.01),分别减少38.6%(第14天)和38.0%(第28天),见表2。
3 讨 论
现代中医学对熟地、龟板、鹿角胶的药理作用做了相关研究,发现其均有增强大脑学习记忆,抗衰老、抗氧化、抗突变作用[5-7]。苗明三等[8]研究发现熟地黄中的多糖有较好的抗衰老作用,能提高小鼠衰老模型脑中酶类自由基清除剂的活力,降低脑匀浆过氧化脂质(LPO)水平。提示熟地可通过提高血中抗氧化相关酶的活性,起到一定的抗氧化作用。育真熄风汤以熟地、龟板、鹿角胶为君药,包含18种滋补肝阴肾气、益气补脾的有效中药成分,从多靶点、多途径整体调节机体功能,化疾通络,熄风止痉,符合中医治疗颤症的理论。
作者采用游泳法和尼氏体病理染色的方法,从行为学和组织形态学两方面观察小鼠的协调运动能力和DA神经元的改变。结果显示,模型对照组与空白对照组小鼠运动能力存在统计学差异,提示PD模型建立的成功和可靠。随着用药时间的延长,YZXFD治疗组小鼠的运动协调能力及DA神经元的数量都有不同程度的改善和提高,尤其以YZXFD高剂量组效果明显。说明YZXFD对PD小鼠的行为学障碍有显著改善作用和对多巴胺神经元的保护作用。
NO作为自由基家族的成员,近年研究表明,过多地在中枢神经系统内生成能引发神经细胞损伤,导致帕金森病及其他神经退行性疾病[9-11]。NOS是NO合成最关键的限速酶,有3种亚型,其中,nNOS属结构型NOS,正常情况下在神经元中仅有低水平表达。Vincent等[12]研究发现,大鼠局部脑缺血时同侧的nNOS、mRNA明显增加,而nNOS基因敲除的小鼠能明显抵抗脑缺血性损伤[13],提示来源于nNOS的NO参与对神经的毒性作用。iNOS在正常健康人的脑中不表达或表达很少,但病理情况下,如炎症细胞因子免疫应答、神经损伤等情况下表达增多,且产生比nNOS更多且持续更长时间[14]。因此,来源于iNOS和nNOS的NO都具有神经毒性作用,可作为重要的介导因素被激活,从而引起神经元的毒性作用,导致神经元的凋亡或细胞坏死[15]。作者在实验中也得出 MPTP模型小鼠SN内在第14、28天的nNOS和iNOS有明显升高。而经过YZXFD中药预防和治疗后的小鼠与模型组比较,其行为学障碍有明显改善,DA神经元数量增加,nNOS和iNOS有明显降低。因此,作者有理由认为YZXFD可以通过抑制nNOS和iNOS的活性,进而降低其对DA神经元的毒性作用,发挥保护DA神经元、抗帕金森病的作用。
[1] 秦博文,党晓伟,卢思英,等.育真熄风汤对帕金森病模型小鼠脑内铁蛋白Fn的影响[J].重庆医学,2014,43(15):1889-1891,1895.
[2] Lee KS,Lee JK,Kim HG,et al.Differential effects of 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine on motor behavior and dopamine levels at brain regions in three different mouse strains[J].Korean J Physiol Pharmacol,2013,17(1):89-97.
[3] 秦博文,董丽萍,卢思英,等.育真熄风汤对 MPTP诱导PD模型小鼠行为学的影响[J].河北医学,2014,38(9):1482-1485.
[4] 秦博文,党晓伟,卢思英,等.育真熄风汤对PD模型小鼠多巴胺能神经元的作用[J].江苏医药,2014,40(11):1249-1251.
[5] 朱妍,徐畅.熟地黄活性成分药理作用研究进展[J].亚太传统医药,2011,7(11):173-175.
[6] 余新建,陈素红,吕圭源.龟甲“滋阴补肾”药效相关研究概况[J].当代医学,2009,15(10):15-17.
[7] 牛晓晖,孙佳明,张艳萍,等.中国鹿科动物源药材药理作用十年研究进展(一)[J].吉林中医药,2012,32(6):611-612.
[8] 苗明三,孙艳红,方晓艳.(怀)熟地黄多糖抗氧化作用[J].中国中医药信息杂志,2002,10(10):32-34.
[9] 胡章颜.一氧化氮与细胞凋亡的研究进展[J].江西医学院学报,2005,45(3):176-178.
[10]杨斌.复方地黄对老年痴呆动物模型学习记忆能力的影响[J].中国实验方剂学杂志,2011,17(3):195-197.
[11]Lorenc-Koci E,Czarnecka A.Role of nitric oxide in the regulation of motor function.An overview of behavioral,biochemical and histological studies in animal models[J].Pharmacological Reports,2013,65(5):1043-1055.
[12]Vincent AM,Maiese K.Nitric exide induction of neutral endonucleasc activity in programmed cell death[J].Exp Cell Res,1999,246:240-243.
[13]Tsutsui M,Shimokawa H,Morishita T,et al.Development of genetically engineered mice lacking all three nitric oxide synthase isoforms[J].J Pharmacol Sci,2006,102(2):147-154.
[14]Huerta C,Sánchez-Ferrero E,Coto E,et al.No association between Parkinson′s disease and three polymorphisms in the eNOS,nNOS,and iNOS genes[J].Neurosci Lett,2007,413(3):202-205.
[15]Gupta SP,Yadav S,Singhal NK,et al.Does restraining nitric oxide biosynthesis rescue from toxins-induced parkinsonism and sporadic Parkinson′s disease?[J].Mol Neurobiol,2014,49(1):262-275.

