鸡蛋黄低密度脂蛋白理化及加工特性研究进展
王 宁 马美湖
(华中农业大学,武汉 430070)
鸡蛋黄不仅具有高的营养价值,在食品加工等方面也有重要的地位;是一种有效的乳化剂,可以用来稳定蛋黄酱、沙拉酱和冰激凌等乳状食品;蛋黄还是一种冻融保护剂,被添加在动物的精液冻藏保护液中。蛋黄的这些功能特性与其组成及结构密切相关,其中,发挥乳化和冻融保护作用的主要成分就是低密度脂蛋白(low density lipoprotein,LDL)。
LDL是蛋黄的主要组成部分,大约占蛋黄干重的2/3,主要存在于卵黄浆质中,在卵黄颗粒中也有少量LDLg(LDL in granule)存在。LDL与鸡血液中的极低密度脂蛋白(very low density lipoprotein,VLDL)相似,在下蛋母鸡的肝脏中合成,通过血液转运到卵母细胞,再通过一系列生物作用形成蛋黄中的LDL。将针对LDL的分离提取、理化性质、乳化功能和冻融保护性几个方面进行阐述。
1 低密度脂蛋白(LDL)的分离提纯
对鸡蛋黄中低密度脂蛋白的分离提取主要包括物理和化学的方法,目前较多采用的是物理分离操作。
1.1 化学提取方法
鸡蛋黄黏度较高,采用物理方法很难分离卵黄浆质和卵黄颗粒,Fevold等[1]发现利用乙醚分离提取含有低密度组分的上清液的方法。Turner等[2]利用乙醚提取鸡蛋黄中的低密度脂蛋白,得到的目标成分溶解度大大降低,得率为80%,这种物质被定义为低密度的含脂组分,且这种提取方法受到提取时间、温度和盐浓度的影响(影响脂质的提取量和可溶性及不溶性脂蛋白的量);另外,在早期的分离提取方法中,离心操作时间均较长,不适合工业化生产。
1.2 物理提取法
LDL的密度为0.982 g/mL,在盐溶液中离心以后以上清液的形式存在,因此,物理的分离提取方法以离心操作为主。物理分离方法也经历了不断的改进与更新。
1964年,Martin等[3]先将蛋黄与等体积的水混合稀释,第1次离心(75 000×g,5℃,1 h),取上清液,加入到1 mol/L的 NaCl溶液中,第 2次离心(75 000×g,5℃,16 h),再对悬浮的半固体层用1 mol/L的NaCl溶液进行分散处理,然后离心。这种操作没有使用有机试剂,完整地保留了LDL的溶解性,且分离得到2种低密度物质:LDF1和LDF2,但是耗时较长(2次离心需16 h),LDL粗提物中的盐离子去除不完全。
2002年,Moussa等[4]分离卵黄浆质得到含有LDL的上清液,将上清液与饱和度40%的硫酸铵混合并搅拌处理,然后离心(10 000×g,4℃,45 min),上清液透析除去硫酸铵,再离心(10 000×g,4℃,45 min)得到富集了LDL的上清液。硫酸铵的加入能够除去卵黄球蛋白的污染,有助于后续的脱辅基蛋白纯化操作。这种方法已广泛应用于试验研究和生产实践中。
2 LDL的结构与组成
为了获得LDL的构象、粒径等物理性质方面的信息,应用不同的技术手段进行了研究。在1972年对LDL蛋白物理研究中,Kamat等[5]采用红外光谱(IR)、电子自旋共振光谱(electron spin resonance,ESR)、高分辨率的质子磁共振光谱(high-resolution proton magnetic resonance spectroscopy,high - resolution PMRS)、宽行核磁共振光谱(broad-line nuclear magnetic resonance spectroscopy,broad - line NMRS)、X-射线和电镜等技术对LDL的构象、蛋白质和脂质的动态及它们之间的相互作用进行研究,观察到LDL主要以无序和反向平行的β-折叠的构象存在,且蛋白质与脂质之间存在相互作用。透射电镜(TEM)结果显示LDL呈球形结构,颗粒度分布在20~60 nm之间,平均直径大约为 35 ~ 40 nm[6]。薛慧君[7]采用AFM观测鸡蛋黄中LDL的表面形貌,发现成像结果与LDL的纯度、浓度有关,在较低浓度时,较易得到单个LDL,尺寸一般在50~80 nm之间,随着其浓度的增加,成像的尺寸也随之增大,直至形成LDL的聚合物,认为聚集体的形成可能与脂蛋白的乳化性质有关。为了了解LDL中功能性分子基团对蛋黄乳化性的控制作用,借助激光拉曼光谱和傅里叶变换红外光谱检测LDL的结构功能团,检测到了LDL中对称CH2及不对称CH3的伸缩振动、脂链中P O的伸缩振动和磷脂中胆碱聚集体的N+(CH3)3的不对称振动,这些信息不能够完全地解释LDL中功能性分子基团对蛋黄乳化性的影响,可根据具体情况选择合适的检测方式对此进行完善,作为一个新的研究方向。
Marc Anton[8]通过对LDL的结构研究总结并模拟出一个模型:球形纳米颗粒(颗粒大小17~60 nm),密度为0.982 g/mL[9-10],有1 个由三酰甘油和胆固醇组成的脂质核心(流动状态),这个中性脂质核心周围有1层单层磷脂膜,蛋白质镶嵌在单层膜上,磷脂膜的疏水特性保证了LDL的结构稳定有时也会有一些胆固醇镶嵌在单层膜上,增加单层膜的强度,电镜和X-射线衍射结果证明在LDL的表面脂质和蛋白质占据不同的区域,两者之间没有强烈的相互作用。结构见图1。
磷脂对LDL结构的稳定起着重要作用,因为LDL结合的主要作用力是疏水相互作用[11],而镶嵌在磷脂膜上的胆固醇能够增强LDL的强度。
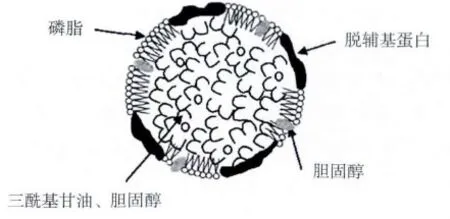
图1 蛋黄LDL的结构示意图[9]
LDL中含有12%的蛋白质和87%的脂质[9],脂质中各组分的比例是:71%三酰甘油酯、25%磷脂(PC/PE大约为6.1)和4%胆固醇;磷脂与三酰甘油的比例大约为0.35。蛋白质是LDL的主要组成成分,是其实现不同加工特性的关键。
3 LDL脱辅基蛋白
对LDL脱脂处理得到几种脱辅基蛋白,Anton[6]通过SDS-PAGE分离得到了5个蛋白条带,相对分子质量分别为:15 000、60 000、65 000、80 000 和 130 000(图2a),其中15 ku的蛋白比较容易纯化,且具有较强的表面活性;Jolivet等[12]通过SDS-PAGE分离得到了9个蛋白条带,相对分子质量分别为:8 000、15 000、55 000、62 000、73 000、96 000、98 000、118 000和190 000(图2b)。

图2 LDL中脱辅基蛋白的SDS-PAGE
LDL的前体物质是母鸡血液中的极低密度脂蛋白(very low density lipoprotein,VLDL)[13],母鸡血液VLDL中的2种主要的脱辅基蛋白:ApoB和ApoVLDLⅡ,通过不同的途径转移到鸡蛋黄中,形成LDL的不同种类的脱辅基蛋白;ApoB在从母鸡血液中转移到鸡蛋黄的过程中有3个位置被酶解,形成了鸡蛋黄脂蛋白中的所有高分子质量的脱辅基蛋白,分别对应了鸡蛋黄脂蛋白中的4种脱辅基蛋白:ApovitelleninⅢ-Ⅵ,具体的酶解位点未知[14];鸡蛋黄中的脱辅基蛋白ApovitelleninⅠ是从母鸡血液中的ApoVLDLⅡ转变而来,可能是通过卵母细胞表面的受体胞吞作用完整保留下来的一种脱辅基蛋白[15];而鸡蛋黄中的ApovitelleninⅡ中没有标记物存在,说明这种脱辅基蛋白不是由VLDL转运而来,可以对这种蛋白的“源头”进行研究,对鸡蛋黄中LDL的合成途径有更清晰的认识。
3.1 脱辅基蛋白的理化研究进展
Martin 等[3]根据 LDF(LDL)的偏比容(partial specific volume)将其分离得到2种物质:LDF1(10×106)和LDF2(3×106),约各占总量的1/5和4/5。
Anton等[6]通过 SDS-PAGE从纯化后的 LDL中分离得到5(或6)条脱辅基蛋白的条带,利用凝胶过滤色谱对LDL进行纯化,得到3个峰,其中峰A对应于条带1和2,峰B对应于条带3和4,峰C对应于15 000的条带5,130 000和65 000的蛋白质属于糖基化蛋白[16]。
Jolivet等[12]利用SDS-PAGE 从 LDL中分离得到9条不同的蛋白条带,根据胰蛋白酶消化、Swiss-Prot和NCBI数据库查询结果鉴定出2个载脂蛋白:Apovitellenin I和 Apolipoprotein B。Jolivet等[17]利用结构蛋白组学的方法对LDL中获得Apo B进行了更深入的研究,发现母鸡血液中的Apo B酶作用成熟后形成9个蛋白片段,其中有2个片段中β-折叠含量很高,与脂质紧密连接,且不易被蛋白酶K接近,与人类的载脂蛋白B-100中的五分裂(pentapartite)结构(NH2-α1-β1-α2-β2-α3-COOH)相似。
鸡蛋黄中 ApovitelleninⅠ的一级结构已经被Dopheide等[18]通过自动和手动测序法测定,被证明是单体或二聚体,有82个氨基酸残基,相对分子质量为 9 331,Burley等[19]证明了 ApovitelleninⅠ以二聚体形式存在时的稳定作用力是通过2条链间的二硫键提供的。Jolivet等[12,17]将鸡蛋黄中的 LDL 分离提纯后对其进行酶解,得到不同的蛋白片段,采用液质联用技术对这些成分进行分析,得到了9个主要的电泳条带,相对分子量范围分布在8 000~190 000,条带8和9对应的是ApovitelleninⅠ(相对分子质量分别为9 000和15 000),条带1~7则是ApoB的酶解产物(ApoB在鸡卵母细胞中被组织蛋白酶D或类似组织蛋白酶的对胃蛋白酶抑制剂敏感的蛋白酶酶解),根据NCBI数据库的信息对这9个条带进行鉴别:条带1~条带7的登记号码是XP_419 979,条带8~条带9的登记号码是P02 659。
3.2 脱辅基蛋白的组学研究进展
关于鸡蛋不同部位的组学研究中发现在蛋黄膜、蛋清和蛋黄中均有不同脱辅基蛋白存在,例如,水洗和盐洗处理获得的蛋黄膜(vitelline membrane,VM)的组学分析中有apovitellenin-1(emPAI 9.0)、apoB(emPAI 3.9)和 apoA - Ⅰ(emPAI 0.7)[20];蛋清中发现有 apoA - Ⅰ(emPAI 0.6)[21-22];蛋黄中这些脱辅基蛋白的含量较高,且种类多,apovitellenin-1(emPAI 157.5)、apoB(emPAI 7.3)、apoA - Ⅰ(em-PAI 18.7)、类似apoH的蛋白(emPAI 12.3)和类似apoC - Ⅲ (emPAI 9.0)[23]。Farinazzo 等[24]通 过CPLL对蛋黄浆质部分进行组学研究,检测到apoB、apovitellenin-1前体、apoH39 000蛋白、apoA-Ⅰ前体、apoB31 000蛋白和apoB51 000蛋白等。
4 鸡蛋黄中LDL的乳化特性
蛋白质组分在界面膜上主要作用有2个:与油-水界面的蛋白质结合从而降低表面张力;蛋白膜具有一定的黏弹性,能够形成一个机械屏障,阻止界面膜的破坏。蛋白质也可以控制凝胶组分的相互作用,调节聚集和絮凝作用。影响蛋白质乳化特性的主要因素可能是蛋白质的分子柔韧性、溶解度和疏水性[25-27]。这些性质由蛋白质不同的理化性质决定:分子大小,氨基酸的组成和序列,构象和带电荷数;另外还有一些外在影响因素:分离方法,pH,离子强度,与其他组分的相互作用,及一些技术处理方法[28]。鸡蛋黄LDL中的脱辅基蛋白的平均等电点在6.5~7.3[29]。LDL脱辅基蛋白的氨基酸中有40%左右的疏水性氨基酸[30]。
由于大量LDL的存在,卵黄浆质可以在任何条件下溶解。在对蛋黄乳化特性的研究中普遍认为LDL是主要的乳化成分。LDL和卵黄球蛋白在食品乳状液中能够显著的溶解,能够在界面处有效地、竞争性地吸附,因此在许多情况下这些蛋白质都可以作为乳化剂使用[17]。有研究证明卵黄浆质的乳化特性优于蛋黄和卵黄颗粒[31]。Le Denmat等[32]研究了不同理化条件下蛋黄、卵黄浆质和卵黄颗粒在水包油的溶液中的乳化特性,结果证明乳化特性最好的当属卵黄浆质,其中的脂蛋白(apo-LDL)是最主要的乳化成分。Mizutaki等[33]证明LDL的乳化特性优于牛血清蛋白,这可能是因为LDL具有较强的脂结合能力。
LDL在油水界面的乳化作用机理可能是LDL胶团吸附在油水界面以后裂解、LDL中的中性脂核心与油相结合,其余部分在界面上分散;LDL胶团的吸附、裂解的程度依赖于环境条件的变化。磷脂在界面的吸附并不完全,只有部分能够结合到油水界面[34]。
Martinet等[35]用朗缪尔膜天平(Langmuir film balance)和原子力显微镜(atomic force microscopy,AFM)研究了气/液界面上LDL的表面作用机制,研究结果表明,LDL在界面处被破坏,释放出大量的中性脂质,从而赋予了LDL扩散能力。Dauphas等[36]研究了LDL在气/液和油/水界面的吸附特性。研究结果表明,LDL在气/液界面的分散情况与油/水界面相反:在pH 7时比pH 3时分散性好,与载脂蛋白—磷脂混合物在气/液界面的分散情况相似;LDL在气/液界面处形成1个含有中性脂质、载脂蛋白和磷脂的界面膜,在油/水界面形成1个含有载脂蛋白和磷脂的界面膜。后来又发现LDL的流变学特性与载脂蛋白组成结构有关(可能是形成了1个载脂蛋白网络结构)[37]。Dauphas等[38]又对表面压力在 30~45 mN/m的鸡蛋黄LDL的结构改造情况进行研究,采用AFM作为研究手段,在不同的表面压力下LDL膜的结构差异明显。在压力不断的过程中,LDL膜会发生3次主要变化,包括脂蛋白-脂质转变、磷脂破坏和中性脂质的破坏。其中第1次转变(π=19 mN/m)被认为是自由的中性脂质的破坏引起的,第2次转变(π=41 mN/m)是由于脂蛋白和磷脂的混合导致,第3次转变(π=51 mN/m)是在载脂蛋白和磷脂混合后,磷脂单层膜的破坏。
但是,LDL中的蛋白质和磷脂的直接吸附是不容易的,因为它们在水中或缓冲溶液中是不溶解的。因此,蛋白质与脂质之间组成LDL的相互作用对于该乳化剂的乳化特性是比较重要的。
5 鸡蛋黄LDL冻融保护特性
人工受精被广泛应用于家畜的繁殖,精液的保存是关键,目前较多的精液保存方法是冻藏。然而,在冻结的过程中形成的冰晶可能会通过机械作用或渗透作用而破坏精子膜。因此,将精子与保护介质迅速混合再进行冻结处理。在早期,人们用蛋黄作为一种冷冻防护剂,但是,蛋黄的保护机制并不确定。许多学者认为主要由LDL组成的蛋黄的低密度部分是有效的抗热激和提高精子成活率的主要成分[39-40]。
Moussa等[4]将鸡蛋黄中的LDL分离纯化后应用于公牛精液的冻融保存,并将其效果与含有蛋黄的商业冻融防护剂进行比较,发现LDL组的效果更好,证实了LDL是蛋黄中冻融保护的主要作用因子。
Briand等[41]研究了鸡蛋黄 LDL冻融保护的公牛精液在人工授精过程中的受孕情况,发现精子的体内受孕能力被保存了下来。也有研究将谷氨酸盐加入到鸡蛋黄LDL冻融防护剂中用于公牛精液的保藏[42],初步研究结果表明添加10 mmol/L的谷氨酸盐到鸡蛋黄LDL冻融防护剂中可以显著提高公牛精子的活力。
Bencharif等[43]将鸡蛋黄LDL用于犬类精液的冻藏保护,针对含有20%(V/V)蛋黄的保护介质与含有不同浓度的LDL的介质进行研究,发现在解冻过程中,6%LDL(M/V)时冻融保护效果最佳,精子活动能力是55.3%,远远高于蛋黄组的27.7%;与蛋黄组相比,LDL组能够更好的改进在冻结过程中顶体、鞭毛质膜和DNA的完整性;6%的LDL组冻藏的精子的2次受孕率能够达到100%。Junior等[44]也对鸡蛋黄LDL对狗的精液冻融保护性能进行研究,证明了6%LDL冻融保护效果最好、经济效益最高。Bencharif等[45]对鸡蛋黄LDL与谷氨酸盐结合使用时对犬类精液的冻融保护能力进行研究,从顶体精子完整性、鞭毛质膜及DNA的完整性几个方面证明了6%LDL+20 mmol/L谷氨酸盐试验组的冻融保护能力较6%LDL组更强。
LDL具有比鸡蛋黄更好的冻融保护性,与不同冻融保护剂的协同作用也有报道,但是,这些现象产生的机理未知,是深入应用鸡蛋黄LDL的阻碍。
6 前景与展望
鸡蛋黄LDL的分子质量、结构、组成、功能特性都取得了不同水平的研究成果,但还存在一些不足,本研究根据自身对鸡蛋黄LDL相关知识的积累提出以下几个新的研究方向。
关于鸡蛋黄LDL的结构的研究,法国农业部已经做了大量的相关工作,对鸡蛋黄LDL的结构进行形象的描述,对其组成也有了一些了解,其中,LDL的脱辅基蛋白的研究涉及到了母鸡的产卵过程中血清LDL脱辅基蛋白的酶解及转运,已经有针对鸡蛋黄LDL的Apovitellenin I及ApovitelleninⅢ-Ⅵ的来源的研究,但是ApovitelleninⅡ的具体来源没有得到解释,且无后续研究,这是需要解决的一个问题。
LDL由脱辅基蛋白与中性脂质、磷脂等组装而成,虽然对于鸡蛋黄LDL的脱辅基蛋白组成有一定程度的认识,但是这些脱辅基蛋白如何与鸡蛋黄内的卵磷脂、三酰甘油、胆固醇等脂类组装成LDL,脂质与蛋白质之间的相互作用方式都不得而知。希望对鸡蛋黄LDL与鸡血清LDL、人血清LDL的功能特性比较给予更多的关注,为鸡蛋黄LDL的营养研究开辟思路。
关于鸡蛋黄LDL的冻融保护能力的应用已经有了长足的发展,但是LDL的冻融保护机理并未明确提出,可以针对其冻融保护机制进行深入研究,了解LDL为什么具有这一特性,是怎么实现冻融保护的能力,为更充分的利用这一天然资源提供理论依据。
鸡蛋黄LDL中脂质成分与蛋白质成分之间的相互作用机制鲜见报道,目前关于生物体蛋白质—脂质之间互作机理的研究都是基于生物膜,而鸡蛋黄LDL是一个球形结构,这些研究方法在LDL的蛋白—脂质互作研究上是否适用还需进一步研究。
鸡蛋黄LDL已经被大量研究但是仍然存在许多未知领域,值得更多的关注。希望对这些问题进行梳理、研究,拓宽对鸡蛋黄LDL的加工应用。
[1]Fevold H,Lausten A.Isolation of a new lipoprotein,lipovitellenin,from egg yolk[J].Archives of Biochemistry,1946,11:1-7
[2]Turner K,Cook W.Molecular weight and physical properties of a lipoprotein from the floating fraction of egg yolk[J].Canadian Journal of Biochemistry and Physiology,1958,36(9):937-949
[3]Martin W,Augustyniak J,Cook W.Fractionation and characterization of the low-density lipoproteins of hen's egg yolk[J].Biochimica et Biophysica Acta(BBA)- Specialized Section on Lipids and Related Subjects,1964,84(6):714 -720
[4]Moussa M,Martinet V,Trimeche A,et al.Low density lipoproteins extracted from hen egg yolk by an easy method:cryoprotective effect on frozen - thawed bull semen[J].Theriogenology,2002,57(6):1695 -1706
[5]Kamat V,Lawrence G,Barratt M,et al.Physical studies of egg yolk low density lipoprotein[J].Chemistry and Physics of Lipids,1972,9(1):1 -25
[6]Anton M,Martinet V,Dalgalarrondo M,et al.Chemical and structural characterisation of low-density lipoproteins purified from hen egg yolk[J].Food Chemistry,2003,83(2):175-183
[7]薛慧君.卵黄低密度脂蛋白的结构检测及卵黄蛋白的乳化性研究[D].西安:陕西师范大学,2010
[8]Anton M.Egg yolk:structures,functionalities and processes[J].Journal of the Science of Food and Agriculture,2013,93(12):2871-2880
[9]Martin W,Turner K,Cook W.Macromolecular properties of vitellenin from egg yolk and its parent complex with lipids[J].Canadian Journal of Biochemistry and Physiology,1959,37(10):1197-1207
[10]Anton M.Low -density lipoproteins(LDL)or lipovitellenin fraction[M].Bioactive Egg Compounds:Springer;2007:7 -12
[11]Saari A,Powrie W,Fennema O.Isolation and characterization of low-density lipoproteins in native egg yolk plasma[J].Journal of Food Science,1964,29(3):307 -315
[12]Jolivet P,Boulard C,Beaumal V,et al.Protein components of low - density lipoproteins purified from hen egg yolk[J].Journal of Agricultural and Food Chemistry,2006,54(12):4424-4429
[13]Evans AJ,Burley RW.Proteolysis of apoprotein B during the transfer of very low density lipoprotein from hens'blood to egg yolk[J].Journal of Biological Chemistry,1987,262(2):501-504
[14]Burley Rw,Sleigh Rw,Shenstone Fs.Lipoproteins from the blood and egg yolk of the hen[J].European Journal of Biochemistry,1984,142(1):171 -176
[15]Dugaiczyk A,Inglis A,Strike P,et al.Comparison of the nucleotide sequence of cloned DNA coding for an apolipoprotein(apoVLDL-II)from avian blood and the amino acid sequence of an egg-yolk protein(apovitellenin I):equivalence of the two sequences[J].Gene,1981,14(3):175 -182
[16]Yamauchi K,Kurisaki J- i,Sasago K.Polypeptide composition of hen's egg yolk very low density lipoprotein[J].Agricultural and Biological Chemistry,1976,40(8):1581 -1586
[17]Jolivet P,Boulard Cl,Chardot T,et al.New insights into the structure of apolipoprotein B from low-density lipoproteins and identification of a novel YGP-like protein in hen egg yolk[J].Journal of Agricultural and Food Chemistry,2008,56(14):5871-5879
[18]Dopheide T,Inglis A.Primary structure of apovitellenin I from hen egg yolk and its comparison with emu apovitellenin I[J].Australian Journal of Biological Sciences,1976,29(3):175-180
[19]Burley R,Davies W.Studies on the apoproteins of the major lipoprotein of the yolk of hen's eggs II.The dimer- tetramer transition of apovitellenin I[J].Australian Journal of Biological Sciences,1976,29(4):317 -324
[20]Mann K.Proteomic analysis of the chicken egg vitelline membrane[J].Proteomics,2008,8(11):2322 -2332
[21]Mann K.The chicken egg white proteome[J].Proteomics,2007,7(19):3558 -3568
[22]D’Ambrosio C,Arena S,Scaloni A,et al.Exploring the chicken egg white proteome with combinatorial peptide ligand libraries[J].Journal of Proteome Research,2008,7(8):3461-3474
[23]Mann K,Mann M.The chicken egg yolk plasma and granule proteomes[J].Proteomics,2008,8(1):178 -191
[24]Farinazzo A,Restuccia U,Bachi A,et al.Chicken egg yolk cytoplasmic proteome,mined via combinatorial peptide ligand libraries[J].Journal of Chromatography A,2009,1216(8):1241-1252
[25]Shimizu M,Takahashi T,Kaminogawa S,et al.Adsorption onto an oil surface and emulsifying properties of bovine.alpha.s1 - casein in relation to its molecular structure[J].Journal of Agricultural and Food Chemistry,1983,31(6):1214-1218
[26]Nakai S.Structure- function relationships of food proteins:with an emphasis on the importance of protein hydrophobicity[J].Journal of Agricultural and Food Chemistry,1983,31(4):676-683
[27]Kato A,Nakai S.Hydrophobicity determined by a fluorescence probe method and its correlation with surface properties of proteins[J].Biochimica et Biophysica Acta(BBA)-Protein Structure,1980,624(1):13 -20
[28]Kinsella JE.Functional properties of soy proteins[J].Journal of the American Oil Chemists’Society,1979,56(3):242-258
[29]Kojima E,Nakamura R.Heat gelling properties of hen's egg yolk low density lipoprotein(LDL)in the presence of other protein[J].Journal of Food Science,1985,50(1):63 -66
[30]Tsutsui TO,T.Hydrophobic components in delipidated granule of egg yolk[J].Agricultural and Biological Chemistry,1982,46:2587 -2589
[31]Dyer - Hurdon J,Nnanna I.Cholesterol content and functionality of plasma and granules fractionated from egg yolk[J].Journal of Food Science,1993,58(6):1277 -1281
[32]Le Denmat M,Anton M,Beaumal V.Characterisation of emulsion properties and of interface composition in O/W emulsions prepared with hen egg yolk,plasma and granules[J].Food Hydrocolloids,2000,14(6):539 -549
[33]Mizutani R,Nakamura R.Physical state of the dispersed phases of emulsions prepared with egg yolk low density lipoprotein and bovine serum albumin[J].Journal of Food Science,1985,50(6):1621 -1623
[34]Kiosseoglou V,Sherman P.The influence of egg yolk lipoproteins on the rheology and stability of O/W emulsions and mayonnaise[J].Colloid and Polymer Science,1983,261(6):502-507
[35]Martinet V,Saulnier P,Beaumal V,et al.Surface properties of hen egg yolk low-density lipoproteins spread at the airwater interface[J].Colloids and Surfaces B:Biointerfaces,2003,31(1):185 -194
[36]Dauphas S,Beaumal V,Riaublanc A,et al.Hen egg yolk low -density lipoproteins filmspreading at the air-water and oilwater interfaces[J].Journal of Agricultural and Food Chemistry,2006,54(10):3733 -3737
[37]Dauphas S,Beaumal V,Gunning P,et al.Structures and rheological properties of hen egg yolk low density lipoprotein layers spread at the air- water interface at pH 3 and 7[J].Colloids and Surfaces B:Biointerfaces,2007,57(1):124 -133
[38]Dauphas S,Beaumal V,Gunning P,et al.Structure modification in hen egg yolk low density lipoproteins layers between 30 and 45mN/m observed by AFM[J].Colloids and Surfaces B:Biointerfaces,2007,54(2):241 -248
[39]Pace M,Graham E.Components in egg yolk which protect bovine spermatozoa during freezing[J].Journal of Animal Science,1974,39(6):1144 -1149
[40]Quinn P,Chow P,White I.Evidence that phospholipid protects ram spermatozoa from cold shock at a plasma membrane site[J].Journal of Reproduction and Fertility,1980,60(2):403-407
[41]Amirat- Briand L,Bencharif D,Vera - Munoz O,et al.In vivo fertility of bull semen following cryopreservation with an LDL(low density lipoprotein)extender:Preliminary results of artificial inseminations[J].Animal Reproduction Science,2010,122(3-4):282-287
[42]Amirat- Briand L,Bencharif D,Vera - Munoz O,et al.Effect of glutamine on post-thaw motility of bull spermatozoa after association with LDL(low density lipoproteins)extender:preliminary results[J].Theriogenology,2009,71(8):1209-1214
[43]Bencharif D,Amirat L,Anton M,et al.The advantages of LDL(low density lipoproteins)in the cryopreservation of canine semen[J].Theriogenology,2008,70(9):1478 -1488
[44]Varela Junior AS,Corcini CD,Ulguim RdR,et al.Effect of low density lipoprotein on the quality of cryopreserved dog semen[J].Animal Reproduction Science,2009,115(1):323-327
[45]Bencharif D,Amirat L,Pascal O,et al.The advantages of combining low-density lipoproteins with glutamine for cryopreservation of canine semen[J].Reproduction in Domestic animals,2010,45(2):189 -200.

