响应面法优化籼稻挥发性成分SPME萃取条件的研究
石嘉怿 张檬达 鞠兴荣
(南京财经大学食品科学与工程学院,南京 210046)
稻谷是世界上最重要的谷物之一,也是中国的主要粮种[1],年产量可达 1.8 亿 t[2]。稻谷在储藏期间,由于呼吸氧化作用和各种酶的作用,其品质必然会随着储藏时间的延长而发生变化,甚至劣变[3],Kaminski等[4]和 Michael等[5]利用分光光度法对谷物中的挥发性成分进行研究,表明稻谷的挥发性成分会随着储藏时间的延长而发生变化,但该分析方法并未对各个挥发性组分进行鉴定。
顶空固相微萃取(SPME)具有操作简单、样品制备时间短、精确性高、成本低及安全等特点,特别适合萃取含量微小的挥发、半挥发性物质[6]。赵峰等[7],吴继红等[8]分别采用此方法分析苹果中的芳香成分,测得了含量较少的醇类和酯类物质。近年来,利用顶空固相微萃取技术研究粮油中挥发性成分也引起了广泛兴趣和重视[9]:张玉荣等[10]采用SPME技术对不同储藏时间弱(强)筋小麦中的挥发性物质进行提取、鉴定和分析;林家永等[11]采用顶空固相微萃取结合气质联用技术对不同稻谷中的挥发性物质进行分析。但这些分析方法仅仅只对SPME的萃取条件进行单因素的研究,并没有进行系统优化,因此本研究在单因素试验的基础上,采用响应面分析法进一步优化籼稻中挥发性成分的SPME萃取条件,并采用SPME-GC-MS对储藏期间籼稻谷所产生的挥发性成分进行分析,以期为确定籼稻谷在储藏期间挥发性成分变化规律以及筛选特征标识物提供科学、客观的分析方法。
1 材料与方法
1.1 材料
晚籼稻:2011年入库,浙江省嘉兴粮库提供。
1.2 主要仪器
手动SPME进样器:南京大沪公司;GC(7890A)-MS(5975C)分析仪:美国Agilent公司;萃取头(50/30 μm DVB/CAR/PDMS):美国Supelco公司。
1.3 方法
1.3.1 固相微萃取头的老化
首次使用萃取头时,插入GC-MS进样口老化,老化时间120 min,老化温度250℃;萃取头每次使用前老化30 min,样品与样品之间老化5 min。
1.3.2 萃取
将20 g试样置于顶空萃取瓶中,以锡纸作隔垫,用橡胶塞封口,混合均匀样品后置于恒温水浴锅中加热平衡,一段时间后,将固相微萃取头插入瓶中萃取样品挥发性成分,完毕后立即将萃取头插入GCMS进样口,在250℃不分流模式下解析。
1.3.3 GC-MS参数条件及分析
1.3.3.1 色谱条件
色谱柱为HP-5MS毛细管柱(30 m×0.25 mm,0.25μm);升温程序为:起始柱温50℃,保持5 min,以12℃/min上升到125℃,保持3 min,然后以1℃/min上升到165℃,保持3 min后以14℃/min上升到230℃,保持2 min,运行结束后冷却2 min,温度降为50℃。载气为氦气,流速为1 mL/min,不分流模式,进样口温度为250℃。
1.3.3.2 质谱条件
离子源为EI,离子源温度为230℃,电子能量为70 ev,质量扫描范围(m/z)为35~400 amu。
1.3.4 定性与定量分析
定性方法:未知挥发性成分经计算机检索与NIST08标准质谱库匹配得到,选择匹配度大于80的挥发性组分进行分析。
定量方法:相对百分含量按峰面积归一化计算。
1.3.5 试验设计
1.3.5.1 单因素试验
选取50/30μmDVB/CAR/PDMS规格的萃取头,对萃取量、萃取温度、平衡时间、萃取时间、解析时间5个因素进行试验,分析各因素对离子色谱图峰面积的影响。
1.3.5.2 响应面试验
在单因素试验基础上,根据Box-Behnken Design方案的设计原理,以离子色谱图峰面积为响应值,单因素试验最佳值为中心点,进行四因素三水平的组合设计,最后通过响应面分析得到最佳萃取条件。
1.3.5.3 样品检测
根据响应面分析得到的最佳萃取条件对样品进行检测,并对结果进行分析。
2 结果与分析
2.1 萃取条件的优化
2.1.1 萃取量的选择
选取50/30μmDVB/CAR/PDMS萃取头,固定萃取温度70℃,平衡时间60 min,萃取时间60 min,解析时间4 min,萃取量分别为10、15、20、25、30 g,考察萃取量对萃取效果的影响,结果如图1所示。
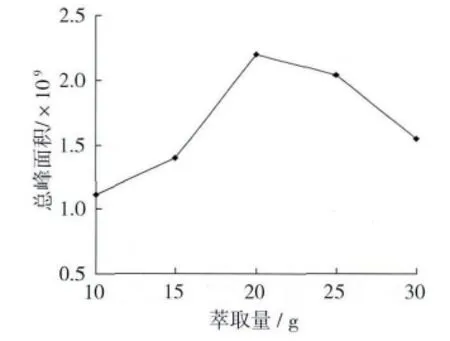
图1 萃取量对萃取效果的影响
萃取量对萃取时间及效果影响很大[12]。萃取量越大,萃取头吸附的物质越多,总峰面积越大;但萃取量过多会导致堆积过厚,水浴平衡时受热不均匀,物质不能很好地挥发出来,同时萃取头纤维吸附会出现饱和状态,不利于更好地萃取物质。由图1可知,随着萃取量的增加,总峰面积也随之增大,当萃取量为20 g时,总峰面积达到最大,之后有所减小,说明萃取量存在最佳点,因此选择20 g为最佳萃取量。
2.1.2 萃取温度的选择
选取50/30μmDVB/CAR/PDMS萃取头,固定萃取量为20 g,平衡时间60 min,萃取时间60 min,解析时间4 min,萃取温度分别为 50、60、70、80、90 ℃,考察萃取温度对萃取效果的影响,结果如图2所示。
顶空固相微萃取是比较敏感的样品处理方法,萃取温度对结果影响较大[6]。随着温度升高,气体分子运动加快,有利于物质更好地挥发出来,缩短达到吸附平衡的时间;但温度过高又会使挥发性物质与涂层之间的分配系数下降[13],降低纤维头的吸附量。由图2可知,萃取温度对总峰面积的影响效果显著,萃取温度为70℃时总峰面积达到最大,因此存在最佳值。

图2 萃取温度对萃取效果的影响
2.1.3 平衡时间和萃取时间的选择
选择50/30μmDVB/CAR/PDMS萃取头,在萃取量20 g,萃取温度70℃,萃取时间60 min,解析时间4 min 的条件下,平衡时间分别30、40、50、60、70 min,考察平衡时间对萃取效果的影响,结果如图3所示。
平衡时间决定挥发性成分和样品之间达到两相平衡的效果,同时影响萃取纤维头的吸附量和达到吸附平衡的时间[14]。由图3可知,总峰面积随着平衡时间的延长而增大,在60 min时达到最大值,随后趋于平缓,存在最佳值。
选择50/30μmDVB/CAR/PDMS萃取头,在萃取量为20 g,萃取温度70℃,平衡时间60 min,解析时间4 min的条件下,选择萃取时间为 30、40、50、60、70 min,考察萃取时间对总峰面积的影响,结果如图4所示。
固相微萃取的最佳萃取时间应该是挥发性成分在气相和涂层两相之间达到平衡的时间[13],由图4可知,随着萃取时间的延长,总峰面积也随之增大,在60 min时达到最大,存在最佳值,随后开始减小,这是由于萃取头纤维涂层吸附已经饱和,萃取时间过长导致热稳定性低的物质分解,因此总峰面积减小。
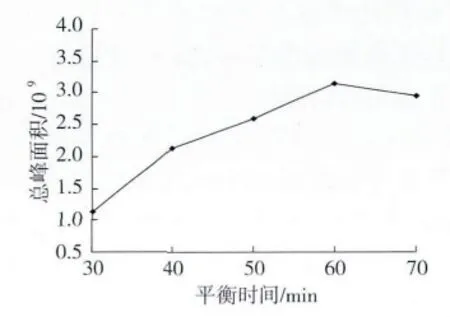
图3 平衡时间对萃取效果的影响
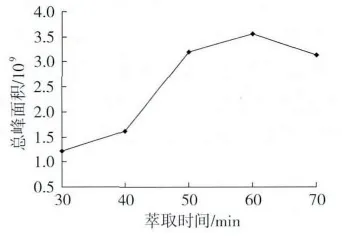
图4 萃取时间对萃取效果的影响
2.1.4 解析时间的选择
选择50/30μm DVB/CAR/PDMS萃取头,在萃取量20 g,平衡时间60 min,萃取温度70℃,萃取时间60 min 的条件下,解析时间选择 1、2、3、4、5 min,考察解析时间对萃取效果的影响,结果如图5所示。
解析时间对萃取效果的影响表现为:若解析时间短,会导致物质没有完全解析出来;若解析时间过长,会使色谱峰变宽,保留时间发生变化[15]。由图5可知,总峰面积随着解析时间的延长而增大,4 min过后趋于平缓,总峰面积基本不变,考虑到解析时间长会影响萃取头寿命,选择4 min为最佳值。
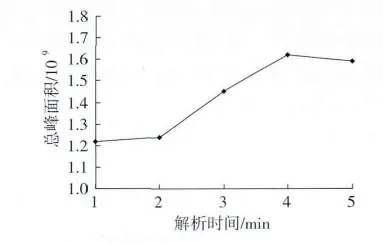
图5 解吸时间对萃取效果的影响
2.2 响应面法优化萃取条件
2.2.1 响应面因素的确定及试验方案
根据 Box- Behnken 试验设计原理[16-17],再综合单因素试验结果,选择50/30μm DVB/CAR/PDMS萃取头,固定萃取量为20 g,以萃取温度、平衡时间、萃取时间、解析时间为响应面因素,离子色谱总峰面积为响应值,进行四因素三水平的分析试验,响应面因素和水平见表1。
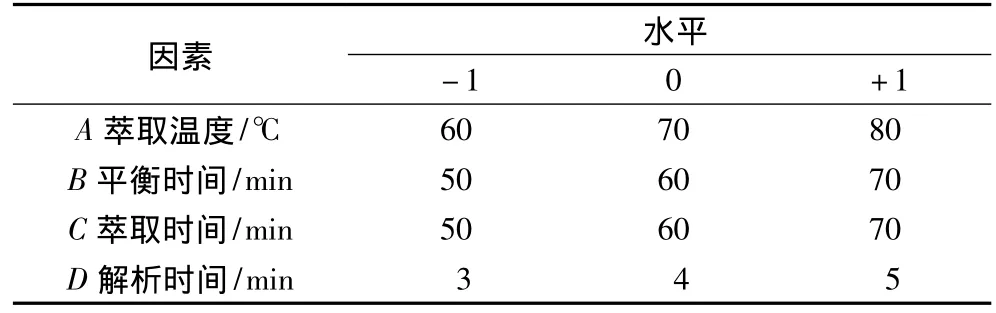
表1 响应面分析试验因素水平表
2.2.2 试验设计及回归分析
以离子色谱总峰面积为响应值进行响应面分析,试验设计为24个析因点和5个零点,零点处重复5次以估计试验误差。试验设计及结果见表2,回归结果分析见表3。通过Design Expert软件对表3中的结果进行二次回归分析,得到如下多元二次响应面回归模型:
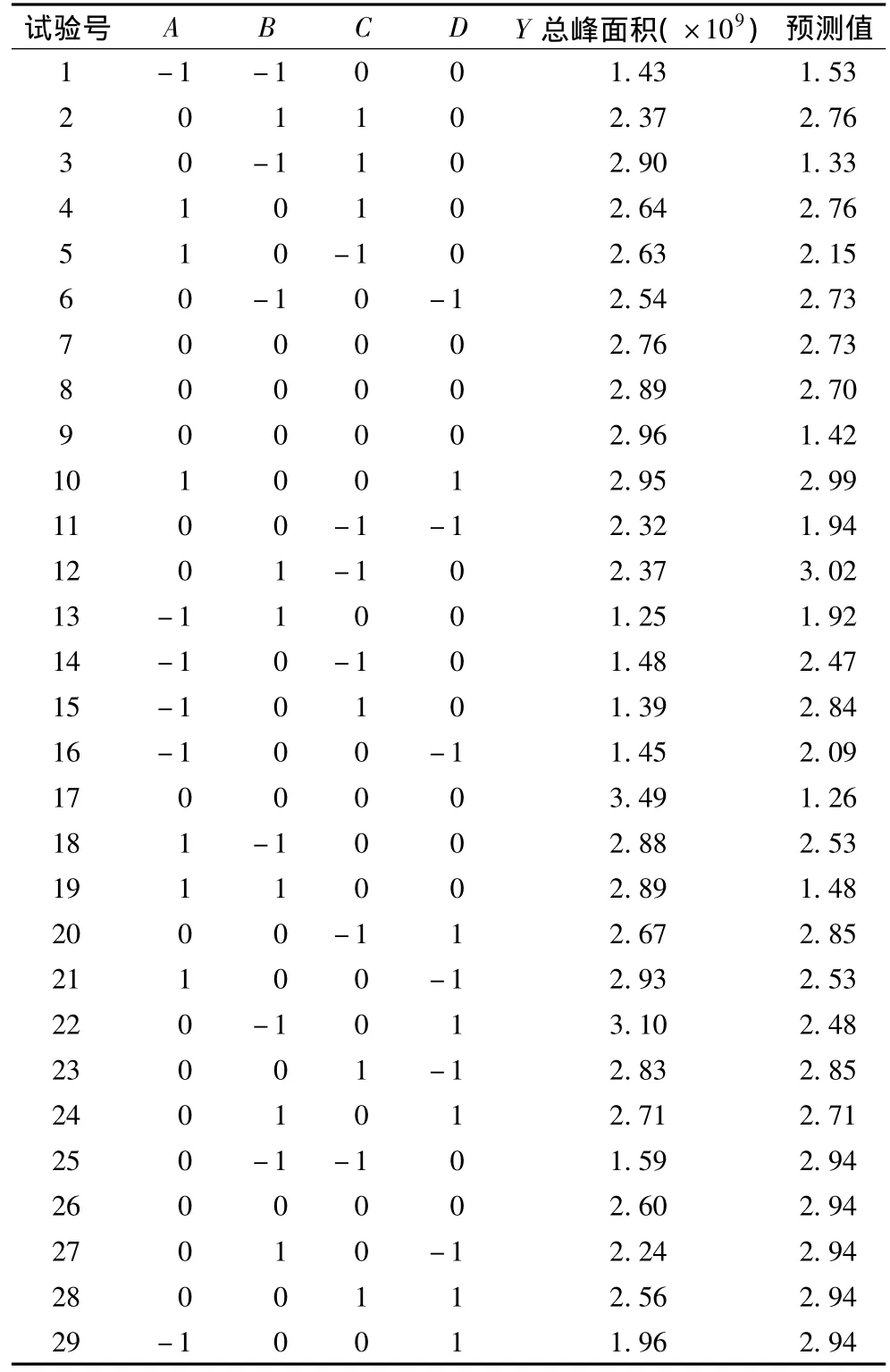
表2 试验设计和结果
Y=2.94+0.66A-0.051B+0.14C+0.14D+0.047AB+0.025AC-0.12AD-0.33BC-0.023BD-0.16CD-0.57A2-0.27B2-0.34C2-0.024D2
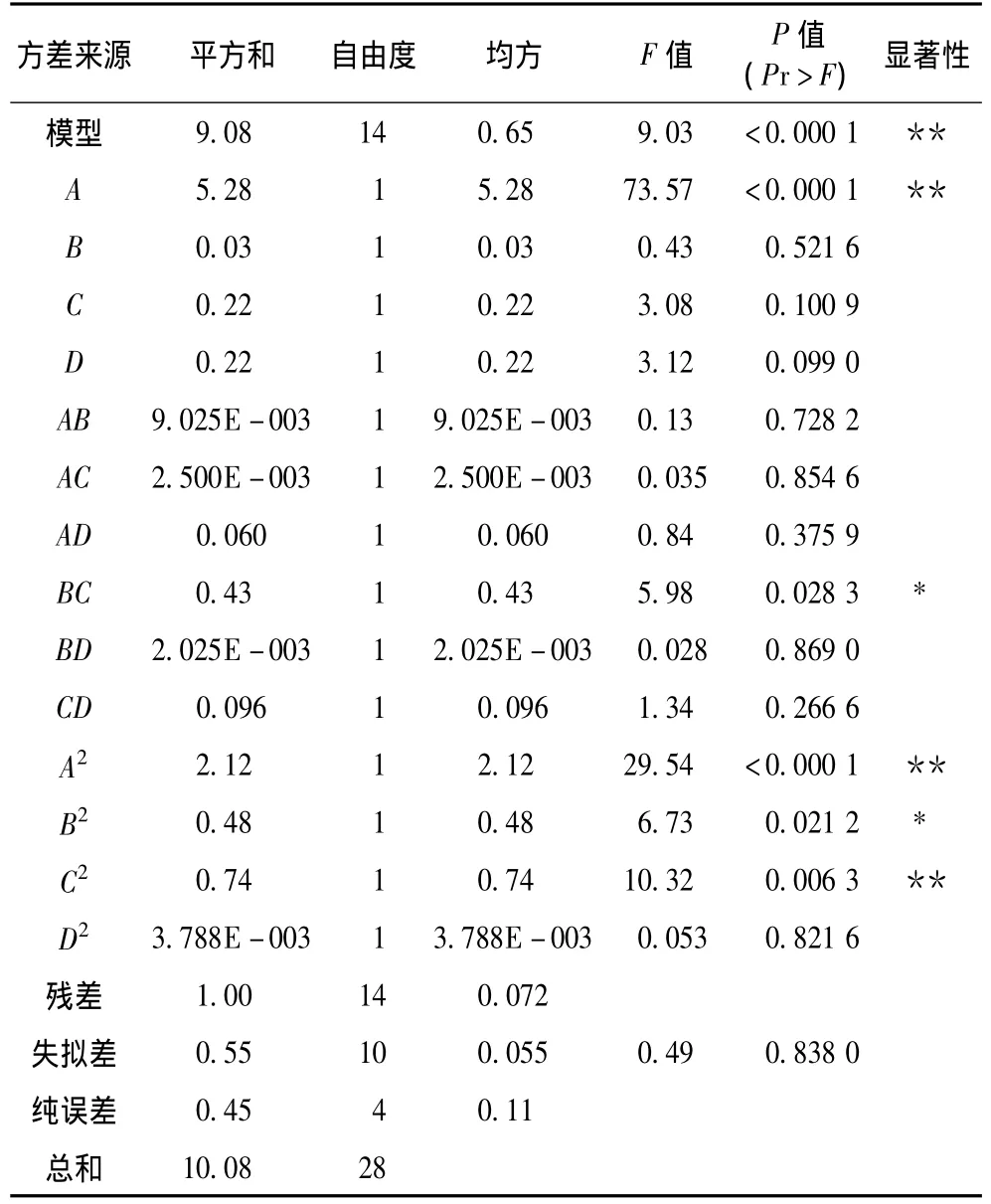
表3 回归分析结果
回归模型拟合度R2=0.900 3,表明试验值与预测值具有较好的相关性,校正拟合度=0.800 7,表明该回归模型可以解释80.07%的响应值的变化,19.93%左右的变异不能由回归模型来解释;残差为实际观测值与回归估计值之间的差,它的平方和反应了模型拟合程度,残差越小,拟合程度越高,表3中残差平方和为0.072,说明回归模型拟合程度较高;同时信噪比(Adeq precision)为9.163(通常大于4模型较好),进一步说明模型设计具有较好的拟合性。
由表3可以看出,BC、B2对结果影响较显著(P<0.05),回归模型及其显著(P<0.01),表明拟合程度较好,此试验具有很高的可信性和准确性;失拟项极其不显著,说明试验误差较小;一次项中,A(萃取温度)对结果的影响极其显著(P<0.01),说明萃取温度是影响离子色谱总峰面积的关键因素,二次项A2、C2对结果的影响也是极其显著的。同时,从F值的大小可以判断,4个因素对总峰面积影响程度的排序为A(萃取温度)>D(解析时间)>C(萃取时间)>B(平衡时间)。2.2.3 响应面曲面分析
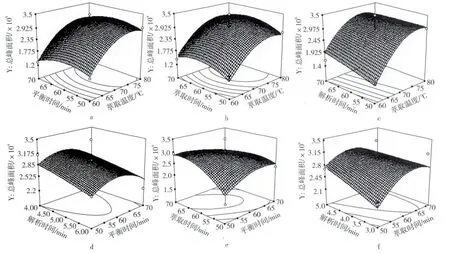
图6 萃取温度、平衡时间、萃取时间、解析时间两两交互作用对萃取效果的影响
图6 反应了萃取温度、平衡时间、萃取时间、解析时间两两交互作用对响应值总峰面积的影响,图6中可以看出,萃取温度和解析时间对总峰面积的影响最大,表现为响应曲面较陡,这与方差分析的结果一致,并且随着温度升高,时间延长,响应值都是先升高后降低,说明存在极值点,根据萃取温度和解析时间,萃取温度和萃取时间,萃取时间和解析时间的响应曲面可看出对总峰面积影响最大的因素是萃取温度,其次是解析时间,然后是萃取时间,最后是平衡时间,这符合表3中得出的方差分析结果,结合响应面分析图和方差分析表得出最大响应值(Y)所对应的最佳的萃取条件为:萃取温度74.69℃,平衡时间58.79 min,萃取时间60.48 min,解析时间为5 min,结合实际条件,选择萃取温度75℃,平衡时间59 min,萃取时间60 min,解析时间5 min。
2.3 样品的检测
按照最佳萃取条件,即萃取温度75℃,平衡时间59 min,萃取时间60 min,解析时间5 min,对籼稻样品的挥发性成分进行测定分析,得到样品挥发性物质总峰面积为3.203 6×109,与预测值3.181 3×109非常接近,相对误差为0.69%,同时单因素试验得到样品挥发性物质的总峰面积为2.940 0×109,小于最佳萃取条件下得到的数值,说明用响应面法优化固相微萃取条件是更加合理可行的,同时共检测出烃类、醛类、酮类、醇类、酸酯类、含氮含氯含氧及杂环化合物84种,其中烃类物质含量最高,其次为醛类、含氮含氯含氧及杂环类、酸酯类、酮类、醇类。样品峰谱图如图7所示,测得的挥发性成分及相对含量如表4所示。
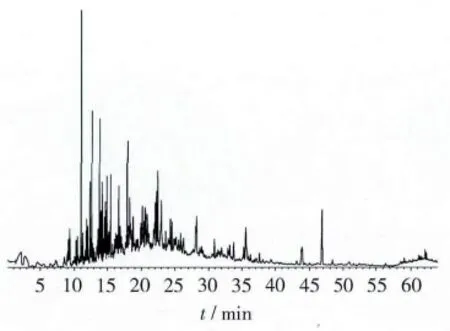
图7 籼稻的分析谱图

表4 籼稻中各类挥发性成分及相对含量

表4 (续)

表4 (续)
3 结论
在单因素试验的基础上,将响应面分析法应用于固相微萃取条件,回归分析模型显著,试验设计具有可行性,同时4个因素对响应值的影响不是简单的线性关系,方差分析和响应曲面结果显示,对总峰面积影响最大的2个因素为萃取温度和解析时间,其次是萃取时间,最后是平衡时间,响应面法优化固相微萃取稻谷挥发性成分的最佳处理条件为:萃取温度75℃,平衡时间59 min,萃取时间60 min,解析时间5 min,在此条件下得到的总峰面积为3.203 6×109,与预测值的相对误差为0.69%,共检出烃类、醛类、酮类、醇类、酸酯类、化合物84种,其中烃类和醛类物质含量最高、其次为含氮含氯含氧及杂环类、酸酯类、酮类、醇类。
[1]周显青,张玉荣.储藏稻谷品质指标的变化及其差异性[J].农业工程学报,2008:24(12):238 -242
[2]张来林,陆亨久,尚科旗.不同温度下稻谷的品质变化[J].粮食储藏,2005,34(6):32 -34
[3]周显青,张玉荣,赵秋红,等.稻谷新陈度的研究(四)—稻谷储藏过程中挥发性物质的变化及其与新陈度的关系[J].粮食与饲料工业,2005(2):1 -3
[4]Kaminski E,Przybylski R.Spectrophotometric determination of volatile carbonyl compounds as a rapid method for detecting grain spoilage during storage[J].Journal of Cereal Science,1985,3(2):165 -172
[5]Michael G L,Harold P D,Robert L O,et al.Instrumental analysis of volatiles from rice and corn products[J].Journal of Agriculture and Food Chemistry.1978,26(5):1035 -1038
[6]张义,高蓓,徐玉娟,等.顶空固相微萃取—气质联用方法分析龙眼中的挥发性化合物[J].食品科学,2010,31(16):156-160
[7]赵峰,王少敏,高华君,等.顶空固相微萃取—气质联用分析红富士苹果中的芳香物质[J].山东农业大学学报:自然科学版,2006,37(2):181 -184
[8]吴继红,胡小松,周珊,等.固相微萃取和气—质联用技术在快速测定苹果中挥发性成分中的应用[J].饮料工业,2003(3):39-41
[9]袁建,付强,高瑀珑,等.顶空固相微萃取-气质联用分析不同储藏条件下小麦粉挥发性成分变化[J].中国粮油学报,2012,27(4):106 -109
[10]张玉荣,高艳娜,林家永,等.顶空固相微萃取—气质联用分析小麦储藏过程中挥发性成分变化[J].分析化学研究报告,2010,38(7):953 -957
[11]林家永,高艳娜,吴胜芳,等.顶空固相微萃取—气质联用法分析稻谷挥发性成分[J].食品科学,2009,30(20):277-282
[12]Cuevas- Glory L F,Pino J A,Santiago L S,et al.A review of volatile analytical methods for determining the botanical origin of honey[J].Food Chemistry,2007,103(3):1032 -1043
[13]周珊,赵立文,马腾蛟.固相微萃取(SPME)技术基本理论及应用进展[J].现代科学仪器,2006(2):86-91
[14]张军安,陈波.顶空固相微萃取-气质联用分析酸枣仁挥发性成分[J].中药材,2012,35(2):235 -240
[15]娄方明,李群芳,张倩茹.固相微萃取-气相色谱-质谱联用分析云木香挥发油成分[J].药物分析杂志,2011,31(3):513-518
[16]Boxge P,Hunter W G.Statistics for experiments:An introduction to design,data analysis and model building[M].New York:Wiley,1990:289 -356
[17]Andenson T W.An introduction to multivariate statistical analysis[M].New York:Wiley,1990:186 -189.

