甲型肝炎病毒和戊型肝炎病毒双重荧光定量PCR方法的建立及应用
张 磊,鲁淑婷,李玉龙,黄洲风*
(1.河南省人民医院 血液病研究所,河南 郑州450003;2.郑州市第一人民医院 检验科,河南 郑州450004)
甲型肝炎病毒和戊型肝炎病毒双重荧光定量PCR方法的建立及应用
张磊1,鲁淑婷2,李玉龙1,黄洲风1*
(1.河南省人民医院 血液病研究所,河南 郑州450003;2.郑州市第一人民医院 检验科,河南 郑州450004)
摘要:目的建立甲型肝炎病毒(HAV)和戊型肝炎病毒(HEV)的双重荧光定量PCR检测方法并应用于临床样本的检测。方法根据参考文献分别选取HAV以及HEV基因组的保守区域设计合成特异性引物和探针,从而建立并优化双重荧光定量PCR反应体系,之后评价反应体系的特异性、敏感性和稳定性。结果本研究建立的HAV和HEV双重荧光定量PCR技术应用于检测HAV核酸时检测极限可以达到1个拷贝/反应,对同一样品重复测定5次获得的Ct值的变异系数(CV)最大为1.5%,同时该体系检测HEV的最低检测极限也达到10个拷贝/反应,重复测试5次后Ct值的变异系数(CV)最大为2.6%,临床样本测试结果显示该体系能够对甲型肝炎和戊型肝炎临床样本中的病毒进行定量。结论本研究成功建立了HAV和HEV双重荧光定量PCR检测方法,灵敏度高,稳定性好,可以同时准确定量HAV和HEV,为这两种病毒的分子病原学诊断提供了一种更加快速的手段。
关键词:甲型肝炎病毒;戊型肝炎病毒;双重荧光定量PCR;敏感性
(ChinJLabDiagn,2015,19:2063)
甲型肝炎病毒(Hepatitis A Virus,HAV)和戊型肝炎病毒(Hepatitis E Virus,HEV)均是能够引起急性肝炎暴发的致病因子,历史上都曾多次造成疾病流行,带来过很严峻的公共卫生问题[1]。虽然在分类学上这两个病毒相去甚远,但从流行病学的角度来看,HAV和HEV的分布均具有明显的区域性特征,在发展中国家流行较广,尤其是卫生条件较差的区域,这在很大程度上应该归因于两种病毒具有相似的传播途径,都是通过粪口途径传播,事实证明:直接接触感染者的排泄物或排泄物污染过的水、土壤甚至接触感染者存在的环境都有可能造成HAV和HEV感染,因此对于排泄物中以及环境中和蔬菜食品中的病毒检测便显得尤其重要,然而,这两种病毒都很难进行细胞培养,或可以培养但不出现明显的细胞病理效应,因此对HAV和HEV的检测便主要依赖于核酸的检测,目前实时荧光定量PCR技术以其灵敏度高,检测速度快,特异性强等优点,已在很多种病原体的核酸定量检测中得到了广泛的应用,实时荧光定量PCR技术又主要分为SYBR Green染料技术和TaqMan探针技术两种,两种方法相比,TaqMan探针技术具有更好的特异性,且花费更低、易于设计,所以本研究探索建立了基于TaqMan技术的HAV和HEV双重荧光定量PCR检测方法。
1材料与方法
1.1血清样品和对照病毒株来源用于制备HAV和HEV定量标准品的质粒模板由中国疾病预防控制中心病毒病预防控制所馈赠。检验反应体系特异性时用到的麻疹病毒核酸(RNA)、脊髓灰质炎病毒核酸(RNA)、风疹病毒核酸(RNA)、呼吸道合胞病毒核酸(RNA)、流感病毒核酸(RNA)、轮状病毒核酸(RNA)、诺如病毒核酸(RNA)、星状病毒核酸(RNA)以及肠道腺病毒核酸(DNA)来自于中国疾病预防控制中心病毒病预防控制所,所有RNA储存于-70℃超低温冰箱。10份甲型肝炎患者和10份戊型肝炎患者的血清样本由河南省人民医院感染科收集馈赠,保存于-20℃。
1.2引物和探针的设计合成根据参考文献[2-5]确定HAV的扩增靶点位于病毒基因组的5′-NCR,选取合适的引物和探针,探针5′端标记FAM荧光报告基团,而HEV的扩增区域位于HEV ORF2区,为实现单管双重的扩增效果,HEV探针5′端标记Cy5荧光报告基团,本研究中用到的所有引物和探针均委托宝生物工程(大连)有限公司合成,序列名称和标记如表1所示。
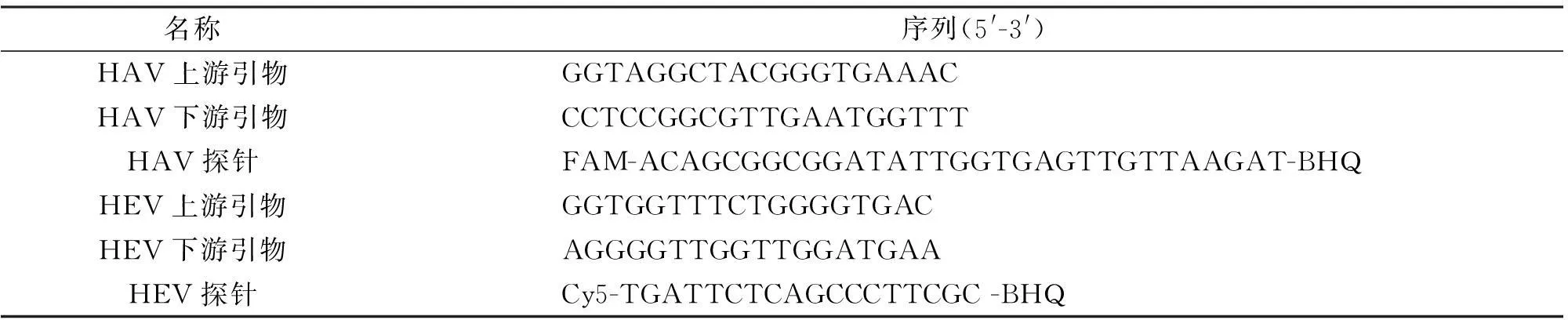
表1 HAV和HEV双重实时荧光定量PCR的引物和探针
1.3标准品的构建和制备以带有HAV和HEV扩增靶序列的质粒作为转录模板,使用RiboMAXTM Large Scale RNA Production Systems-T7(Promega)试剂盒,在T7 RNA聚合酶的作用下,分别转录生成HAV定量和HEV定量用的RNA标准品,之后加入Dnase RQI 37℃作用15 min降解DNA模板,RNA产物经纯化后溶于DEPC水,使用紫外分光光度计(Nanodrop)测定其浓度并根据相对分子量计算其拷贝数浓度,最终倍比稀释成1×107-1×100拷贝/μl作为HAV和HEV荧光定量PCR实验的标准品。
1.4临床血清样本中病毒RNA的提取从临床血清样本中提取病毒RNA采用QIAamp Viral RNA mini kit(Qiagen),严格按照试剂盒说明书操作,提取出的HAV和HEV RNA洗脱于60 μl DEPC处理的水中。
1.5HAV HEV双重实时荧光定量PCR本研究使用One Step PrimeScriptTMRT-PCR Kit (TaKaRa) 在ABI Real-time PCR 7500仪器上进行荧光定量检测,反应体系配制如下:2× one step RT-PCR Buffer III 12.5 μl,TaKaRa ExTaqTMHS 0.5μl,PrimeScriptTMRT Enzyme Mix II 0.5 μl,ROX Reference Dye II 0.5 μl,反应后得到样本的阈值循环数(Ct),根据标准曲线计算样品中含有的RNA拷贝数。
1.6确定双重荧光定量PCR的最优反应条件以制备的HAV和HEV RNA标准品作为模板,分别选用0.2 μM、0.4 μM和0.6 μM浓度的荧光探针以及0.2 μmol/L、0.4 μmol/L和0.6 μmol/L的上下游引物浓度进行预实验,通过比较不同浓度的上下游引物及探针组合优化本实验体系,最终通过矩阵法优选出最佳工作浓度,另外,对双重实时荧光定量PCR的反应条件进行摸索,确定最优变性温度和退火温度。
2结果
2.1最适反应条件的确定以25 μl为反应总体积,通过对不同浓度的引物、Taq-Man探针以及退火温度的筛选、比较和优化,确定最佳反应体系为:HAV和HEV荧光标记探针浓度为0.2μM、上下游引物分别为0.4 μmol/L,最适的退火温度确定为60℃,因此双重荧光定量PCR最终的反应条件设置如下:42℃30 min,95℃10 sec,95℃5 sec,60℃34 sec,共40个循环。
2.2标准曲线的建立以体外转录并纯化后获得的HAV和HEV RNA分子拷贝数的对数值为横坐标(X),以Ct值为纵坐标(Y),建立HAV和HEV实时荧光定量PCR的标准曲线。当标准品的拷贝数在100-107之间时,HAV荧光定量PCR标准曲线呈良好的线性,斜率为-3.287,相关系数R2=0.999,最低检测极限为1个拷贝/反应,而HEV荧光定量PCR标准曲线的斜率为-3.829,最低检测极限为10个拷贝/反应。
2.3HAV HEV双重实时荧光定量PCR的灵敏度和特异性检测以系列稀释的HAV和HEV RNA标准品作为反应模板,分别评估该实时荧光定量PCR体系检测HAV核酸和HEV核酸的灵敏程度,确定HAV和HEV的最低检测极限分别为1个拷贝/反应和10个拷贝/反应。当使用该反应体系检测麻疹病毒核酸(RNA)、脊髓灰质炎病毒核酸(RNA)、风疹病毒核酸(RNA)、呼吸道合胞病毒核酸(RNA)、流感病毒核酸(RNA)、轮状病毒核酸(RNA)、诺如病毒核酸(RNA)、星状病毒核酸(RNA)以及肠道腺病毒核酸(DNA)时, 均未检测出阳性扩增信号,表明该系统具有良好的特异性。
2.4HAV HEV双重实时荧光定量PCR的重复性检测为了评价荧光定量PCR体系检测HAV核酸和HEV核酸的稳定性,分别使用6个浓度(101-106拷贝/反应)的HAV RNA标准品和HEV RNA标准品作为模板进行平行的5次重复测试。结果如表2所示,检测不同稀释度的HAV时Ct值的变异系数(CV)最大为1.5%,而测试HEV的变异系数(CV)最大为2.6%,说明所建立的双重实时荧光定量PCR检测体系具有良好的稳定性和重复性。

表2 HAV HEV双重实时荧光定量PCR的可重复性
2.5HAV HEV双重实时荧光定量PCR检测体系的应用通过本研究中建立的HAV HEV双重实时荧光定量PCR检测体系检测了10份处于急性期的甲型肝炎患者的血清样本和10份戊型肝炎患者的血清样本,结果均为阳性,检出率100%,根据标准曲线计算得到临床样本中HAV RNA拷贝数范围从1.57×103拷贝/ml到6.92×107拷贝/ml而戊型肝炎患者的临床样本中HEV RNA拷贝数范围从5.44×105拷贝/ml到2.19×107拷贝/ml。
3讨论
一套成功的实时荧光定量PCR技术的建立主要取决于探针和引物的选择,需要对两种病毒的基因结构有比较深入的了解,HAV的基因组为一条单股正链的RNA分子,全长在7470-7478bp之间,仅含有一个开放读码框架[6],由于不同的HAV分离株核酸序列高度同源,设计HAV实时荧光定量PCR的引物和探针相对容易,但HEV却型别众多,文献报道至少有4个不同的HEV基因型,各基因型之间核苷酸序列同源性仅为74%-76%[7],给核酸检测带来一定的难度,而且要把与HAV和HEV的检测体系整合,建立同一温度和条件下的双重荧光定量PCR也对引物和探针的设计提出了较高的要求,所以本研究参考了前人对于HAV和HEV核酸定量的研究,选择了合适的引物和探针,并对引物探针的浓度、变性温度、退火温度等反应条件进行了反复的摸索,最终确立95℃变性、60℃退火是同时扩增HAV和HEV的最适反应条件。
经过对体外制备的HAV RNA标准品、HEV RNA标准品以及其它多种病原体核酸的检测,发现本研究中建立的HAV HEV双重实时荧光定量PCR检测体系不仅特异性高,而且非常敏感,其中对于HAV核酸的检测极限可以达到1个拷贝/反应,高于国内外类似方法的灵敏程度,而重复性实验表明,同一稀释度重复5次测量Ct值的变异系数仅为1.5%和2.6%,说明此反应具有很好的稳定性,可以进行可靠、稳定的检测。
临床样本的测试结果显示,本研究建立的HAV HEV双重实时荧光定量PCR检测体系能够从处于急性期的甲型肝炎患者和戊型肝炎患者的血清样本中检测出HAV和HEV核酸,这预示着该体系可用于甲型肝炎和戊型肝炎早期的临床诊断,除此之外,由于本方法快速、准确、简便的特点,所以对急性肝炎暴发的预防和控制以及流行病学监测调查也具有十分重要的实用价值。
参考文献:
[1]戴志澄.在我国预防控制病毒性肝炎刻不容缓[J].中国预防医学杂志,2001,2(3):163.
[2]Sanchez G,Populaire S,Butot S,et al.Detection and differentiation of human hepatitis A strains by commercial quantitative real-time RT-PCR tests[J].J Virol Methods,2006,132:160.
[3]Alain H,Evelyne G,Elyse P,et al.Comparative evaluation of new TaqMan real-time assays for the detection of hepatitis A virus[J].J Virol Methods,2007,140:80.
[4]Narayanan J,Theresa C,Betty R,et al.A broadly reactive one-step real-time RT-PCR assay for rapid and sensitive detection of hepatitis E virus[J].J Virol Methods,2006,131:65.
[5]Germano O,Giuseppina M,Ginevra O,et al.Detection and quantitation of hepatitis E virus in human faeces by real-time quantitative PCR[J].J Virol Methods,2004,118:77.
[6]Mackiewicz V,Cammas A,Desbois D,et al.Nucleotide variability and translation efficiency of the 5' untranslated region of hepatitis A virus:update from clinical isolates associated with mild and severe hepatitis[J].J Virol,2010,84:10139.
[7]佟永力,刘彦成,崔岩.戊型肝炎的研究现状[J].中国公共卫生管理,2001,17:69.
Development and Application of Multiplex Real-time PCR Assay for Hepatitis A Virus and Hepatitis E Virus DetectionZHANGLei1,LUShu-ting2,LIYu-long1,etal.(1.HematonosisResearchInstituteofHenanProvincialPeople’sHospital,Zhengzhou450003,China;2.LaboratoryDepartmentoftheFirstPeople'sHospitalofZhengzhouCity,Zhengzhou450004,China)
Abstract:ObjectiveTo establish a multiplex real-time PCR assay for hepatitis A virus and hepatitis E virus clinical samples detection.MethodsThe specific primers and probes in the conserved region of HAV and HEV genome were designed according to the references.Therefore,HAV-HEV multiplex real-time PCR was established and optimization followed by the evaluation of specificity,sensitivity and reproducibility.ResultsThe detection limit could up to 1 copy each reaction when HAV-HEV multiplex real-time PCR was applied for HAV detection.The same dilution of the RNA standard was analyzed in five times in parallel and the maximum coefficient of variation (CV) of Ct values was 1.5%.The detection limit was 10 copies each reaction in HEV sensitivity evaluation and the maximum CV of Ct values was 2.6% in reproducibility analysis.Clinical tests suggested HAV-HEV multiplex real-time PCR assay was able to quantify HAV and HEV in clinical samples.ConclusionThe HAV-HEV multiplex real-time PCR was established successfully.This detection method was sensitive,stable and it could be used for simultaneous quantification of HAV and HEV.It provided another rapid way for pathogenic diagnosis of these two viruses.
Key words:Hepatitis A virus;Hepatitis E virus;Multiplex real-time PCR;Sensitivity
(收稿日期:2015-01-13)
文献标识码:A
中图分类号:R575.1
文章编号:1007-4287(2015)12-2063-04
*通讯作者

