淮南麻黄鸡MHCⅠα链基因的克隆及序列分析
戴 银,王承志,沈学怀,赵瑞宏, 胡晓苗,侯宏艳,潘孝成,周学利,张丹俊*
(1.安徽省农科院畜牧兽医研究所,安徽合肥 230031;2.安徽农业大学动物科技学院,安徽合肥 230036)
淮南麻黄鸡MHCⅠα链基因的克隆及序列分析
戴 银1,王承志2,沈学怀1,赵瑞宏1, 胡晓苗1,侯宏艳1,潘孝成1,周学利1,张丹俊1*
(1.安徽省农科院畜牧兽医研究所,安徽合肥 230031;2.安徽农业大学动物科技学院,安徽合肥 230036)
典型的主要组织相容性复合体(MHC)是抗原递呈的关键分子,具有重要的免疫功能,与多种疾病密切相关。为深入了解地方品种鸡MHCⅠ类α分子的特征,尤其是抗原结合区域的特点,通过RT-PCR技术获得了29个淮南麻黄鸡完整的α链基因,并进行了分析。结果显示,淮南麻黄鸡MHCⅠα分子高度多态,但主要集中在α1和α2区域,该区变异氨基酸位点共68个,其中高度变异22个。淮南麻黄鸡MHCⅠ分子α1和α2区域氨基酸序列同源性介于79.3%~99.5%之间,仅少部分序列完全一致。鸡氨基酸序列同源性与鸭较高,介于57.6%~64.1%之间;其次为人和鼠。进化分析显示,淮南麻黄鸡MHCⅠ分子α1和α2区域分属于两个类群,但未显示明显的品种差异。此外,鸡与鸭的亲缘关系较近,与其他物种则遗传距离较远。研究结果表明,淮南麻黄鸡MHC分子在进化过程中呈现高度的多态性,但受到病原体的选择压力,多态性主要位于抗原肽结合部分的α1和α2区域。
MHCⅠ类分子;序列分析;淮南麻黄鸡
主要组织相容性复合体(major histocompatibility complex,MHC)具有辨别自身与非己的独特功能,同时又直接参与抵抗病原体入侵及自身稳定的过程,因而在脊椎动物进化中扮演着不可替代的重要角色[1-2]。由于MHC的表达产物广泛参与各种抗原的识别,其遗传背景的差异可导致不同个体抗病能力及自身免疫疾病易感性的差异,目前已证实,MHC与人类和动物的多种疾病之间相关[3-5]。由于MHC突出的特性和其在免疫遗传学和群体遗传学领域中的重要作用,已被作为抗病育种遗传标记辅助选择的重要位点[6-8]。另外,有报道表明,MHC除了与某些疾病密切有关,而且还与畜禽的繁殖性能、生长性能及肉质都存在一定的相关性,因此充分研究MHC的特性,并利用该基因培育出高产、抗病力强的家畜品种极具发展潜力[9-10]。MHCⅠ类分子是一种膜结合糖蛋白,由重链(α)和轻链(β2m)微球蛋白两部分以非共价键结合组成。成熟的α链由3个胞外区域(α1、α2、α3)及转膜区域和胞质尾区组成,其中α1和α2区是MHCⅠ类分子抗原多态性的分子基础,多态性主要体现在该区。抗原多肽结合区位于α1和α2区域,可与病毒、肿瘤细胞等内源性抗原多肽结合,并将其递呈给CD8+T细胞,诱导机体产生细胞性免疫应答。我国优良的地方鸡品种较多,各有优势,然而目前仍然没有一个完善的保持和改进品质的培育系统,MHCⅠ作为抗病育种的关键基因之一,仅少数几个国内外鸡品种有相关报道;同时家畜禽在饲养过程中主要受人工干预和传染病原侵扰,与在自由环境中的生物有所不同,那么MHC基因的进化特点是否也有所差异。为此,克隆安徽省地方品种淮南麻黄鸡MHCⅠ分子的cDNA基因,并分析其分子特征,尤其是α1和α2区域的遗传特点,初步探索MHCⅠ分子与疾病之间的关系,为下一步分子育种及制备基因工程疫苗提供理论依据。
1 材料与方法
1.1 材料
1.1.1 试验用动物 试验鸡为安徽省地方品种淮南麻黄鸡,35只,210日龄,来源于安徽省农业科学院实验基地。
1.1.2 菌株和质粒 大肠埃希菌BL21和载体pMD18-T为宝生物工程(大连)有限公司产品。
1.1.3 工具酶和试剂 DNA Marker DL 2 000、T4连接酶为宝生物工程(大连)有限公司产品;dNTP、Taq酶、琼脂糖(电泳纯)为上海生工生物工程技术服务有限公司产品;DNA清洁/PCR产物清洁试剂盒、DNA凝胶回收试剂盒为杭州维特洁生化技术有限公司产品;Trizol Reagent为Invitrogen公司产品;第一链合成试剂盒为宝生物工程(大连)有限公司产品。
1.2 方法
1.2.1 引物设计 经Oligo 6.0软件分析,参照GenBank数据库中登录的鸡MHCⅠα序列(GenBank 登录号:S78682)设计扩增引物:上游引物P-α-F:5′-GAGAGTGCAGCGGTGCGAGGCGAT-3′;下游引物P-α-R:5′-AATGCTGGTGTGGACTGTTGGCTC-3′。上、下游引物之间跨幅分别约为1 136 bp,涵盖了编码鸡MHCⅠα完整阅读框。引物由宝生物工程(大连)有限公司合成,使用前用灭菌ddH2O稀释至20 pmol/L。
1.2.2 RNA提取和cDNA的合成 通过鸡外周静脉采血,每5 mL血液中加入1 mL抗凝剂,4 ℃储存备用。使用Trizol试剂抽提鸡血液中总RNA。以提取的总RNA为模板合成cDNA,具体方法参照宝生物工程(大连)有限公司产品cDNA第一链合成试剂盒使用说明书。
1.2.3 MHCⅠα基因的扩增 以cDNA第1链为
模板,以P-α-F、P-α-R为上、下游引物,扩增MHCⅠα基因。PCR反应体系:10× PCR buffer 5.0 μL,dNTP Mixture 3.0 μL,上、下游引物各1.0 μL,cDNA 1.0 μL,TaqDNA 聚合酶0.5 μL,加双蒸水补足60 μL。PCR扩增条件为:95 ℃ 5 min;94 ℃ 1 min,67 ℃ 1 min,72 ℃ 2 min,30 个循环;72 ℃ 10 min。扩增产物送上海生工生物工程技术服务有限公司进行测序。
1.2.4 基因序列分析 使用Clustal X 1.83软件比对序列,DNA Star、MegAlign等软件分析序列同源性。使用MEGA3.1软件,Neighbor-joining方法构建系统进化树。来航鸡、乌鸡、珍珠鸡、鸭、人和鼠的相应序列均来自GenBank数据库,登录号分别为AY989897、AB178042、AB178051、AB115242、NM-002116 和 NM-010380。
2 结果
2.1 淮南麻黄鸡MHCⅠα基因的扩增
获得的总RNA经紫外分光法分析,纯度达到了下一步试验的要求。通过逆转录反应得到MHCⅠα基因的第一链,随即进行PCR扩增,得到29个约1 136 bp的MHCⅠα特异性条带,与预期的片段长度一致,阴性对照组未见特异性条带(图1)。
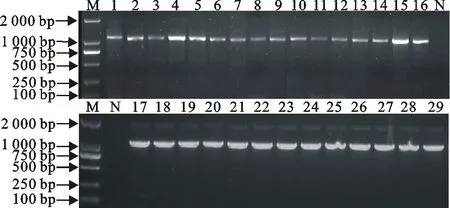
M.DNA标准DL 2 000; N.阴性对照; 1~29. MHCⅠα PCR产物
M. DNA Marker DL 2 000; N. Negative control; 1-29. PCR products of MHCⅠα gene
图1 MHCⅠα 基因的RT-PCR结果
Fig.1 RT-PCR results of MHC Ⅰ α gene
2.2 MHCⅠα氨基酸序列分析
克隆了29条淮南麻黄鸡MHCⅠα链cDNA全长基因,获得了1 035 bp和1 068 bp两种长度的序列,分别由7或8个外显子组成。推导的氨基酸序列显示1 068 bp编码355个氨基酸,1 035 bp编码344个氨基酸。各外显子分别对应21个氨基酸残基的前导肽,88个残基的α1区域,91个残基的α2 区域,91个残基的α3区域,53或64个残基的TM/CY区域。氨基酸序列分析发现变异位点较多,但主要集中于α1和α2区域。进一步分析可见,α1和α2区域共68个可变位点,占α1和α2区域的36.3%。其中第2、8、9、24、43、66、68、72、73、75、76、82、97、111、113、121、128、147、148、149、153和155位为高变异位点(图2)。
2.3 α1和α2区域氨基酸序列同源性分析
同源性分析可见,淮南麻黄鸡品种内存在少数一致序列,其余22条鸡的MHCⅠα1和α2区域氨基酸序列同源性介于79.3%~99.5%之间。淮南麻黄鸡与来航鸡同源性介于79.3%~90.8%之间,与乌鸡同源性介于82.6%~94%之间,与珍珠鸡同源性介于82.1%~92.9%之间。同时鸡与鸭、人和鼠的MHCⅠα序列比对可见,鸡与鸭序列相似性介于57.6%~64.1%之间,而与鼠的序列相似性在44.0%~48.9%之间,与人的序列相似性在44.6%~49.5%之间(图3)。
2.4 α1和α2区域氨基酸序列进化分析
将所有MHCⅠα基因 α1和α2区域氨基酸序列构建系统发育树(图4),可见淮南麻黄鸡MHCⅠα氨基酸序列没有单独聚集为一类,被归属于两个类群,第一类群较大,且继续进化为不同分支,而第二类群仅含有2条序列。同时来航鸡、乌鸡和珍珠鸡的序列均属于第一大类群。此外,可见鸡与鸭的MHCⅠα亲缘关系较近,而鸡与人、鼠的MHCⅠα氨基酸序列遗传距离则较远。
序列上方的数字代表氨基酸残基的位置; 一致的氨基酸用点表示; 短线表示缺失的氨基酸残基
The numbers above the sequences represent amino acid positions. Dots represent identity in amino acid residues. Dashes represent the amino acid deletion
图2 MHCⅠα链 α1和α2区域比对
Fig.2 Alignment of α1and α2 domains of MHC class Ⅰα

图3 MHCⅠα链α1和α2区域同源性比对Fig.3 The homology comparison of α1and α2 domains of MHC class Ⅰα

遗传距离在图的下方;聚类分析的可靠性用bootstrap置信区限检测
Genetic distance is indicated at the bottom; The reliability of the cluster analyses are tested by bootstrap confidence limits
图4 MHCⅠα链α1和α2区域系统发育树
Fig.4 Phylogenetic tree of α1and α2 domains of MHC class Ⅰ α
3 讨论
共克隆了29条淮南麻黄鸡MHCⅠ序列,经分析除了少数序列完全一致外,其余大部分序列呈现多态性。此外,我们发现多态的氨基酸位点主要聚集于α1和α2区域共有68个变异位点,其中22个高度变异。α1和α2区域为抗原递呈的关键位置,其在分子内形成与抗原肽结合的分子凹槽,该区域部分位点与抗原肽识别密切相关。Furlong R F等[11]分析了哺乳动物的MHCⅡ类分子DRB,其处于正选择的多态性氨基酸位点几乎都在PBR区,与抗原侧链相接触,或紧靠PBR。Hinrichs J等[3]模拟了人类两个HLA-A*30等位基因的同源模型,虽然两个结构外在是一致的,但Cys164Ser的多态性改变了其与抗原的结合力,导致部分抗原肽不能被有效递呈,这种效果会对移植产生严重的影响。这说明MHC分子的PBR区域较为多态,部分位点的高度变异,可能更有利于与各类不同抗原肽结合。
MHC等位基因来源于共同祖先,优势基因型似乎与环境压力,特别是疾病的选择有关,而不受区域与品种差异影响。研究结果也显示鸡MHCⅠ序列α1和α2区域,同源性介于79.3%~100%之间,部分序列差异较大,但进化分析显示品种内和品种间差异不显著,不同来源鸡MHCⅠ分子均来自共同祖先。Gu X等[12]研究发现MHC基因受制于频繁的基因变异,哺乳动物MHC进化是与生和死演化模式一致的,而不是协同演化模式。在养殖条件下,传染病病原的威胁压力是生死选择,所以,MHC基因是动物在适应过程,尤其是其受到病原体介导的选择[13-14]。因此,不同的鸡品种外形和生产性能上有很大区别,但是在基本相同环境压力下抵御病原的进化过程中,MHC分子仍然保持着共同祖先的遗传特征[15]。本研究初步分析了地方品种淮南麻黄鸡MHCⅠ类α分子的特征,尤其是抗原结合区域的遗传特点,为下一步研究更多长期驯化的不同地方鸡品种MHC分子结构特征,及其与抗病性关系的研究奠定了基础。
[1] Hughes A L, Yeager M. Natural selection at major histocompatibility complex loci of vertebrates[J].Annu Rev Genet,1998,32:415-435.
[2] Maenaka K, Jones E Y. MHC superfamily structure and the immune system[J].Curr Opin Struct Biol,1999,9:745-753.
[3] Hinrichs J, Foll D, Bade Doding C, et al. The nature of peptides presented by an HLA class I low expression allele[J].Haematologica,2010,95(8):1373-1380.
[4] Otting N, de Vos-Rouweler A J, Heijmans C M, et al. MHC class I A region diversity and polymorphism in macaque species[J].Immunogenetics,2007,59:367-375.
[5] Boehm T, Zufall F. MHC peptides and the sensory evaluation of genotype[J].Trends Neu,2006,29:100-107.
[6] Tregenza T, Wedell N. Genetic compatibility, mate choice and patterns of parentage: Invited review[J].Mol Ecol,2000,9(8):1013-1028.
[7] Paterson S, Pemberton J M. No evidence for major histocompatibility complex-dependent mating patterns in a free-living ruminant population[J].Proc R Soc Lond B,1997,264:1813-1819.[8] Lamont S J. The chicken major histocompatibility complex in disease resistance and poultry breeding[J].J Dairy Sci,1989,72:1328.
[9] Sharif S, Mallard B A, Wikie B N, et al. Association of bovine major histocompatibility complex DRB3 (BoLA-DRB3) with production traits in Canadian dairy cattle[J].Animal Genetics,1999,30:157-160.
[10] 欧阳建华, 袁 立, 孙 权, 等.中国泰和乌骨鸡MHC与其繁殖性能相关的研究[J].江西农业大学学报,2000,22(1):98-101.[11] Furlong R F, Yang Z. Diversifying and purifying selection in the peptide binding domain of DRB in mammals[J].J Mol Evol,2008,66:384-394.
[12] Gu X, Nei M. Locus specificity of polymorphic alleles and evolution by a birth-and-death process in mammalian MHC genes[J]. Mol Biol Evol,1999,16(2):147-156.
[13] Mona S, Crestanello B, Bankhead-Dronnet S, et al. Disentangling the effects of recombination, selection, and demography on the genetic variation at a major histocompatibility complex class II gene in the alpine chamois[J].Mol Ecol,2008,17(18):4053-4067.
[14] Hawley D M , Fleischer R C. Contrasting epidemic histories reveal pathogen-mediated balancing selection on class II MHC diversity in a wild songbird[J].PLoS One,2012,7(1):e30222.
[15] Chen F F, Pan L, Wu C , et al. Character of chicken polymorphic major histocompatibility complex class II alleles of 3 Chinese local breeds[J].Poult Sci,2012,91(5):1097-1104.
Cloning and Sequence Analysis of MHC ClassⅠα Gene in Huainan Partridge Chickens
DAI Yin1,WANG Cheng-zhi2,SHEN Xue-huai1,ZHAO Rui-hong1,HU Xiao-miao1,HOU Hong-yan1,PAN Xiao-cheng1,ZHOU Xue-li1,ZHANG Dan-jun1
(1.InstituteofAnimalHusbandryandVeterinaryScience,AnhuiAcademyofAgriculturalScience,Hefei,Anhui,230031,China; 2.CollegeofAnimalScienceandTechnology,AnhuiAgriculturalUniversity,Hefei,Anhui,230036,China)
Typical major histocompatibility complex (MHC) is the key of antigen-presenting molecules, plays a crucial role in the immune system, and closely relates to many diseases. In order to further understand molecular characteristics of chicken MHC Class Ⅰ gene, and peptide-binding regions, the 29 chicken MHC Ⅰα genes from Huainai partridge chicken were cloned by RT-PCR. The results revealed that MHC gene was highly polymorphic,but they were mainly located in the α1 and α2 regions.There were 68 mutations, which were distributed in the α1 and α2 regions, but 22 of them were highly mutated sites. The amino acid homology among α1 and α2 regions of chicken MHCⅠranged from79.3% to 99.5%%, only several sequences were identical.The results showed that α1 and α2 regions of chicken MHCⅠ shared higher amino acid homology with that of duck, between 57.6%-64.1%, and followed by human and mouse. In the phylogenetic tree,all amino acid sequences of α1 and α2 regions from chickens belonged to two clusters together, no correlation with the chicken breeds. Chicken had a closer genetic relationship with duck, and the genetic distance of other species was farther. The results showed that chicken MHCⅠ molecules showed high polymorphism in the evolutionary process, but the polymorphism located mainly in peptide-binding region of α 1 and α 2 under pressure of the pathogen.
MHC class Ⅰ;sequence analysis;Huainan partridge chicken
2014-06-05
国家自然科学基金项目(31302044);国家蛋鸡产业技术体系项目(CARS-41);安徽省现代农业肉禽产业发展资金;院科技创新团队资助项目(11C0404)
戴 银(1980-),女,安徽蒙城人,助理研究员,博士,主要从事兽医微生物与免疫学研究。*
S858.31;Q785
:A
:1007-5038(2015)02-0034-05