基于Activin A途径的大黄素神经保护机制的研究
沈笑然,袁 慧
(首都医科大学附属北京安贞医院 检验科,北京 100020)
基于Activin A途径的大黄素神经保护机制的研究
沈笑然,袁慧*
(首都医科大学附属北京安贞医院 检验科,北京 100020)
摘要:目的明确大黄素对缺血缺氧性脑损伤中的神经元具有保护作用的内在机制。方法应用pc-12细胞经牛膝多肽刺激转化为神经元样细胞后,并制备神经元细胞的氧糖剥夺(OGD)模型,并在此基础上,给予大黄素干预,分别检测细胞的生存力;应用酶联免疫方法检测细胞培养基的Activin A的表达含量;应用Western blotting 对caspase-3蛋白的检测。结果pc-12细胞经牛膝多肽刺激后转化为类神经元样细胞,在OGD后的pc-12细胞呈明显的梯度变化;实验组细胞的生存力明显提高,其培养基的Activin A含量升高明显,caspase-3蛋白的表达与单纯应用氧糖剥夺组比较,表达降低(P<0.05)。结论大黄素可以提高缺血缺氧状态下神经元细胞的生存力,同时可促进激活素的表达上调,并通过下调caspase3表达来抑制神经凋亡,起到神经保护的作用。
关键词:OGD;神经保护(Neuroprotection);Emodin;Activin A; Apoptosis;Caspase-3
(ChinJLabDiagn,2015,19:1818)
目前,关于神经缺血缺氧脑损伤的发病过程与机制并不完全明了,而在临床实践中,脑保护的治疗相对较少。大黄素,作为一种中药的提取物,其现代研究具有较多的生物学功能,如抗氧化[1]、抗肿瘤[2]等,此外,国内外研究表明:大黄素与TGF-β1[3]、Rho激酶[4]等诸多信号转导通路相互作用影响。近年来研究显示:大黄素还具有明显的神经保护的作用,与脑缺血关系密切,在神经系统脑保护机制的研究中,其是如何发挥脑保护作用,是否与神经保护的相关的信号途径相联系,我们尚不可知。而激活素A(Activin A)作为神经系统中目前公认的强保护因子而备受关注,研究显示:其作用机制是以Activin A/Samds 信号转导系统途径发挥生物学效应的,推测大黄素对神经系统的保护作用可能与激活素A信号系统存在某种关联,本研究就其二者与脑保护的关系进行更深入的研究[5]。
1材料与方法
1.1材料pc-12细胞,购自北京金紫荆生物有限公司。
1.2方法
1.2.1分组模型制备分组:根据3 h、6 h、9 h、12 h、16 h、24 h将细胞随机分为6组进行评价。实验分为正常对照组(Control组:C组):正常培养的pc12细胞;氧糖剥夺组(OGD6 h组:O组):正常培养的pc12细胞行氧糖剥夺处理后6 h;实验组即大黄素预处理后行OGD实验组(Emodin组:E组):应用20 μmol/ml大黄素预处理24 h后行OGD处理6 h。
1.2.2牛膝多肽诱导PC12细胞转化为类神经元样细胞牛膝多肽用DMEM培养基配制成0.5 mg/ml的液体进行pc-12细胞的转换类神经元样细胞的培养。
1.2.3类神经元样细胞的鉴定将细胞爬片的玻片放置在24孔板中,将pc-12细胞按5×104/ml密度接种于孔板中,培养24 h,加入含有0.5 mg/ml牛膝多肽的DMEM培养基培养,突起长度如果超过细胞体的2倍以上视为阳性,多突起的细胞液可视为阳性,记5孔取平均值。
1.2.4MTT法细胞存活率检测收集对数期细胞,调整细胞悬液浓度,每孔加入100 μl,铺板使待测细胞调密度5×104/ml /孔。5%CO2,37℃孵育,孵育48小时后每孔加入20 μlMTT溶液,继续培养4 h。弃液,每孔加入150 μl二甲基亚砜,摇床振荡10 min,在酶联免疫检测仪OD490 nm处测量各孔的吸光值。按公式计算细胞存活率。
1.2.5ELISA法检测ActinA浓度实验流程图按说明书操作。实验重复3次。
2结果
2.1PC12细胞转化为神经元的鉴定
应用牛膝多肽刺激PC12细胞培养24h,可见细胞长出突触;牛膝多肽刺激36h,细胞突起变长;培养72h,突触与突触之间互相交织成网状结构,具有的神经元形态特点,占总数90%以上。见图1。

A:牛膝多肽刺激24 h;B:牛膝多肽刺激36 h;C:牛膝多肽刺激72 h,呈典型神经元形态
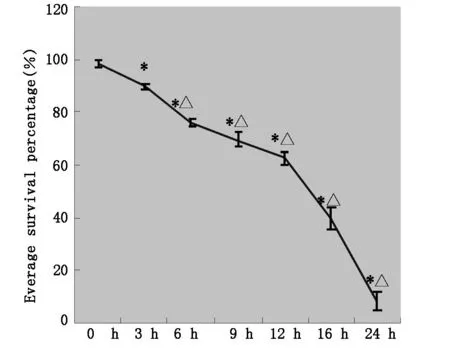
2.2PC-12细胞氧糖剥夺(OGD)模型的评价
氧糖剥夺不同时间MTT法细胞存活率检测,OGD3h细胞存活率较正常对照组略开始有所降低87.31%,到24h其生存活力不到10%,期间,12h出现一个陡直的下降;OGD3h—OGD12h时细胞存活率呈现缓坡状;OGD12h与OGD24h细胞存活率与对照组及OGD3h组比较差异显著(P<0.05)。各组细胞存活率见图2。
2.3行大黄素预处理后MTT法检测细胞生存活力
与对照组相比,行OGD6h组的细胞生存力明显下降,具有统计学意义,应用大黄素处理以后再行OGD6h组,其生存活力较OGD6h组明显改善,具有明显统计学意义(P<0.05)。见图3。
2.4酶联免疫法检测激活素A的含量
在对照组的培养基中,可以检测出微量的ActivinA的分泌,行OGD的pc-12细胞培养液中ActivinA的含量与对照组相比,有明显的升高,经过大黄素与处理的pc-12细胞组中,与OGD组相比,Actin有着较显著的升高(P<0.05),见图4。
*与Control组比较P<0.05,△与OGD3h组比较P<0.05

*与Control组比较P<0.05,△与OGD6h组比较P<0.05

*与Control组比较P<0.05,△与OGD6h组比较P<0.05
2.5westernblotting法检测caspase-3蛋白的表达
应用OGD后6h,检测到有caspase3的前体蛋白(procaspase3)和裂解蛋白(leavedcaspase3)的高表达,其差异显著(P<0.05);应用大黄素预处理后,再行氧糖剥夺的pc-12细胞的cleavedcaspase3蛋白表达较单纯氧糖剥夺组明显减低(P<0.05)。见图5、图6。

*与Control组比较P<0.05,△与OGD6h组比较P<0.05
3讨论
现代研究显示:激活素A具有神经保护的作用[6,7]。而大黄素作为从中药大黄中提取的一种有效单体,具有较多的生物学活性,大黄素通过抗氧化和抑制谷氨酸盐毒性作用,起到神经保护作用,对抗大脑的缺血性再灌注损伤[8,9]。同时研究还显示:大黄素可使损伤后组织细胞的凋亡率明显下降[10]。
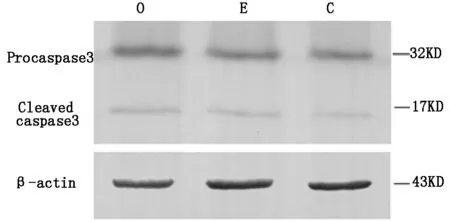
图6 应用大黄素后caspase-3 Protein的检测
本实验中,我们采用大鼠肾上腺嗜铬细胞瘤(PC12细胞株),其在体外可经牛膝多肽刺激诱导后,可向神经元分化,转变为神经元样细胞。并制备OGD模型,采用MTT、hoechst荧光染色等技术进行模型评价,结果显示在体外制备缺血缺氧细胞模型建立成功。
正如实验结果显示,应用大黄素预培养后,再行氧糖剥夺的pc-12细胞组(E组)与OGD6h组(O组)比较,生存力升高明显,说明大黄素可以在体外明显提高神经元在缺血缺氧的脑损伤中的耐受力和生存力。同时发现:在pc-12细胞经大黄素预处理后行氧糖剥夺组的培养基中可见激活素的高表达,提示:大黄素可能通过某种途径预先激活神经元细胞的某种自身保护机制,使神经元细胞对激活素的表达上调。推测大黄素可能预先通过某种潜在的靶点激活了ActivinA/Smads信号转导系统,通过某种正反馈机制不断自分泌激活素A蛋白,强化了神经元细胞抗损伤的能力。
本研究中,应用大黄素预处理后,再行氧糖剥夺的pc-12细胞的caspase3的裂解蛋白(cleavedcaspase3)和前提蛋白(procaspase-3)表达较单纯氧糖剥夺组表达明显减低。提示大黄素神经保护作用的发挥,或是通过对抗损伤后细胞凋亡的作用而实现的。
参考文献:
[1]LiYP,TakamiyagiA,RamziST,etal.InhibitoryeffectofRumexJaponicusHouttontheporphrinphotooxidativereaction[J].TheJournalofDermatology,2000,27 (12):761.
[2]ZengY,LiuA,TongHF.EffectofemodincombinedgemcitabineonthegrowthandapoptosisofpancreaticcancercelllineBxPC-3invitro[J].ZhongguoZhongXiYiJieHeZaZhi,2011,31(4):552.
[3]HuQ,NoorM,WongYF,etal.Invitroanti-fibroticactivitiesofherbalcompoundsandherbs[J].NephrolDialTransplant,2009,24(10):3033.
[4]CaiJ,NiuX,ChenY,etal.Emodin-inducedgenerationofreactiveoxygenspeciesinhibitsRhoAactivationtosensitizegastriccarcinomacellstoanoikis[J].Neoplasia,2008,10(1):41.
[5]WeiTian-Nlan,HuJian-Da,ChenYing-Yu,etal.EffectofEmodinonInductionofApoptosisinJurkatCellsandItsPossibleMechaniams[J].JournalofExperimeutalHematology,2009,17(5):1203.
[6]BarbaraMunz,YvonneP.TretterD,etal.Therolesofactivinsinrepairprocessesoftheskinandthebrain[J].MolecularandCellularEndocrinology,2001,180(1):169.
[7]HiroshiAgeta,AkikoMurayama,RikaMigishima,etal.ActivinintheBrainModulatesAnxiety-RelatedBehaviorandAdultNeurogenesis[J].PLoSOne,2008,3(4):e1869.
[8]WangC,ZhangD,MaH,etal.Neuroprotectiveeffectsofemodin-8-O-beta-D-glucosideinvivoandinvitro[J].EurJPharmacol,2007,577(1-3):58.
[9]GuJW,HasuoH,TakeyaM,etal.EffectsofemodinonsynaptictransmissioninrathippocampalCA1pyramidalneuronsinvitro[J].Neuropharmacology,2005,49(1):103.
[10]HuangZ,ChenG,ShiP.Emodin-inducedapoptosisinhumanbreastcancerBCap-37cellsthroughthemitochondrialsignalingpathway[J].ArchPharmRes,2008,31(6):742.
Research of neuroprotection mechanism of emodin by Actin A pathwaySHENXiao-ran,YUANHui.(DepartmentofClinicalLaboratory,BeijingAnzhenHospital,CapitalMedicalUniversity,Beijng100020,China)
Abstract:ObjectiveTo investigate effect and possible mechanism of neuroprotection of emodin in ischemia brain injuries.MethodsPC12 cells were transformed into neurons which had been stimulated by polypeptides of achyranthes bidentata blume(ABPP) in vitro.Oxygen and glucose deprivation (OGD) model of activated PC 12 cells prepare were established in extracellular environment without oxygen and nutrition.Viability ere detected after OGD injury.expression of Actin A were measured with ELISA.Protein expression of caspase-3 were detected with Western blotting.ResultsPC12 cells were transformed into neuron-like cells which had been stimulated by ABPP in vitro.Change of ladder of Viability were detected after OGD injury.Contrast with group O,Viability rised significantly in group E,and content of Actin A in nutrient medium increased obviously.Compared with group O,caspase-3 protein expression detected by western blotting reduced significantly (P).ConclusionEdomin can enhance Viability of pc-12 cells after OGD,and promote expression of Actin A,upgrade the protein expression of caspase -3 and inhabin apoptosis.
Key words:OGD;Neuroprotection;Emodin;Actin A;Apoptosis;Caspase-3
(收稿日期:2014-11-22)
作者简介:沈笑然,女,硕士研究生,临床检验师,研究方向:细胞内信号转导通路相关研究。
文献标识码:A
中图分类号:R54
文章编号:1007-4287(2015)11-1818-04
*通讯作者

