miRNA-126 与颈动脉粥样硬化患者斑块稳定性的关系
骆 瑜,熊 玮,杨纯玉,梁 旭
易损斑块是指具有破裂倾向、容易形成血栓导致急性心脑血管事件的动脉粥样硬化斑块,又称不稳定斑块[1]。斑块的易损性或稳定性是影响动脉粥样硬化患者预后的关键因素,需要早期发现,及时治疗。miRNA (microRNA,miR)是一类长度21~29个核苷酸的小分子非编码RNA,它们能够识别特定的目标mRNA,在转录后水平负调控基因表达,编码超过30%的基因,与人类的生命活动和疾病的发生关系十分密切[2]。miR-126 是内皮细胞特异性的miRNA,它的缺乏会损害胚胎血管的完整性,使新生血管减少,导致血管的形态和功能出现改变,可能参与了动脉粥样硬化的发生及进展[3]。本文通过研究颈动脉粥样硬化患者血液中miR-126 的水平变化,探讨miR-126 与动脉粥样硬化及斑块稳定性之间的关系。
1 材料与方法
1.1 研究对象 所有病例均来自于自2012 年7 月-2014 年12 月在我院就诊的门诊和住院患者。所有病例均为无血缘关系的华南地区汉族人群,经相关检查排除急慢性感染、手术、创伤、肝肾疾病、恶性肿瘤、类风湿性疾病、继发性高血压、心力衰竭、心瓣膜病以及存在酗酒、服用避孕药的患者。
1.2 研究方法
1.2.1 一般项目检测 所有患者常规检查血压,连续测量3 次,取平均值作为该患者的血压。测量身高(m)、体重(kg),计算体重质量指数(BMI)。所有受试者空腹8 h 以上于清晨取卧位肘静脉血4 ml,-80 ℃保存待测。所有患者常规测定肝功能(GPT)、肾功能(血肌酐)、总胆固醇(TC)、甘油三脂(TG)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、空腹血糖(BG)、血尿酸(UA)、超敏C 反应蛋白(hsCRP)。
1.2.2 颈动脉彩色多普勒超声检查 采用飞利浦公司IE33 型彩色多普勒超声显像仪,由专人进行检查,探头频率7.5~10.0 MHz,常规检查颈总动脉、颈内动脉、颈外动脉。测量血管内径、颈动脉内中膜厚度(IMT),观察斑块的部位、大小、形态、数量、回声特点、血流信号、有无充盈缺损等。将IMT>1.0 mm 定义为颈动脉内膜增厚;IMT >1.3 mm并明显突出内膜为颈动脉斑块形成。硬斑为斑块呈强回声;软斑为斑块呈中等或弱回声,形态规则或不规则,内膜向腔内凸起,内部结构均匀或不均匀;混合斑形态介于硬斑及软班之间。硬斑为稳定性斑块,软斑和混合斑为不稳定性斑块。所有患者均连续测量每侧颈动脉3 次,取平均值计算IMT。
1.2.3 Real time PCR 检测miR-146a 按照RNeasy Mini Kit 试剂盒(Qiagen 公司)说明书提取RNA,紫外分光光度仪(260/280)检测RNA 浓度(1.8~2.0 者采用),聚丙烯酰胺凝胶电泳鉴定总RNA 的纯度。
cDNA 合成:按照miRCURY LNA Universal RT microRNA PCR 试剂盒(EXIQON 公司)说明书操作。取模板RNA 14 μl,Enzyme mix 2 μl,5 ×RT 缓冲液4 μl,总体积20 μl,于PCR 仪42 ℃1 h,95 ℃5 min进行逆转录反应。合成的cDNA 置于-20℃保存备用。
荧光定量PCR:反应体系20 μl,包括SYBR Green mix 10 μl,PCR primer mix 2 μl,稀释的cDNA模板8 μl。反应条件:95 ℃10 min,95 ℃10 s,60 ℃1 min,40 次循环。每标本均做3 个复孔。以U6 作为内参,放入7900 荧光定量PCR 仪中检测,根据公式miR-146a 相对表达量=2-(ΔCt sample-ΔCt control)计算。miR-146a 上下游引物由EXIQON 公司合成。
1.2.4 药物治疗 对经过颈动脉超声检查诊断为颈动脉粥样硬化斑块的患者常规予瑞舒伐他汀20 mg 每晚一次口服,治疗12 个月后复查颈动脉超声、血hsCRP 及血miR-126。
1.3 统计学处理 采用SPSS 12 软件包进行统计学处理。计量资料以均数±标准差()表示,组间差异采用独立样本t 检验,以P <0.05 为差异有统计学意义。
2 结果
2.1 一般情况 在106 例患者中,男性71 例,女性35 例,年龄30~87 岁,平均(51.4 ±8.9)岁,其中正常组患者32 例,稳定斑块组40 例,不稳定斑块组患者34 例。3 组患者的平均年龄、血压、BMI、GPT、血肌酐、血脂、血糖、血尿酸均无明显差异(P >0.05)。与正常组相比,稳定斑块组患者的血hsCRP水平上升,但差异不明显(P >0.05),不稳定斑块组患者的hsCRP 明显升高(P <0.05)(见表1)。
2.2 miR-126 表达 采用荧光定量PCR 的方法检测外周血miR-126 的相对表达量,结果显示,与正常组患者相比,稳定斑块组患者血液中的miR-126水平上升,差异具有统计学意义(P <0.05);不稳定斑块组患者外周血的miR-126 水平明显升高,与正常组患者相比差异更加显著(P <0.01)(见图1)。
2.3 治疗前后hsCRP 和miR-126 变化 在34例不稳定型颈动脉粥样硬化患者中,完成随访16例。予瑞舒伐他汀治疗12 个月后复查颈动脉超声,结果显示11 例患者为稳定型颈动脉斑块,5 例患者颈动脉正常,好转率达到100%。16 例患者治疗前外周血hsCRP 为(7.9 ± 1.0)mg/L,治疗后复查hsCRP 为(5.7 ±0.7)mg/L,差异具有统计学意义(P<0.05);16 例患者治疗前外周血miR-126CT 值为(4.67 ±0.26),治疗后CT 值为(5.22 ±0.31),与治疗前相比,治疗后miR-126 相对表达量明显下降(P<0.05)(见图2)。
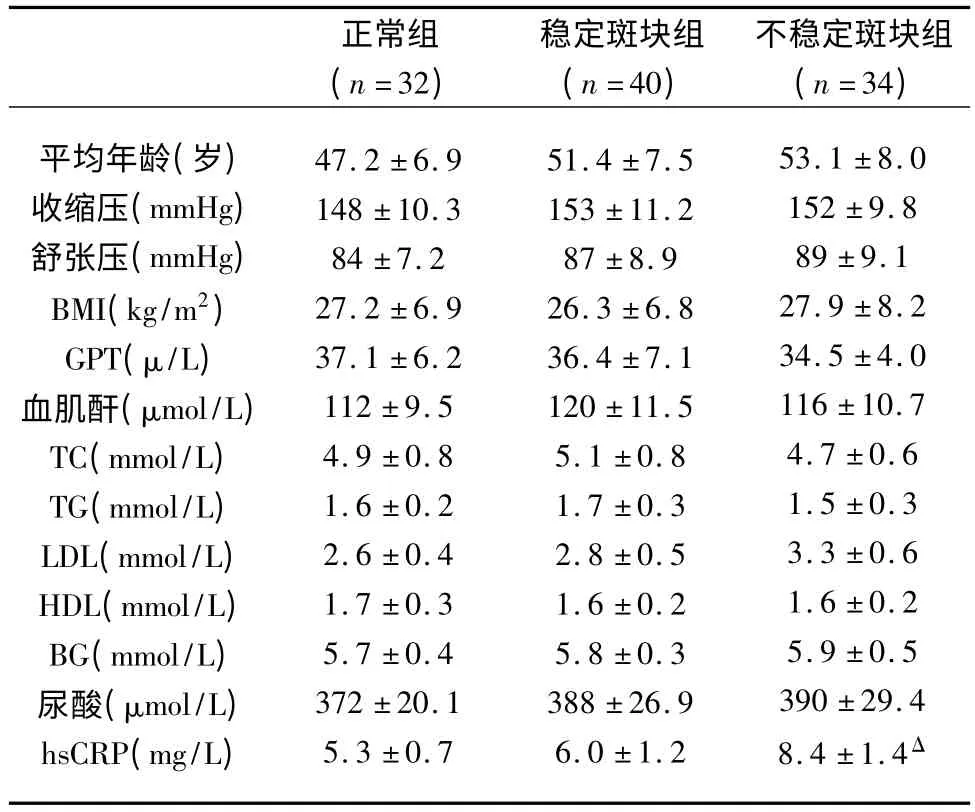
表1 3 组患者的临床资料

图1 不同患者外周血的miR-126 表达

图2 与治疗前相比ΔP <0.05
3 讨论
小分子RNA 作为一个广泛分布的重要的基因调节子,在机体的正常生长、发育、分化、信号转导、疾病和死亡等生理和病理过程均发挥着重要作用。近年来,对miRNA 表达调控机制及其调控相关疾病如恶性肿瘤、病毒感染、炎症和免疫性疾病、内分泌及代谢性疾病以及作为基因靶向药物的研究表明miRNA 不仅参与了疾病的发生发展,同时也可以作为疾病的生物学诊断标志用于疾病的诊断,作为基因药物可用于疾病的治疗[4~6]。
miR-126 是血管特异性的miRNA[7]。研究发现,敲除斑马鱼的miR-126 基因后,胚胎血管的发育受损害,血管的完整性被破坏从而导致出血,该作用的发生与血管内皮生长因子信号通路被抑制有关[3]。敲除小鼠的miR-126 基因后,血管内皮细胞的增殖和迁移能力下降,血管完整性破坏导致容易发生出现出血和死亡,而缺乏miR-126 基因的成年小鼠因为心脏血管的缺陷而发生心肌梗死[3]。血流刺激是促进血管形成的因素之一。在血流机械力的作用下,锌指蛋白诱导转录因子klf2a 表达增加,促进内源性的miR-126 生成,miR-126 激活血管内皮生长因子信号通路,促进血管的生成和发育[8]。在心肌梗死的动物模型研究发现,局部注射miR-126 可以促进缺血心肌的血管再生,改善心肌的血液灌注[9]。血管细胞间粘附分子-1 被发现是miR-126 的靶基因之一,miR-126 通过抑制血管细胞间粘附分子-1 的表达,阻断血液中的白细胞和内皮细胞的粘附,参与动脉粥样硬化的发生[10]。在冠心病导致的慢性心功能衰竭时循环miR-126 水平显著下降,其水平与脑钠肽负相关,随着心功能改善,miR-126 水平上升,表明miR-126 亦可作为心衰的循环标志物[11]。研究还发现冠心病患者的血液miR-126水平下降,miR-126 可能对冠心病进行负调控[12]。以上研究表明miR-126 是维持血管正常结构和功能的miRNA,与动脉粥样硬化的发生发展有关联。
在本文中,我们研究了不同类型颈动脉斑块患者的血液miR-126 水平的变化。我们的研究结果表明,与正常患者相比,颈动脉粥样硬化患者的循环miR-126 水平上升(P <0.05),而且随着颈动脉粥样硬化斑块的进展,由稳定斑块向不稳定斑块发展后,不稳定斑块患者的血液miR-126 水平上升更加明显(P <0.01);在给予瑞舒伐他汀治疗12 个月后,不稳定型颈动脉粥样斑块的患者的斑块稳定性均明显好转,同时外周血hsCRP 及miR-126 水平也明显下降(P <0.05),表明miR-126 可能参与了颈动脉粥样硬化的病理过程,但它在动脉粥样硬化发生发展中的具体作用及机制需要进一步验证和探讨。
[1]Aloke V,Masataka N,Jagat N,et al.Concept of vulnerable/unstable plaque[J].Arterioscler Thromb Vasc Biol,2010,30(7):1282-1292.
[2]Esteller M.Non-coding RNAs in human disease[J].Nat Rev Genet,2011,12(12):861-874.
[3]Wang S,Aurora AB,Johnson BA,et al.The endothelial-specific microRNA miR-126 governs vascular integrity and angiogenesis[J].Dev Cell,2008,15(2):261-271.
[4]Creemers EE,Tijsen AJ,Pinto YM.Circulating microRNAs:novel biomarkers and extracellular communicators in cardiovascular disease[J].Circ Res,2012,110(3):483-495.
[5]van Rooij E,Olson EN.MicroRNA therapeutics for cardiovascular disease:opportunities and obstacles[J].Nat Rev Drug Discov,2012,11(11):860-872.
[6]Vickers KC,Rye KA,Tabet F.MicroRNAs in the onset and development of cardiovascular disease[J].Clin Sci (Lond),2014,126(3):183 -194.
[7]Wei Y,Nazari-Jahantigh M,Neth P,et al.MicroRNA-126,-145,and -155:a therapeutic triad in atherosclerosis[J].Arterioscler Thromb Vasc Biol,2013,33(3):449 -454.
[8]Niscoli S,Stansley C,Walker P,et al.MicroRNA-mediated integration of haemodynamics and vegf signaling during angiogenesis[J].Nature,2010,464(7292):1196-1200.
[9]Chen JJ,Zhou SH.Mesenchymal stem cells overexpressing MiR-126 enhance ischemic angiogenesis via the AKT/ERK-related pathway[J].Cardiol J,2011,18(6):675-681.
[10]Harris TA,Yamakuchi M,Ferlito M,et al.MicroRNA-126 regulates endothelial expression of vascular cell adhesion molecule 1[J].Proc Natl Acad Sci USA,2008,105(5):1516-1521.
[11]Fukushima Y,Nakanishi M,Nonogi H,et al.Assessment of plasma miRNAs in congestive heart failure[J].Circ J,2011,75(2):336-340.
[12]郑志伟,劳海燕,余细勇,等.冠心病患者血浆循环miR-126 的表达及其对血管内皮细胞的影响[J].中国病理生理杂志,2011,27(12):2313-2317.

