酸性鞘磷脂酶/神经酰胺通路在疾病发生发展中作用机制的研究进展
张阔军,顾勤兰,王明慧,赵丽,杨侃,王进欣*(. 中国药科大学江苏省药物分子设计与成药性优化重点实验室,江苏 南京 0009;.中国药科大学高等职业技术学院,江苏 南京0009;.中国药科大学生理教研室,江苏 南京 0009)
酸性鞘磷脂酶/神经酰胺通路在疾病发生发展中作用机制的研究进展
张阔军1,顾勤兰2,王明慧1,赵丽3,杨侃1,王进欣1*
(1. 中国药科大学江苏省药物分子设计与成药性优化重点实验室,江苏 南京 210009;2.中国药科大学高等职业技术学院,江苏 南京210009;3.中国药科大学生理教研室,江苏 南京 210009)
[摘要]酸性鞘磷脂酶/神经酰胺通路可介导细胞凋亡、炎症和自噬等多种细胞活动,与心脑血管疾病、代谢类疾病、肺部和肝部疾病以及神经系统疾病等多种疾病的发生、发展密切相关。酸性鞘磷脂酶现已成为多种疾病的临床生物标记物和潜在的治疗靶点。综述酸性鞘磷脂酶/神经酰胺通路在各种疾病中的生物学功能和作用机制最新研究进展,旨在为相关疾病的治疗提供新思路。
[关键词]酸性鞘磷脂酶;神经酰胺;细胞凋亡;疾病
接受日期:2015-10-20
项目资助:国家自然科学基金面上项目(No. 81473231)
研究方向: 基于天然产物的新药设计与合成研究;
Tel:025-83271414;E-mail: jinxinwang@163.com
Research Progress in Acidic Sphingomyelinase/ Ceramide Pathway: Its Role and Mechanism in
Development of Related Diseases
ZHANG Kuojun1, GU Qinlan2, WANG Minghui1, ZHAO Li3, YANG Kan1, WANG Jinxin1
(1. Key Laboratory of Drug Design and Optimization of Jiangsu Provinve, China Pharmaceutical University, Nangjing 210009, China; 2. Altitude Vocational School, China Pharmaceutical University, Nanjing 210009, China;3. Department of Physiology, China Pharmaceutical University, Nanjing 210009, China)
[Abstract] Acidic sphingomyelinase (ASMase)/ceramide (CE) pathway mediates various cellular processes including cell apoptosis, inflammation and autophagy, and is closely associated with the development of many human diseases, including cardiovascular and cerebrovascular, metabolic, pulmonary, hepatic and neurological disorders. ASMase has been regarded as a promising clinical biomarker and potential therapeutic target for many diseases. The recent progress in investigations on the biological functions and mechanisms of ASMase/CE pathway in these diseases was reviewed, so as to provide new ideas for the treatment of related diseases.
[Key words] acid sphingomyelinase; ceramide; apoptosis; disease
酸性鞘磷脂酶(acid sphingomyelinase,ASMase)是鞘脂类物质代谢的一种关键酶,可催化鞘磷脂(sphingomyelin,SM)生成神经酰胺(ceramide,CE)。虽然CE在体内也可由其他生物途径合成,但ASMase生成途径是体内CE生成最快、最直接的途径。CE还可进一步代谢生成鞘氨醇(sphingosine)、鞘氨醇-1-磷酸(sphingosine-1-phosphate,S1P)等一系列生物活性脂质,CE及其下游代谢物参与多种细胞活动,包括细胞增殖、凋亡、衰老、转移、血管生成、炎症、自噬、感染和蛋白运输等[1]。
ASMase的编码基因SMPD1,能同时产生两种ASMase,即溶酶体酸性鞘磷脂酶(lysosomal acid sphingomyelinase,L-ASMase)和分泌型酸性鞘磷脂酶(secretory acid sphingomyelinase,S-ASMase),两者的分布位置和结构均有差异,且发挥不同的生物学效应。L-ASMase分布于溶酶体内侧,与高甘露糖低聚糖糖基化,且不需额外的Zn2+激活;S-ASMase位于细胞外,需要Zn2+激活,具有复杂的糖基化模式,体内半衰期较长[2]。ASMase最初是因尼曼皮克病(Niemann-Pick disease,NPD)患者体内该酶缺乏导致鞘磷脂在溶酶体内大量聚积而为大家所熟识。近年来,多项研究表明ASMase/CE通路在受体信号分子(如CD95、CD40)、细胞毒试剂(如顺铂、阿霉素)、病原体(如细菌、病毒)、辐射(如紫外线辐射、电离辐射)、氧化应激、缺血再灌注等各种理化刺激下激活,参与细胞凋亡、炎症和自噬等相关信号通路的调控[2-4],在心脑血管疾病、代谢类疾病、肝部和肺部疾病以及神经系统疾病等多种疾病的发生、发展过程中起关键作用(见图1)。本文就ASMase/CE通路在多种疾病中的生物学功能和作用机制研究的最新进展进行综述。
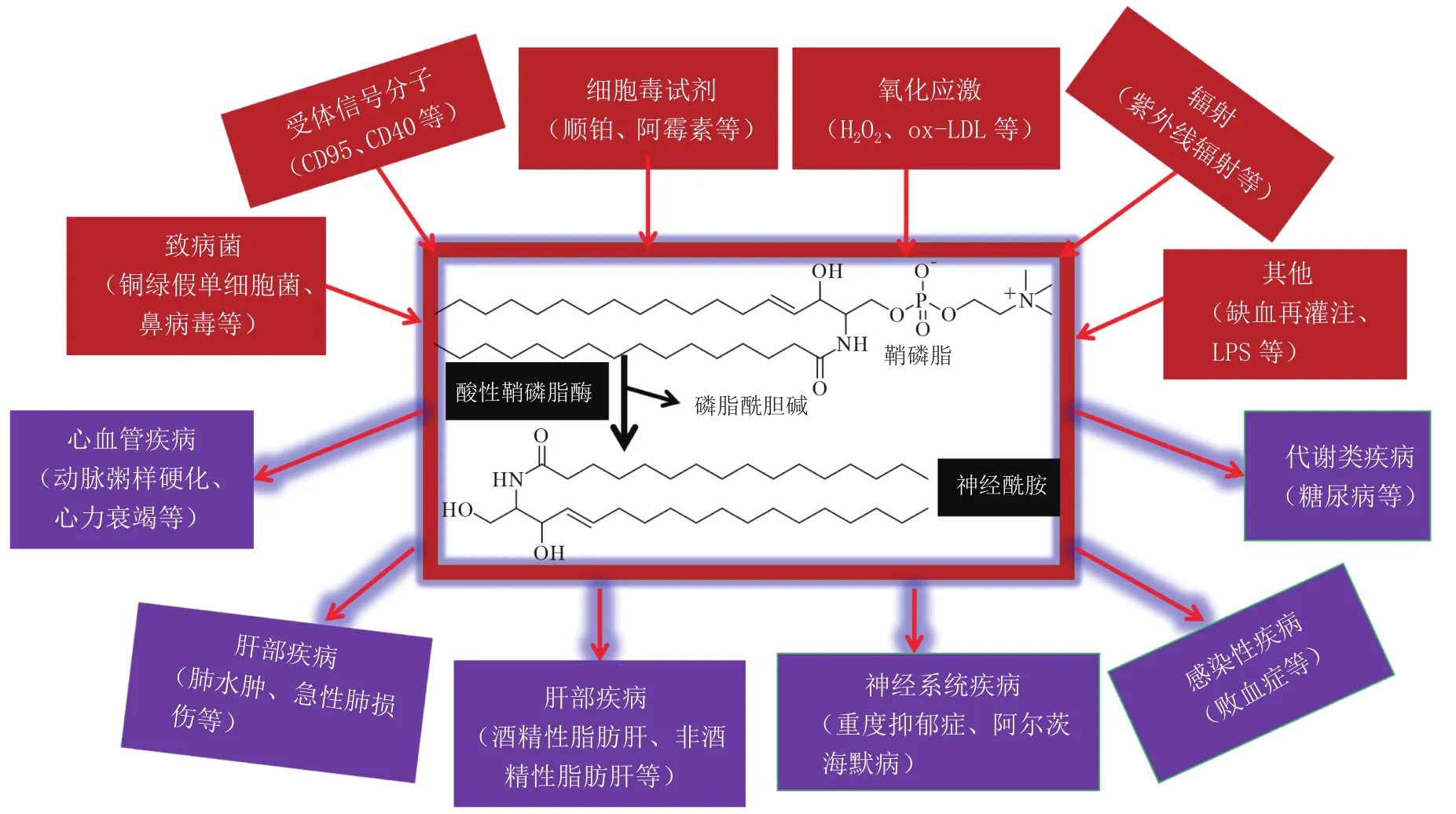
图1 AMSmase/CE通路生物学机制Figure 1 Biological mechanism of ASMase/CE pathway
1 ASMase/CE通路与心脑血管疾病
1.1动脉粥样硬化
研究表明,ASMase/CE通路激活在动脉粥样硬化(arteriosclerosis,AS)发生、发展的各个环节均发挥重要作用。Schissel等最早发现粥样硬化斑块损伤处提取的低密度脂蛋白(low density lipoprotein,LDL)与血浆中的LDL相比,SM和CE含量均明显增高。该课题组进一步研究发现:①AS动物模型和患者的斑块损伤处均有S-ASMase表达,其可在生理(中性)pH条件下水解动脉粥样硬化LDL表面的SM生成CE,导致LDL颗粒聚集融合,增强LDL对动脉壁蛋白聚糖的亲和力,造成LDL内皮下聚集和滞留[5],而LDL聚集后更易被巨噬细胞摄入,从而诱导泡沫细胞形成[6];②AS过程始终伴随炎症反应,损伤处的血管壁本身含有高水平的促炎因子,导致局部炎症反应,促炎因子激活ASMase/CE通路,而CE又可刺激促炎因子进一步表达,最终造成内膜增厚和斑块破裂,介导AS炎症过程[7]。最近,Deevska等[8]也证实了S-ASMase在LDL聚集中的重要作用。研究表明,在外界刺激(如死亡受体CD95)下,L-ASMase转移至细胞膜外叶,水解细胞膜SM,释放大量CE,CE自我联结,形成CE富集的膜平台,加速NADPH氧化酶亚基的聚集和激活,刺激活性氧(reactive oxygen species,ROS)的产生,引发氧化应激,降低NO生物活性,最终导致内皮细胞功能失调[9-11]。另外,血管平滑肌细胞的增殖和凋亡均促进AS病变的发展,而ASMase/CE通路激活可同时参与平滑肌细胞增殖和凋亡的调控过程。
值得注意的是,尽管大量证据表明ASMase/CE通路激活促进AS病理发展,但临床研究结果却表明A型和B型NPD患者(ASMase缺陷)患冠状动脉粥样硬化的风险较大[12]。最近也有文献报道,动物模型中ASMase具有抗AS作用,比如腺病毒诱导ASMase表达、分泌至血液循环,但并没有加重载脂蛋白E(apolipoprotein E,apoE)缺陷小鼠(apoE-/-)粥样硬化斑块损伤,反而降低了损伤[13]。特别是L-ASMase被报道具有抗AS作用,其可能的机制:①L-ASMase水解溶酶体中SM,释放出胆固醇,加速胆固醇运输至细胞外,阻止胆固醇在巨噬细胞溶酶体中的聚集[14];②L-ASMase通过调节自噬(autophagy)成熟过程发挥其抗AS效应[15-16]。因此,L-ASMase与S-ASMase在AS中的作用及机制完全不同,两者在上述过程中的确切调控机制尚未明确,还需进一步深入研究。
1.2缺血再灌注损伤
大量体外、离体和体内试验结果表明,ASMase/CE通路激活是缺血再灌注(ischemia/reperfusion,I/R)损伤产生的机制之一,I/R诱导ASMase/CE通路激活,导致细胞凋亡或介导炎症因子的产生造成细胞损伤。例如,大鼠左冠状动脉闭塞模型中,缺血后CE的水平升高,再灌注后CE升高更加显著,CE诱导心肌细胞凋亡[17-18];家兔左冠状动脉闭塞模型中,CE明显升高,而缺血前静脉注射D609(抑制ASMase和CE的生成)可减少心肌细胞凋亡和心肌梗死面积[19];局灶性脑缺血导致野生型小鼠(ASMase+/+)ASMase/CE通路激活,产生大量促炎因子,而ASMase-/-小鼠或ASMase+/+小鼠预先给予D609可有效降低脑部损伤程度,减小梗死面积,提高神经功能,改善脑缺血再灌注后的中风症[20]。Usta等[21]采用人类心肌活检,发现CE介导心麻痹和I/R中心肌细胞凋亡,而缺血前给予ASMase功能性抑制剂阿米替林,人心肌细胞凋亡现象明显降低,预示ASMase抑制剂可应用于临床减轻I/R损伤。
缺血预处理(ischemic preconditioning,IP)可使I/R心肌细胞凋亡减轻,心肌梗死面积减小,心律失常发生率降低,并促进再灌注后心肌功能的恢复等,但其机制尚不完全明确。Cui等[22]研究表明,IP 可短暂性激活ASMase,生成一定量的CE,而CE进一步代谢生成S1P,最终CE减少、S1P增加。S1P与CE不同,具有抗凋亡效应,从而产生心肌保护作用,而在IP之前用ASMase功能性抑制剂去郁敏抑制ASMase活性则会抑制预处理的心肌保护作用。另外,Der等[23]研究表明IP可通过降低CE的生成而使内皮一氧化氮合成酶(endothelial nitric oxide synthase,eNOS)从小窝蛋白-1 (caveolin 1,Cav-1)中释放出来,生成心肌可利用的NO,从而降低心肌损伤。由此可见,ASMase、CE以及CE下游的代谢物共同参与IP的调控过程,但它们在该过程的具体调节机制尚需进一步研究。
2 ASMase/CE通路与代谢类疾病
糖尿病(diabetes mellitus)分为1型糖尿病和2型糖尿病两种类型,CE在两种类型糖尿病的发病机制中发挥多方面的作用,主要包括诱导β-细胞凋亡、胰岛素抵抗以及降低胰岛素基因的表达[24]。例如,链脲霉素诱导的糖尿病小鼠模型中,肾脏和血浆中的CE含量升高,血浆中S-ASMase活性增加,提示CE介导糖尿病小鼠的肾脏损伤[25];2型糖尿病患者中CE含量升高,且CE含量与胰岛素的敏感性呈负相关[22]。另外,有研究表明ASMase/CE通路在糖尿病并发症中起关键作用,如糖尿病视网膜病变(diabetic retinopathy,DR)等[26]。Busik课题组发现:①在视网膜内皮细胞(体外)和1型糖尿病小鼠模型(体内)中,ASMase活性升高,介导视网膜血管炎症,ASMase基因敲除或二十二碳六烯酸(docosahexaenoic acid,DHA)抑制ASMase活性,可有效抑制视网膜微血管炎症及非细胞微血管的形成[27];②在2型糖尿病小鼠模型中,视网膜和内皮祖细胞(一种血管内皮损伤修复细胞)ASMase活性均升高,而DHA抑制视网膜内皮细胞ASMase活性可抑制视网膜炎症、血管损伤,抑制内皮祖细胞ASMase活性可恢复内皮祖细胞的血管修复功能[28],因此,ASMase在糖尿病视网膜病变的血管退化阶段发挥重要作用,抑制ASMase既可抑制血管退化,又可恢复血管修复功能,提示ASMase是治疗DR的潜在有效靶点。
3 ASMase/CE通路与肺部疾病
3.1囊性纤维化
囊性纤维化(cystic fibrosis,CF)会累及身体多处器官,其中肺部所受的影响最为严重,主要表现为肺部慢性炎症,反复性、持续性肺部感染以及肺部纤维化。大量证据表明,在CF细胞和动物模型以及患者中存在ASMase/CE通路异常、CE聚集的现象[4, 29-30]。铜绿假单胞菌(Pseudomonas aeruginosa)感染是CF患者死亡的主要原因,Teichgräber等[4]研究发现不同品种CF小鼠模型以及CF患者肺部标本的CE水平升高,促进了肺部炎症、内皮细胞死亡、增加支气管DNA沉积,从而增加了对P. aeruginosa感染的敏感性。抑制ASMase活性或者ASMase基因杂合小鼠(ASMase+/-),可使CE水平恢复正常,并阻止上述所有病理表现,降低细菌感染。Brodlie等[30]也证实CE聚集出现在CF患者中。鉴于ASMase基因敲除和系统性抑制ASMase可能会给机体组织带来副作用,Becker等[31]研究了CF小鼠肺部局部吸入ASMase抑制剂的影响,结果表明,ASMase抑制剂局部吸入与ASMase基因敲除和系统性抑制ASMase产生相似效果。另外,Ziobro等[32]研究表明CE促进肺纤维化,长时间给予阿米替林可减慢肺纤维化进程。
3.2肺水肿和急性肺损伤
金黄色葡萄球菌(Staphylococcus aureus)引起的肺水肿模型中,ASMase/CE通路通过产生超氧化物破坏紧密连接蛋白(tight junctions,TJs)在肺水肿中起重要作用。阿米替林抑制ASMase活性或敲除ASMase基因均可抑制感染小鼠的肺水肿,但不能减少细菌的数量;而给予抗生素可减少细菌的数量,但不能抑制小鼠肺水肿。因此,抗生素与ASMase抑制剂合用既可抑制肺水肿,又可减少细菌数量,从而保护小鼠免受致命的败血症和肺功能障碍[33]。
新生儿肺部急性炎症模型中,ASMase/CE通路激活,使血管通透性增加,表面活性剂钝化,肺泡上皮细胞凋亡,诱发肺水肿。给予外源性表面活性剂对肺部功能只能起暂时性保护作用,而将ASMase功能性抑制剂丙米嗪与表面活性剂同时给予一次打击诱发的新生幼猪急性肺损伤模型,可改善其肺部功能,且在灌洗液中其白细胞计数和白细胞介素-8(interleukin-8,IL-8)浓度均降低[34]。在后续研究中,研究者们采用三次打击诱发的新生幼猪急性肺损伤模型,将表面活性剂与ASMase抑制剂磷脂酰肌醇-3,5-双磷酸(phosphatidylinositol-3,5-bisphosphate,PIP2)或肌醇-1,2,6-三磷酸(inositol-1,2,6-trisphosphate,IP3)合用,能明显改善肺部功能,抑制肺水肿的发生;分离的肺部组织中ASMase活性和CE浓度降低,各种炎症因子、转化生长因子表达降低,粒细胞的浸润减轻,表面活性剂的表面张力也降低[35-36]。
血小板激活因子(platelet-activating factor,PAF)能迅速增加血管通透性,是肺水肿发生的重要调节因子。Göggel等[37]研究表明PAF引发肺水肿包括两种机制:ASMase激活产生 CE以及环氧合酶(cyclooxygenase,COX)激活产生前列腺素E2(prostaglandin E2,PGE2)。在此基础上,研发人员进一步研究发现,PAF引起ASMase激活,产生大量CE,促进各种信号分子包括Cav-1、eNOS、经典瞬时受体电位-6(transient receptor potential classical 6,TRPC6)等募集至内皮细胞的小窝。这一方面导致eNOS与Cav-1结合,减少NO的合成;另一方面促进了Ca2+内流,血管通透性增加,最终诱导肺水肿的发生[38- 39]。
4 ASMase/CE通路与肝部疾病
4.1脂肪性肝炎
脂肪性肝炎(Steatohepatitis,SH)是脂肪性肝疾病的中间阶段,主要包括酒精性脂肪性肝炎(alcoholic steatohepatitis,ASH)和非酒精性脂肪性肝炎(nonalcoholic steatohepatitis steatohepatitis,NASH)。有研究表明,ASH和NASH患者血清中ASMase水平升高,提示ASMase有望成为慢性肝疾病的新标志物[40]。Fernández-Checa课题组的研究表明,ASH和NASH患者以及动物模型中ASMase激活,可介导内质网应激(endoplasmic reticulum stress,ER stress)、自噬和溶酶体膜透化作用(lysosomal membrane permeabilization,LMP),导致胰岛素抵抗、脂肪变性、脂毒性、凋亡以及纤维化,从而促进ASH和NASH的发展进程[41-43]。给予ASMase+/+小鼠阿米替林,可抑制高脂肪食物引起的脂肪变性、纤维化和肝脏损伤,提示阿米替林可能成为NASH的有效治疗方法[43]。另外,ASMase激活导致蛋氨酸代谢失常,如降低S-腺苷-L-蛋氨酸(S-adenosyl-L-methionine,SAM)和卵磷脂(phosphatidylcholine,PC)的水平,破坏甲基化反应、抗氧化防御作用以及膜的完整性,从而促进ASH和NASH病变发展。
4.2其他肝脏损伤
在肿瘤坏死因子α(tumor necrosis factorα,TNF-α)[44]、I/R[45]以及Wilson病[46]等诱导的肝细胞凋亡与ASMase/CE通路密切相关。Llacuna等[45]发现,ASMase在小鼠肝脏I/R中被激活而释放大量CE,CE激活下游的氨基末端激酶(Jun N-terminal kinase,JNK)通路,促进促凋亡蛋白BimL(Bcl-2 interacting mediator of cell death L)磷酸化,并转移至线粒体,从而诱导线粒体凋亡途径,造成肝损伤。丙米嗪抑制ASMase活性以及siRNA沉默ASMase基因,可降低血清中丙氨酸氨基转移酶(alanine aminotransferase,ALT)的水平,减轻肝细胞坏死和凋亡,使肝损伤程度明显降低。Wilson病是一种由铜代谢障碍引起的常染色体隐性遗传性疾病,临床表现为肝损害、锥体外系症状以及贫血等。Lang等[46]研究表明大量的Cu2+聚集,激活ASMase/CE通路,一方面诱导肝细胞凋亡、促进肝硬化的发生,另一方面促进红细胞膜上磷脂酰丝氨酸的外露,从而使红细胞易被其他细胞内化而造成贫血。给予Wilson小鼠丙米嗪,可阻止肝硬化、肝损伤,增加小鼠的生存率,并抑制贫血的发生。另外,Moles 等[47]发现ASMase/CE通路激活,可通过调节组织蛋白酶B(cathepsinB,CtsB)和组织蛋白酶D(cathepsinD,CtsD)的蛋白酶水解过程进而促进肝星状细胞(hepatic stellate cell,HSC)的激活和增殖,促进肝纤维化进程。丙米嗪、阿米替林抑制ASMase活性、siRNA沉默ASMase基因或ASMase杂合小鼠(ASMase+/-),均可使CtsB/D的水解处理过程钝化,HSC的激活和增殖受到抑制。总之,抑制ASMase/CE通路激活具有双重效应,既可抑制肝细胞凋亡而减轻肝脏损伤,又可抑制HSC激活而抑制肝纤维化进程,因此,ASMase有望成为治疗慢性肝疾病的新靶点。
5 ASMase/CE通路与神经系统疾病
5.1阿尔茨海默病
阿尔茨海默病(Alzheimer's disease,AD)是一种神经退行性疾病,主要病理特征为β-淀粉样蛋白(amyloid β peptide,Aβ)沉积形成老年斑(senile plaques,SPs)和tau蛋白过度磷酸化形成神经元纤维缠结(neurofibrillary tangles,NFTs)。Malaplate-Armand等[48]研究表明Aβ寡聚体激活磷脂酶A2(phospholipase A2,cPLA2)-花生四烯酸(arachidonic acid,AA)-ASMase-CE通路可引起神经元细胞凋亡,而CE下游代谢物S1P通过抑制ASMase活性进而抑制Aβ寡聚体引起的细胞凋亡,是很强的神经保护因子。He等[49]对AD患者大脑标本中ASMase、CE及其下游的酸性神经酰胺酶(acid ceramidase,AC)、鞘氨醇、S1P的水平进行了全面分析,结果表明ASMase以及AC活性增加,CE、鞘氨醇水平升高,S1P降低,可共同促进神经元细胞凋亡。提示,ASMase的激活和S1P的降低与Aβ沉积和过度磷酸化的tau蛋白水平密切相关。自噬(autophagy)功能障碍或受限是AD发病的重要原因。Lee等[50]发现AD小鼠模型中ASMase激活,导致溶酶体活性降低、自噬功能障碍,进而促进AD病变的发展。ASMase基因部分敲除或阿米替林盐酸盐抑制AD小鼠ASMase活性,可使溶酶体自噬功能恢复正常,Aβ沉积减少,小鼠的认知功能和记忆力得到改善。另有研究表明,CE还可通过稳定β-分泌酶1(β-site APP cleaving enzyme 1,BACE1)进而促进Aβ的生成,造成Aβ过量沉积[51]。
5.2重度抑郁症
重度抑郁症(major depressive disorder,MDD)是一种严重的情绪障碍,终生患病率超过10%,而MDD的发病原因和机制到目前为止尚不明确。Gulbins课题组的研究表明ASMase/CE通路在MDD的发病机制中起核心作用[52]:①MDD患者脑内ASMase活性和CE水平均明显异常升高[53];②三环类抗抑郁药,例如阿米替林、氟西汀等通过抑制ASMase/CE通路激活发挥其抗抑郁功效,证实ASMase是抗抑郁的潜在靶点[54];③CE可抑制多巴胺转运体(dopamine transporter,DAT)活性,导致多巴胺转运受阻而血清素转运增加,从而引发抑郁症[55]。
6 酸性鞘磷脂酶抑制剂
多种疾病的发生、发展与ASMase/CE通路激活密切相关,ASMase抑制剂可下调ASMase的表达和活性,进而降低CE水平,对相关疾病的预防和治疗具有重要意义。目前,报道的ASMase抑制剂主要有两种类型:功能性抑制剂和直接抑制剂[56]。ASMase功能性抑制剂是一类促使ASMase从溶酶体膜上脱落而与蛋白水解酶结合,导致ASMase降解失活的化合物[57],目前主要为三环类抗抑郁药,如丙咪嗪、去郁敏、阿米替林等。但该类抑制剂会抑制其他溶酶体水解酶,选择性较差[58];无组织特异性,会产生不良反应;起效浓度高,高剂量必然会导致一定的毒副作用。ASMase直接抑制剂是一类直接作用于ASMase而使之失活的化合物,目前主要有底物类似物、磷酸酯类和天然产物类[58]。底物类似物虽然活性较好,但对中性鞘磷脂酶也有抑制作用,故选择性较差;磷酸酯类对磷脂酶A1、 A2、C和D不稳定,且不易透过细胞膜,应用受到限制;Okudaira 等[59]发现,藤黄属植物中分离得到的3个氧杂蒽酮化合物(α-mangostin、cowanin和cowanol)对ASMase具有较高的抑制活性。迄今为止,ASMase蛋白晶体结构尚未见报道,基于受体的药物设计无法进行,ASMase直接抑制剂的研究任重道远。本课题组近期研究发现了一些结构新颖、抑制活性较好的ASMase直接抑制剂[60],将有助于ASMase相关疾病的预防和治疗药物的研究与开发。
7 结语
综上所述,ASMase/CE通路在多种疾病中的作用及机制研究已取得重要进展,充分证实ASMase/CE通路在相关疾病中的重要作用。但目前大多数研究只是针对细胞和动物模型,相关临床研究较少,ASMase/CE通路在病理生理中的确切调控机制以及CE下游代谢产物的确切变化规律尚需进一步的深入研究。另外,由于高效、高选择性的ASMase抑制剂严重缺乏,大多数研究只能使用基因敲除或RNA干扰技术,疾病发展过程中ASMase的拓扑学问题也尚未解决。随着研究方法和技术的成熟,以及高效、高选择性抑制剂的发现,ASMase/CE通路生物学机制逐步被阐明,将为心脑血管疾病、肺部和肝部疾病以及神经系统疾病等人类重大疾病的预防和治疗提供新思路、新策略。
[参 考 文 献]
[1]Jenkins R W, Canals D, Hannun Y A. Roles and regulation of secretory and lysosomal acid sphingomyelinase [J]. Cell Signal, 2009, 21(6): 836-846.
[2]Kornhuber J, Rhein C, Müller C P, et al. Secretory sphingomyelinase in health and disease[J]. Biol Chem, 2015, 396(6/7): 707-736.
[3]Sentelle R D, Senkal C E, Jiang W, et al. Ceramide targets autophagosomes to mitochondria and induces lethal mitophagy[J]. Nat Chem Biol, 2012, 8(10): 831-838.
[4]Teichgräber V, Ulrich M, Endlich N, et al. Ceramide accumulation mediates inflammation, cell death and infection susceptibility in cystic fibrosis[J]. Nat Med, 2008, 14(4): 382-391.
[5]Tabas I, Williams K J, Borén J. Subendothelial lipoprotein retention as the initiating process in atherosclerosis: update and therapeutic implications[J]. Circulation, 2007, 116(16): 1832-1844.
[6]Devlin C M, Leventhal A R, Kuriakose G, et al. Acid sphingomyelinase promotes lipoprotein retention within early atheromata and accelerates lesion progression[J]. Arterioscler Thromb Vasc Biol, 2008, 28(10): 1723-1730.
[7]Wong M L, Xie B, Beatini N, et al. Acute systemic inflammation upregulates secretory sphingomyelinase in vivo: a possible link between inflammatory cytokines and atherogenesis[J]. Proc Natl Acad Sci USA, 2000, 97(15): 8681-8686.
[8]Deevska G M, Sunkara M, Morris A J, et al. Characterization of secretory sphingomyelinase activity, lipoprotein sphingolipid content and LDL aggregation in ldlr-/- mice fed on a high-fat diet[J]. Biosci Rep, 2012, 32(5): 479-490.
[9]Li P L, Zhang Y, Yi F. Lipid raft redox signaling platforms in endothelial dysfunction[J]. Antioxid Redox Signal, 2007, 9(9): 1457-1470.
[10]Li X, Becker K A, Zhang Y. Ceramide in redox signaling and cardiovascular diseases[J]. Cell Physiol Biochem, 2010, 26(1): 41-48.
[11]Li P L, Zhang Y. Cross talk between ceramide and redox signaling: implications for endothelial dysfunction and renal disease[J]. Handb Exp Pharmacol, 2013( 216): 171-197.
[12]McGovern M M, Pohl-Worgall T, Deckelbaum R J, et al. Lipid abnormalities in children with types A and B Niemann Pick disease[J]. J Pediatr, 2004, 145(1): 77-81.
[13]Leger A J, Mosquea L M, Li L, et al. Adeno-associated virus-mediated expression of acid sphingomyelinase decreases atherosclerotic lesionformation in apolipoprotein E(-/-) mice[J]. J Gene Med, 2011, 13(6): 324-332.
[14]Leventhal A R, Chen W, Tall A R, et al. Acid sphingomyelinase-deficient macrophages have defective cholesterol trafficking and efflux[J]. J Biol Chem, 2001, 276(48): 44976-44983.
[15]Li X, Xu M, Pitzer A L, et al. Control of autophagy maturation by acid sphingomyelinase in mouse coronary arterial smooth muscle cells: protective role in atherosclerosis[J]. J Mol Med (Berl), 2014, 92(5): 473-485.
[16]Luft F C. Acid sphingomyelinase, autophagy, and atherosclerosis[J]. J Mol Med (Berl), 2014, 92(5): 429-431.
[17]Bielawska A E, Shapiro J P, Jiang L, et al. Ceramide is involved in triggering of cardiomyocyte apoptosis induced by ischemia and reperfusion[J]. Am J Pathol, 1997, 151(5): 1257-1263.
[18]Cordis G A, Yoshida T, Das D K. HPTLC analysis of sphingomylein, ceramide and sphingosine in ischemic/reperfused rat heart[J]. J Pharm Biomed Anal, 1998, 16(7): 1189-1193.
[19]Argaud L, Prigent A F, Chalabreysse L, et al. Ceramide in the antiapoptotic effect of ischemic preconditioning[J]. Am J Physiol Heart Circ Physiol, 2004, 286(1): H246-H251.
[20]Yu Z F, Nikolova-Karakashian M, Zhou D, et al. Pivotal role for acidic sphingomyelinase in cerebral ischemia-induced ceramide and cytokine production, and neuronal apoptosis[J]. J Mol Neurosci, 2000, 15(2): 85-97.
[21]Usta E, Mustafi M, Artunc F, et al. The challenge to verify ceramide's role of apoptosis induction in human cardiomyocytes--a pilot study[J]. J Cardiothorac Surg, 2011, 6: 38.
[22]Cui J, Engelman R M, Maulik N, et al. Role of ceramide in ischemic preconditioning[J]. J Am Coll Surg, 2004, 198(5): 770-777.
[23]Der P, Cui J, Das D K. Role of lipid rafts in ceramide and nitric oxide signaling in the ischemic and preconditioned hearts[J]. J Mol Cell Cardiol, 2006, 40(2): 313-320.
[24]Galadari S, Rahman A, Pallichankandy S, et al. Role of ceramide in diabetes mellitus: evidence and mechanisms[J]. Lipids Health Dis, 2013, 12: 98.
[25]Kobayashi K, Ichi I, Nakagawa T, et al. Increase in plasma ceramide levels via secretory sphingomyelinase activity in streptozotocin-induced diabetic rats[J]. Med Chem Comm, 2011, 2(6): 536-541.
[26]Opreanu M, Lydic T A, Reid G E, et al. Inhibition of cytokine signaling in human retinal endothelial cells through downregulation of sphingomyelinases by docosahexaenoic acid[J]. Invest Ophthalmol Vis Sci, 2010, 51(6): 3253-3263.
[27]Opreanu M, Tikhonenko M, Bozack S, et al. The unconventional role of acid sphingomyelinase in regulation of retinal microangiopathy in diabetic human and animal models[J]. Diabetes, 2011, 60(9): 2370-2378.
[28]Tikhonenko M, Lydic T A, Opreanu M, et al. N-3 polyunsaturated Fatty acids prevent diabetic retinopathy by inhibition of retinal vascular damage and enhanced endothelial progenitor cell reparative function[J]. PLoS One, 2013, 8(1): e55177.
[29]Becker K A, Tümmler B, Gulbins E, et al. Accumulation of ceramide in the trachea and intestine of cystic fibrosis mice causes inflammation and cell death[J]. Biochem Biophys Res Commun, 2010, 403(3/4): 368-374.
[30]Brodlie M, McKean M C, Johnson G E, et al. Ceramide is increased in the lower airway epithelium of people with advanced cystic fibrosis lung disease[J]. Am J Respir Crit Care Med, 2010, 182(3): 369-375.
[31]Becker K A, Riethmüller J, Lüth A, et al. Acid sphingomyelinase inhibitors normalize pulmonary ceramide and inflammation in cystic fibrosis[J]. Am J Respir Cell Mol Biol, 2010, 42(6): 716-724.
[32]Ziobro R, Henry B, Edwards M J, et al. Ceramide mediates lung fibrosis in cystic fibrosis[J]. Biochem Biophys Res Commun, 2013, 434(4): 705-709.
[33]Peng H, Li C, Kadow S, et al. Acid sphingomyelinase inhibition protects mice from lung edema and lethal Staphylococcus aureus sepsis[J]. J Mol Med (Berl), 2015, 93(6): 675-689.
[34]von Bismarck P, Wistädt C F, Klemm K, et al. Improved pulmonary function by acid sphingomyelinase inhibition in a newborn piglet lavage model[J]. Am J Respir Crit Care Med, 2008, 177(11): 1233-1241.
[35]Preuss S, Omam F D, Scheiermann J, et al. Topical application of phosphatidyl-inositol-3,5-bisphosphate for acute lung injury in neonatal swine[J]. J Cell Mol Med, 2012, 16(11): 2813-2826.
[36]Preuss S, Stadelmann S, Omam F D, et al. Inositol-trisphosphate reduces alveolar apoptosis and pulmonary edema in neonatal lung injury[J]. Am J Respir Cell Mol Biol, 2012, 47(2): 158-169.
[37]Gӧggel R, Winoto-Morbach S, Vielhaber G, et al. PAF-mediated pulmonary edema: a new role for acid sphingomyelinase and ceramide[J]. Nat Med, 2004, 10(2): 155-160.
[38]Yang Y, Yin J, Baumgartner W, et al. Platelet-activating factor reducesendothelial nitric oxide production: role of acid sphingomyelinase[J]. Eur Respir J, 2010, 36(2): 417-427.
[39]Samapati R, Yang Y, Yin J, et al. Lung endothelial Ca2+and permeability response to platelet-activating factor is mediated by acid sphingomyelinase and transient receptor potential classical 6[J]. Am J Respir Crit Care Med, 2012, 185(2): 160-170.
[40]Grammatikos G, Mühle C, Ferreiros N, et al. Serum acid sphingomyelinase is upregulated in chronic hepatitis C infection and non alcoholic fatty liver disease[J]. Biochim Biophys Acta, 2014, 1841(7): 1012-1020.
[41]Garcia-Ruiz C, Mato J M, Vance D, et al. Acid sphingomyelinaseceramide system in steatohepatitis: a novel target regulating multiple pathways[J]. J Hepatol, 2015, 62(1): 219-233.
[42]Fernandez A, Matias N, Fucho R, et al. ASMase is required for chronic alcohol induced hepatic endoplasmic reticulum stress and mitochondrial cholesterol loading[J]. J Hepatol, 2013, 59(4): 805-813.
[43]Fucho R, Martínez L, Baulies A, et al. ASMase regulates autophagy and lysosomal membrane permeabilization and its inhibition prevents early stage non-alcoholic steatohepatitis[J]. J Hepatol, 2014, 61(5): 1126-1134.
[44]Mari M, Colell A, Morales A, et al. Acidic sphingomyelinase downregulates the liver-specific methionine adenosyltransferase 1A, contributing to tumor necrosis factor-induced lethal hepatitis[J]. J Clin Invest, 2004, 113(6): 895-904.
[45]Llacuna L, Marí M, Garcia-Ruiz C, et al. Critical role of acidic sphingomyelinase in murine hepatic ischemia-reperfusion injury[J]. Hepatology, 2006, 44(3): 561-572.
[46]Lang P A, Schenck M, Nicolay J P, et al. Liver cell death and anemia in Wilson disease involve acid sphingomyelinase and ceramide[J]. Nat Med, 2007, 13(2): 164-170.
[47]Moles A, Tarrats N, Morales A, et al. Acidic sphingomyelinase controls hepatic stellate cell activation and in vivo liver fibrogenesis[J]. Am J Pathol, 2010, 177(3): 1214-1224.
[48]Malaplate-Armand C, Florent-Béchard S, Youssef I, et al. Soluble oligomers of amyloid-beta peptide induce neuronal apoptosis by activating a cPLA2-dependent sphingomyelinase-ceramide pathway[J]. Neurobiol Dis, 2006, 23(1): 178-189.
[49]He X, Huang Y, Li B, et al. Deregulation of sphingolipid metabolism in Alzheimer's disease[J]. Neurobiol Aging, 2010, 31(3): 398-408.
[50]Lee J K, Jin H K, Park M H, et al. Acid sphingomyelinase modulates the autophagic process by controlling lysosomal biogenesis in Alzheimer's disease[J]. J Exp Med, 2014, 211(8): 1551-1570.
[51]Patil S, Melrose J, Chan C. Involvement of astroglial ceramide in palmitic acid-induced Alzheimer-like changes in primary neurons[J]. Eur J Neurosci, 2007, 26(8): 2131-2141.
[52]Gulbins E, Walter S, Becker K A, et al. A central role for the acid sphingomyelinase/ceramide system in neurogenesis and major depression[J]. J Neurochem, 2015, 134(2): 183-192.
[53]Kornhuber J, Medlin A, Bleich S, et al. High activity of acid sphingomyelinase in major depression[J]. J Neural Transm(Vienna), 2005, 112(11): 1583-1590.
[54]Gulbins E, Palmada M, Reichel M, et al. Acid sphingomyelinaseceramide system mediates effects of antidepressant drugs[J]. Nat Med, 2013, 19(7): 934-938.
[55]Kornhuber J, Reichel M, Tripal P, et al. The role of ceramide in major depressive disorder[J]. Eur Arch Psychiatry Clin Neurosci, 2009, 259(Suppl 2): S199-S204.
[56]Kornhuber J, Muehlbacher M, Trapp S, et al. Identification of novel functional inhibitors of acid sphingomyelinase[J]. PLoS One, 2011, 6(8): e23852.
[57]Elojeimy S, Holman D H, Liu X, et al. New insights on the use of desipramine as an inhibitor for acid ceramidase[J]. FEBS Lett, 2006, 580(19): 4751-4756.
[58]Arenz C. Small molecule inhibitors of acid sphingomyelinase[J]. Cell Physiol Biochem, 2010, 26(1): 1-8.
[59]Okudaira C, Ikeda Y, Kondo S, et al. Inhibition of acidic sphingomyelinase by xanthone compounds isolated from Garcinia speciosa[J]. J Enzyme Inhib, 2000, 15(2): 129-138.
[60]杨侃, 张阔军, 胡松源, 等. 酸性神经鞘磷脂酶直接抑制剂的设计、合成及生物活性[J]. 高等学校化学学报, 2015, 36(2): 279-286.
*通讯作者:王进欣,教授;
[中图分类号]R363.2+1
[文献标志码]A
[文章编号]1001-5094(2015)11-0838-08

