泊沙康唑药动学-药效学及其治疗药物监测研究进展
陈璐,王陶陶,董亚琳(西安交通大学第一附属医院药学部,陕西 西安 710061)
泊沙康唑药动学-药效学及其治疗药物监测研究进展
陈璐,王陶陶,董亚琳*
(西安交通大学第一附属医院药学部,陕西 西安 710061)
[摘要]泊沙康唑为新一代三唑类广谱抗真菌药,临床主要用于侵袭性曲霉菌病、念珠菌病的预防和难治性口咽念珠菌病的治疗,具有抗菌活性高、耐受性好、不良反应少等特点,但其口服后生物利用度具有较大的个体差异。综述泊沙康唑混悬液的药动学影响因素、不同患者人群的药动学特征以及群体药动学特征、药动学/药效学特性、治疗药物监测对临床疗效和不良反应的重要影响,以指导临床个体化用药,提高用药的有效性和安全性。
[关键词]泊沙康唑;药动学;药效学;群体药动学;治疗药物监测
接受日期:2015-10-04
研究方向:临床药理;
Tel:029-85323241;E-mail:dongyalin@mail.xjtu.edu.cn
Advances in Research on Pharmacokinetics/ Pharmacodynamics of Posaconazole and Its Therapeutic Drug Monitoring
CHEN Lu, WANG Taotao, DONG Yalin
(Department of Pharmacy, the First Affiliated Hospital of Xi’an JiaotongUniversity, Xi’an 710061, China)
[Abstract] Posaconazole is a new-generation azole antifungal agent which is used for prophylaxis of invasive Aspergillus and Candida infections and treatment of refractory oropharyngeal candidiasis. Despite its high antimicrobial activity, good tolerability and less adverse reactions, considerable individual variations in pharmacokinetics have been observed. In this article, pharmacokinetics affecting factors, pharmacokinetic characteristics in different patient populations, population pharmacokinetics, pharmacokinetics/pharmacodynamics and the influence of therapeutic drug monitoring on clinical efficacy and adverse reactions were reviewed for posaconazole, so as to provide guidance for individualized therapy and to improve drug efficacy and safety.
[Key words] posaconazole; pharmacokinetics; pharmacodynamics; population pharmacokinetics; therapeutic drug monitoring
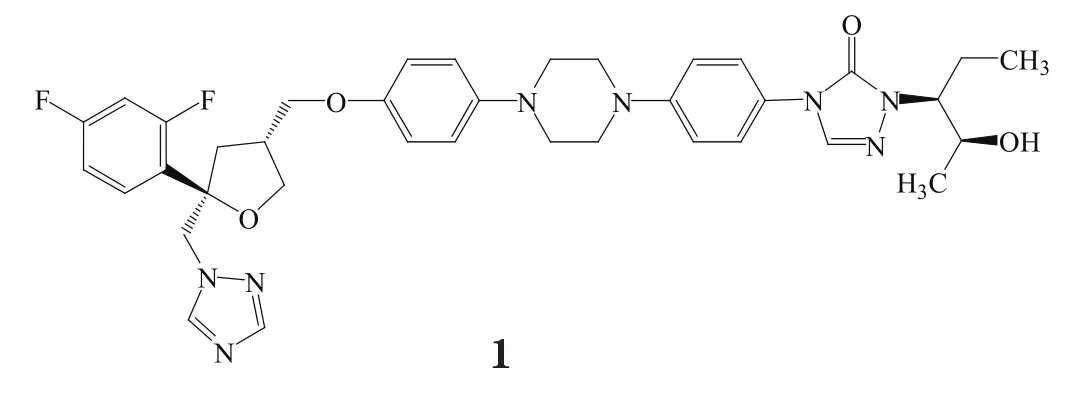
近年来,由于临床上免疫抑制剂、侵袭性置管技术的广泛使用以及HIV病毒感染的持续蔓延,侵袭性真菌病(invasive fungal disease,IFD)在恶性血液病、器官移植、恶性肿瘤以及艾滋病患者中的发病率逐年升高。目前用于治疗IFD的抗真菌药物主要有多烯类、三唑类和棘白菌素类等[1],不同药物针对不同真菌的特异抗菌活性均不相同。泊沙康唑混悬液(posaconazole,商品名诺科飞,1)为第2代三唑类抗真菌新药,由先灵葆雅公司研发[2],2006年获美国FDA批准上市,2013年6月通过中国食品药品监督总局(CFDA)批准[3],其分子式为C37H42F2N8O4,相对分子质量为700.8。
美国FDA批准泊沙康唑口服混悬液主要适用于严重免疫缺陷导致侵袭性念珠菌和曲霉菌感染风险增加的患者,包括接受造血干细胞移植(hematopoietic stem cell transplant,HSCT)后发生移植物抗宿主病(graft-versus-host disease,GVHD)的患者或化疗导致长时间中性粒细胞减少症的血液系统恶性肿瘤患者;还适用于治疗口咽念珠菌病,包括伊曲康唑和/或氟康唑难治性口咽念珠菌病[4]。欧洲药品管理局批准的泊沙康唑适应证包括对于耐药或不耐受其他唑类抗真菌药物和两性霉素B患者的镰刀菌病、着色芽生菌病、球孢子菌病的治疗;重症口咽念珠菌病的一线治疗以及局部治疗;高危HSCT患者IFD的预防用药。此外,现有研究结果表明,泊沙康唑还可用于侵袭性霉菌感染的抢先治疗(如毛霉菌)[5-7]、耐药的地方真菌病(如接合菌感染[8-9])以及儿童患者IFD的抢先或预防治疗[10]。
泊沙康唑的耐受性优于其他唑类抗真菌药物[11],但其口服后生物利用度具有较大个体差异。本文综述了泊沙康唑混悬液的药动学(pharmacokinetic,PK)影响因素、不同患者人群的PK特征和群体药动学(population pharmacokinetics, PPK)特征、药效学/药动学特性(pharmacokinetics/pharmacodynamics,PK/ PD)、治疗药物监测(therapeutic drug monitor,TDM)对临床疗效和不良反应的重要影响,以指导临床个体化用药,增强用药的有效性和安全性。
1 药理作用
泊沙康唑为伊曲康唑的衍生物,与其他三唑类的抗真菌药物作用机制相似,主要通过抑制细胞色素P450依赖的14α-脱甲基酶进而抑制麦角甾醇的合成,导致真菌细胞膜的生物合成障碍,细胞膜通透性改变,从而抑制真菌生长。
体外活性试验表明,泊沙康唑具有广谱抗真菌活性,对曲霉菌属、念珠菌属(包括耐氟康唑的白色念珠菌、光滑念珠菌)、隐球菌属、丝状真菌(包括接合菌、镰刀菌和部分暗色霉)及一些地方真菌(包括球孢子菌、组织胞浆菌和皮炎芽生菌)均具有抗菌活性[1, 10]。研究表明,泊沙康唑对毛霉菌的活性强于其他唑类药物,且与其他抗真菌药物联用时表现出协同作用[10]。
2 药动学特征
2.1健康人群
泊沙康唑为亲脂性药物,其口服生物利用度变异大[12]。一项由103名健康受试者参加的双盲、对照试验结果显示,泊沙康唑口服给药后3~5 h,达峰浓度(Cmax);单剂量(50 ~ 800 mg)和多剂量(50 ~ 400 mg,bid)口服给药时,泊沙康唑的血药浓度与剂量成正比,而单剂量给药超过800 mg或多剂量给药超过400 mg时,血药浓度则不再增加,表明泊沙康唑在健康受试者中的吸收具有饱和性;泊沙康唑(200 mg,bid)口服给药14 d后,健康受试者的平均最大稳态血浆药物浓度为1.753 mg·L-1,24 h平均药时曲线下面积(AUC0-24)为31.106 mg·h·L-1;接受泊沙康唑(400 mg,bid)给药方案的健康受试者的平均最大稳态血浆药物浓度为4.150 mg·L-1,AUC0-24为73.105 mg·h·L-1,多剂量给药后7~10 d达稳态血药浓度[11]。泊沙康唑的表观分布容积为5~25 L·kg-1,表明其在组织中分布广泛[13]。泊沙康唑主要通过UDP葡糖苷酸化进行代谢,是P糖蛋白的底物,且是肝微粒体酶CYP3A4的抑制剂。泊沙康唑与CYP450酶不发生作用,故不受基因型的影响[13]。泊沙康唑的血浆蛋白结合率为98.2%,可穿过血脑屏障,在血浆中主要以母体药物的形式存在。泊沙康唑主要以母体药物(66%)通过粪便排泄(71%),其次通过肾脏排泄(13%)。在健康受试者中其t1/2约为35 h(22~66 h),清除率(CL/F)为32 L·h-1。此外,泊沙康唑在健康受试者中具有良好的安全性和耐受性[14]。
与其他影响因素相比,食物对泊沙康唑的PK影响最大。一项随机、非盲、单中心的研究结果表明,是否服用碳酸饮料、是否高脂饮食、服药与用餐的相对时间、胃液pH、质子泵抑制剂的使用均可影响泊沙康唑PK参数。与空腹服用泊沙康唑相比,伴随碳酸饮料服药时,其Cmax和AUC分别增加92%和70%,而在高的胃液pH环境下,则其Cmax和AUC分别减少46%和32%;与单独服用泊沙康唑400 mg或200 mg相比,与营养液同服,其Cmax和AUC分别增加65%或66%和137%或161%,若在高脂餐前服用泊沙康唑,Cmax和AUC分别增加96%和111%,而在高脂餐中或餐后服用,Cmax和AUC分别增加339%或382%和333%或387%,但同服增加胃动力药时,Cmax和AUC分别减少21%和19%[15]。因此,为更好地发挥泊沙康唑的药效,可与高脂餐、或营养液、或碳酸饮料同服,但应避免与质子泵抑制剂同服。
2.2肝功能不全患者
Moton等[16]对不同肝功能分级患者与肝功能正常患者给予泊沙康唑后的PK参数变化进行了探究,该研究为一项由37名患者(其中肝功能不全患者19名,肝功能正常者18名)参加的单剂量、平行、开放性试验,每位受试者在高脂餐后口服泊沙康唑混悬液400 mg,给药后648 h内采集血样。结果,中度肝功能不全患者的Cmax高于肝功能正常者(0.724 vs 0.517 mg·L-1),重度肝功能不全患者的Cmax低于肝功能正常者(0.403 vs 0.608 mg·L-1);所有肝功能不全患者的Cmax与肝功能正常者相似(0.607 vs 0.605 mg·L-1),但其AUC值较后者高36%;泊沙康唑耐受性较好,肝功能不全患者和肝功正常者的不良反应发生率分别为32%和33%。提示,肝功能不全对于泊沙康唑的药代动力学不存在显著的影响,因此,肝功能不全患者服用泊沙康唑时尚不需要进行剂量调整,但推荐进行TDM。
2.3肾功能不全患者
Hachem等[17]对泊沙康唑在肾功能不全患者中的有效性和安全性进行探究,该研究为一项由330名常规抗真菌难治性或不耐受患者参加的多中心、开放性Ⅲ期试验,其中确诊或临床诊断为IFD的患者有238名,包括65名肾功能不全患者(肌酐清除率< 50 mL·min-1或血清肌酐浓度>20 mg·L-1)和173名肾功能正常患者(肌酐清除率≥50 mL·min-1),所有患者均采取800 mg·d-1、分次给药(200 mg,qid或400 mg,bid)。结果,肾功能不全和肾功能正常患者的治愈率分别为49%和42%;常见不良反应为恶心、血清肌酐水平升高、呕吐、腹痛、头晕。可见,肾功能不全患者与肾功能正常患者的治愈率和不良反应发生率均相似,故在肾功不全患者中泊沙康唑也具有较好的有效性和耐受性。
2.4儿童患者
Krishna等[18]报道了青少年IFD患者服用泊沙康唑的有效性及安全性,该研究是一项由12名青少年患者(≤18岁,平均年龄为12岁)和194名成年患者参加的多中心、非盲Ⅲ期临床试验,所有患者均对常规的抗真菌治疗不耐受或耐药,且均采取800 mg·d-1、分次口服给药。结果,青少年患者和成年患者的平均稳态血浆浓度分别为0.776 mg·L-1(中位值0.579 mg·L-1,范围0.085 3~2.891 mg·L-1)和0.817 mg·L-1(中位值0.626 mg·L-1,范围0~3.710 mg·L-1);青少年患者的不良反应发生率与成年患者相似,43%的患者出现胃肠道副反应,其中最常见的不良反应为恶心、呕吐、腹痛及头痛,2名青少年患者出现了肝功能变化,但均与泊沙康唑的治疗无关。该项研究结果表明,对于难治性的IFD,青少年和成年患者的泊沙康唑血药浓度相似,与不良反应无相关性,推测其疗效也相近。
2.5老年患者
一项含25名年龄≥65岁的老年患者的有关泊沙康唑安全性的18个对照研究结果显示,年龄<65岁和年龄≥65岁的健康受试者服用泊沙康唑(400 mg,bid)后的不良反应发生率分别为57%和64%;肝药酶水平升高的发生率分别为1%(4/424)和12%(3/25);呼吸系统异常的发生率分别为6%(25/424)和24%(6/25)。可见,以上3组数据仅肝药酶水平升高在不同年龄受试者中具有显著性差异,推测老年患者采用泊沙康唑治疗过程中可能存在较大的肝药酶水平升高风险,但停药后肝药酶水平可恢复,故建议在老年患者用药期间应对其肝功能水平进行监测,以防不可逆肝损伤发生[14]。
2.6药物间相互作用
泊沙康唑主要通过UDP葡糖苷酸化(2相酶)进行代谢,且是P糖蛋白泵出作用的底物,因此,该清除途径的抑制剂或诱导剂均可对泊沙康唑的PK产生影响。同时,泊沙康唑也是CYP3A4的强效抑制剂,故泊沙康唑也可增加通过CYP3A4酶代谢药物的血药浓度。泊沙康唑与其他药物的相互作用见表1。

表1 泊沙康唑的药物相互作用Table 1 Drug interactions of posaconazole
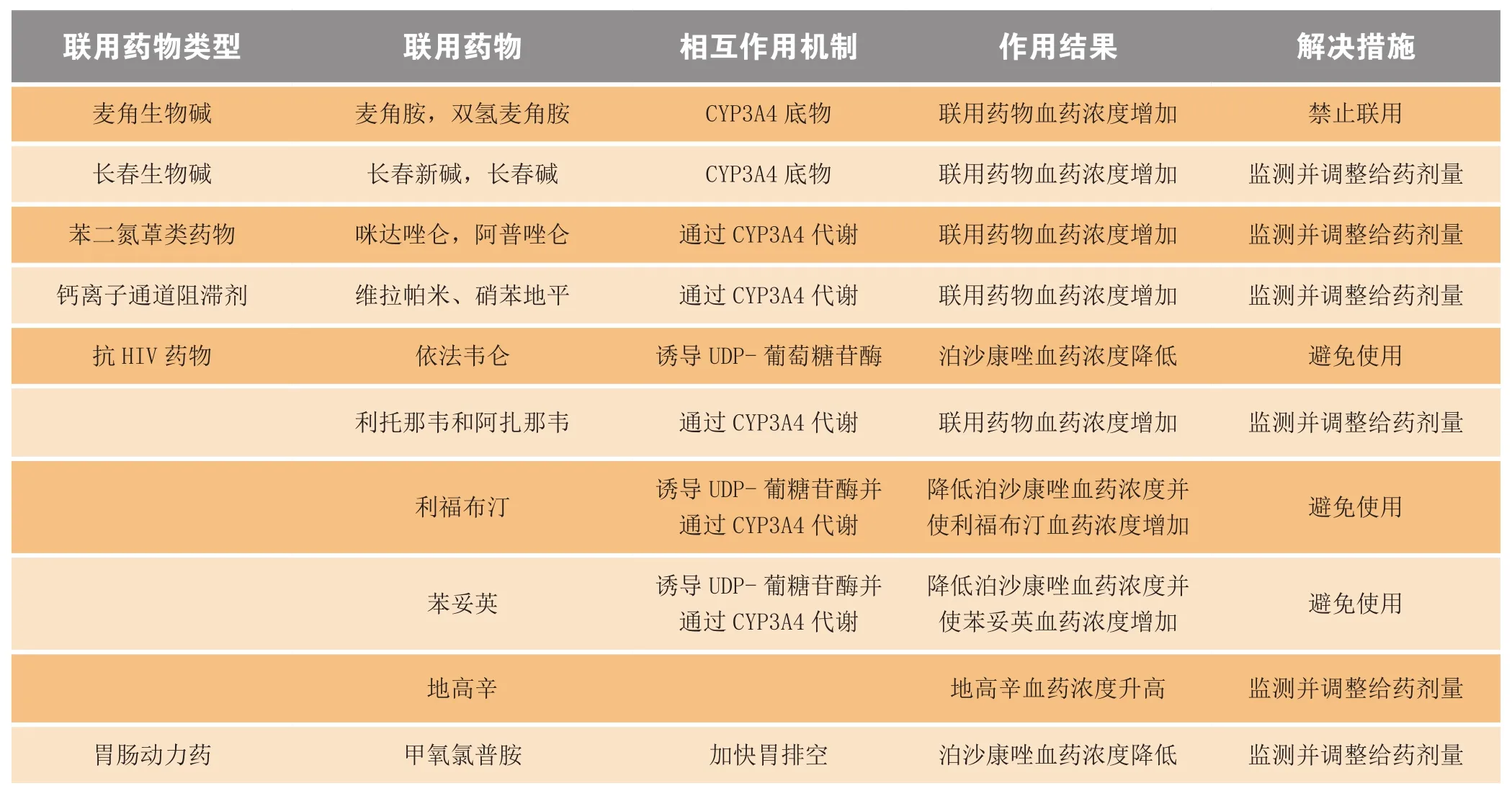
续表1
3 群体药动学
泊沙康唑口服给药生物利用度的个体差异较大,导致患者PK参数的差异进而影响药效的发挥,因此需要在患者人群中进行PPK研究,以探索泊沙康唑药动学特征并找出影响药动学参数变化的关键因素。Dolton等[12]应用PPK模型对泊沙康唑的PK特征及其影响因素进行了探索,该项研究共纳入102名受试者,其中包括82名使用泊沙康唑预防IFD的患者和20名健康志愿者。通过NONMEM软件对905个血样分析结果显示,一级吸收和一级消除的一房室模型能较好地拟合数据;患者的口服生物利用度为55%,较健康志愿者相比偏低;联合使用质子泵抑制剂、甲氧氯普胺以及发生黏膜炎和腹泻时泊沙康唑的生物利用度分别减少45%、35%、58%和45%;与营养液同服可显著增加泊沙康唑的生物利用度(120%);联合使用利福平或苯妥英可增加其清除率达600%以上,联合使用福沙那韦可使其清除率增加34%;年龄、体质量、性别对泊沙康唑的PK参数并无显著影响。Vehreschild等[19]也采用PPK模型探索了泊沙康唑PK的影响因素,共纳入84名使用泊沙康唑进行IFD预防的急性粒细胞白血病或骨髓增生异常综合征患者,采集血样643个。该项研究结果表明,一级吸收和一级消除的一房室模型能较好地拟合PK数据;清除率为56.8 L·h-1(95% CI 为52.8~60.8 L·h-1),表观分布容积为2 130 L(95% CI为1 646~2 614 L)。对各协变量分析后发现,体质量、腹泻以及联合用药(如化疗药物和泮托拉唑)对泊沙康唑暴露量具有显著影响,建议在对患者TDM前考虑相关协变量(如腹泻、化疗药物和质子泵抑制剂的使用)的影响,合理调整泊沙康唑起始给药剂量,以实现预期疗效。Kohl等[20]利用PPK模型研究了泊沙康唑在HSCT患者预防用药过程中PK的影响因素,该研究共采集了32名患者的149个血样,同样也选用NONMEM程序。结果表明,一级吸收和一级消除的一房室模型能较好地拟合PK数据;表观清除率为75.8 L·h-1(95% CI为65.2~86.4 L·h-1),表观分布容积为835 L(95% CI为559~1 111 L)。对各协变量分析后发现,年龄和腹泻对泊沙康唑暴露量具有显著影响,建议根据患者个体年龄和腹泻发生情况在获得TDM结果前合理调整泊沙康唑起始剂量,以达到更好的疗效。
4 药动学/药效学特性
与其他三唑类药物相似,对泊沙康唑PK/PD与疗效关系的探索将有助于优化给药方案,以增加疗效、降低毒副作用。有研究表明,游离药物的AUC0-24/MIC比值可作为泊沙康唑疗效的预测指标,游离药物浓度越高,药效越强;在11种不同白色念珠菌感染的小鼠模型中,泊沙康唑的AUC0-24/MIC比值相似(6.12~26.7,±s=16.9±7.8,P = 0.42)[21]。Li等[13]对白色念珠菌感染模型的研究结果表明,泊沙康唑PK/PD评价参数同样选择游离药物的AUC0-24/MIC比值,且得出其推荐靶值为17,与其他三唑类药物研究结果相似。
5 治疗药物监测
5.1治疗药物监测对疗效和不良反应的影响
目前临床上由于泊沙康唑亚治疗浓度而导致治疗失败的病例并不少见,且患者自身病理生理状况的不同和联合用药等因素均对泊沙康唑的血药浓度产生影响,多个研究也报道了泊沙康唑进行TDM的条件及其治疗窗[22-29]。Howard等[22]对泊沙康唑的暴露量与反应关系研究后发现,高暴露量有助于达到更好疗效。有研究则提出,亚治疗浓度的广泛出现并没有引起一线预防曲霉菌的失败率增高,可能是由于效应器细胞的优先摄取,但对于IFD高危患者,仍有必要利用TDM调整影响暴露量的可变因素(如低口服生物利用度、溶解度差、药物相互作用、胃肠疾病等)并进一步优化给药方案[24]。TDM不仅可使患者快速达到疗效,还可鉴别是否持续处于亚治疗浓度或随剂量增加表现出耐药,通过调整给药剂量或更换治疗药物最终达到更好的疗效。Lefeuvre 等[23]的研究结果也推荐对泊沙康唑进行TDM,并总结得出在IFD治疗过程中可选择泊沙康唑谷浓度值在0.5~1.5 mg·L-1为治疗靶标,在IFD预防过程中可选择0.5 mg·L-1作为最小预防浓度。越来越多的证据表明,泊沙康唑存在暴露量与反应的相关性,且随泊沙康唑暴露量的增加其临床疗效也逐渐提高。目前临床上泊沙康唑处于亚治疗浓度的发生率较高,故开展TDM对于泊沙康唑的合理用药尤为重要。对于出现泊沙康唑亚治疗浓度情况时,可通过增加剂量、与高脂肪食物同服以及避免合用与其相互作用的药物来促进吸收[25]。
泊沙康唑引起的严重不良反应主要包括过敏反应、尖端扭转型室性心动过速、QT间期延长、肝毒性等[30],常见不良反应有恶心、呕吐[31]。但据文献报道,目前泊沙康唑的血药浓素与毒性关系尚不明确[25],且多项研究表明泊沙康唑具有良好的耐受性[32-34]。
5.2对不同患者的泊沙康唑治疗监测
5.2.1造血干细胞移植后发生移植物抗宿主病的患者Jang 等[35]对两项由252名HSCT后发生GVHD的患者参与的泊沙康唑预防IFD的双盲、随机、对照临床研究进行了meta分析。结果显示,患者接受泊沙康唑(200 mg,tid)治疗后,其平均稳态浓度(Cavg)范围为0.022~3.650 mg·L-1,其Cavg的四分位值和中位值分别在0.289、0.736、1.239和2.607 mg·L-1时对应的治疗失败率为44%、21%、18%和18%,该项研究结果表明,随Cavg值的增加,治疗失败率降低;Cavg与泊沙康唑有关的严重不良反应无显著相关性;临床推荐泊沙康唑在HSCT后发生GVHD中预防用药所达Cavg靶值应大于0.7 mg·L-1。故测定泊沙康唑的血药浓度有助于调整给药剂量或是否更换药物,从而提高预防IFD的疗效。
5.2.2急性粒细胞白血病和骨髓增生异常综合征患者Cornely等[36]对泊沙康唑在因急性粒细胞白血病或骨髓增生异常综合征接受化疗所致的中性粒细胞减少症患者中预防IFD的有效性和安全性进行了研究,结果显示,215名受试者接受泊沙康唑(200 mg,tid)治疗后,其Cavg为0.202~0.964 mg·L-1,且随Cavg值的增加,治疗的失败率降低,推荐IFD的泊沙康唑预防用药所达Cavg靶值应大于0.7 mg·L-1。
5.2.3恶性血液病患者一项由63名恶性血液病患者参加的泊沙康唑TDM研究中,受试者接受泊沙康唑(200 mg,tid)治疗后,分别于2、7、10、14和21d取血检测。结果显示,受试者的平均血药浓度为0.42~0.48 mg·L-1,其个体内差异为66.5%,个体间差异为33.5%;仅1例患者因血药浓度偏低而被诊断出IFD;血药浓度不受年龄、性别、体质量、剂量、黏膜炎、质子泵抑制剂的影响,但食物对泊沙康唑血药浓度具有显著影响(P = 0.004 9)。该项研究结果表明,泊沙康唑不良反应发生率低,对于恶性血液病患者的耐受性良好[37]。在另一项由54名患者(其中恶性血液病患者占69%)参与的泊沙康唑用于预防和治疗IFD的单中心研究中,受试者分为预防组(n = 36,200 mg,tid)和治疗组(n = 18,400 mg,bid),同时低泊沙康唑血浆药物浓度(plasma posaconazole concentration,PPC)定义为PPC < 0.5 mg·L-1。结果,预防组和治疗组低PPC的发生率分别为44%(16/36)和22%(4/18),且预防组中低PPC多发于消化系统疾病、腹泻和黏膜炎患者,而治疗组中低PPC多发于腹泻患者;仅2名受试者发生了肝毒性,且与泊沙康唑高PPC无关[38]。提示,对于患有恶性血液病的免疫缺陷患者,在其发生胃肠功能紊乱时应实施TDM以纠正其低PPC,更好地发挥泊沙康唑的疗效。
综上所述,在不同患者群体中,泊沙康唑均具有较好的安全性与有效性,特别是对侵袭性曲霉菌与念珠菌病的预防以及难治性口咽念珠菌病的治疗。目前对泊沙康唑PK/PD与临床疗效之间关系的研究非常有限,且仅限于动物试验研究,未来仍需进一步开展相关临床研究工作,以期指导个体化用药,保证临床用药的有效性和安全性。
[参 考 文 献]
[1]Aperis G, Alivanis P. Posaconazole: a new antifungal weapon[J]. Rev Recent Clin Trials, 2011, 6(3): 204-219.
[2]Krishna G, Martinho M, Chandrasekar P, et al. Pharmacokinetics of oral posaconazole in allogeneic hematopoietic stem cell transplant recipients with graft-versus-host disease[J]. Pharmacotherapy, 2007, 27(12): 1627-1636.
[3]梅丹, 梅隆, 刘梅, 等. 泊沙康唑的药动和药效学评价[J]. 临床药物治疗杂志, 2014, 12(3): 15-22.
[4]Nagappan V, Deresinski S. Reviews of anti-infective agents: posaconazole: a broad-spectrum triazole antifungal agent[J]. Clin Infect Dis, 2007, 45(12): 1610-1617.
[5]Enoch D A, Aliyu S H, Sule O, et al. Posaconazole for the treatment of mucormycosis[J]. Int J Antimicrob Agents, 2011, 38(6): 465-473.
[6]Vehreschild J J, Birtel A, Vehreschild M J, et al. Mucormycosis treated with posaconazole: review of 96 case reports[J]. Crit Rev Microbiol, 2013, 39(3): 310-324.
[7]Lin S Y, Lu P L, Tsai K B, et al. A mucormycosis case in a cirrhotic patient successfully treated with posaconazole and review of published literature[J]. Mycopathologia, 2012, 174(5/6): 499-504.
[8]Maskari Z A, Lawatia F A. Postrenal transplant renopulmonary zygomycosis with vascular aneurysms responded to surgical treatment and salvage therapy with posaconazole after failure to respond to liposomal amphotericin[J]. Am J Case Rep, 2012, 13: 202-205.
[9]Saoulidis S, Simitsopoulou M, Dalakiouridou M, et al. Antifungal activity of posaconazole and granulocyte colony-stimulating factor in the treatment of disseminated zygomycosis (mucormycosis) in a neutropaenic murine model[J]. Mycoses, 2011, 54(5): e486- e492.
[10]Clark N M, Grim S A, Lynch J P 3rd. Posaconazole: use in the prophylaxis and treatment of fungal infections[J]. Semin Respir Crit Care Med, 2015, 36(5): 767-785.
[11]Courtney R, Pai S, Laughlin M, et al. Pharmacokinetics, safety, and tolerability of oral posaconazole administered in single and multiple doses in healthy adults[J]. Antimicrob Agents Chemother, 2003, 47(9): 2788-2795.
[12]Dolton M J, Bruggemann R J, Burger D M, et al. Understanding variability in posaconazole exposure using an integrated population pharmacokinetic analysis[J]. Antimicrob Agents Chemother, 2014, 58(11): 6879-6885.
[13]Li Y, Theuretzbacher U, Clancy C J, et al. Pharmacokinetic/ pharmacodynamic profile of posaconazole[J]. Clin Pharmacokinet, 2010, 49(6): 379-396.
[14]Moton A, Krishna G, Wang Z. Tolerability and safety profile of posaconazole: evaluation of 18 controlled studies in healthy volunteers[J]. J Clin Pharm Ther, 2009, 34(3): 301-311.
[15]Krishna G, Moton A, Ma L, et al. Pharmacokinetics and absorption of posaconazole oral suspension under various gastric conditions in healthy volunteers[J]. Antimicrob Agents Chemother, 2009, 53(3): 958-966.
[16]Moton A, Krishna G, Ma L, et al. Pharmacokinetics of a single dose of the antifungal posaconazole as oral suspension in subjects with hepatic impairment[J]. Curr Med Res Opin, 2010, 26(1): 1-7.
[17]Hachem R Y, Langston A A, Graybill J R, et al. Posaconazole as salvage treatment of invasive fungal infections in patients with underlying renal impairment[J]. J Antimicrob Chemother, 2008, 62(6): 1386-1391.
[18]Krishna G, Sansone-Parsons A, Martinho M, et al. Posaconazole plasma concentrations in juvenile patients with invasive fungal infection[J]. Antimicrob Agents Chemother, 2007, 51(3): 812-818.
[19]Vehreschild J J, Muller C, Farowski F, et al. Factors influencing the pharmacokinetics of prophylactic posaconazole oral suspension in patients with acute myeloid leukemia or myelodysplastic syndrome[J]. Eur J Clin Pharmacol, 2012, 68(6): 987-995.
[20]Kohl V, Muller C, Cornely O A, et al. Factors influencing pharmacokinetics of prophylactic posaconazole in patients undergoing allogeneic stem cell transplantation[J]. Antimicrob Agents Chemother, 2010, 54(1): 207-212.
[21]Andes D, Marchillo K, Conklin R, et al. Pharmacodynamics of a new triazole, posaconazole, in a murine model of disseminated candidiasis[J]. Antimicrob Agents Chemother, 2004, 48(1): 137-142.
[22]Howard S J, Felton T W, Gomez-Lopez A, et al. Posaconazole: the case for therapeutic drug monitoring[J]. Ther Drug Monit, 2012, 34(1): 72-76.
[23]Lefeuvre S, Jelassi M L, Benlmouden A, et al. Level of evidence for therapeutic drug monitoring of posaconazole [J]. Therapie, 2011, 66(2): 115-122.
[24]Ananda-Rajah M R, Grigg A, Slavin M A. Making sense of posaconazole therapeutic drug monitoring: a practical approach[J]. Curr Opin Infect Dis, 2012, 25(6): 605-611.
[25]Dolton M J, Ray J E, Marriott D, et al. Posaconazole exposure-response relationship: evaluating the utility of therapeutic drug monitoring[J]. Antimicrob Agents Chemother, 2012, 56(6): 2806-2813.
[26]Gross B N, Ihorst G, Jung M, et al. Posaconazole therapeutic drug monitoring in the real-life setting: a single-center experience and review of the literature[J]. Pharmacotherapy, 2013, 33(10): 1117-1125.
[27]Hussaini T, Ruping M J, Farowski F, et al. Therapeutic drug monitoring of voriconazole and posaconazole[J]. Pharmacotherapy, 2011, 31(2): 214-225.
[28]Seyedmousavi S, Mouton J W, Verweij P E, et al. Therapeutic drug monitoring of voriconazole and posaconazole for invasive aspergillosis[J]. Expert Rev Anti Infect Ther, 2013, 11(9): 931-941.
[29]Bernardo V A, Cross S J, Crews K R, et al. Posaconazole therapeutic drug monitoring in pediatric patients and young adults with cancer[J]. Ann Pharmacother, 2013, 47(7/8): 976-983.
[30]Poluzzi E, Raschi E, Motola D, et al. Antimicrobials and the risk of torsades de pointes: the contribution from data mining of the US FDA Adverse Event Reporting System[J]. Drug Saf, 2010, 33(4): 303-314.
[31]Raad I I, Graybill J R, Bustamante A B, et al. Safety of long-term oral posaconazole use in the treatment of refractory invasive fungal infections[J]. Clin Infect Dis, 2006, 42(12): 1726-1734.
[32]Shen Y, Huang X J, Wang J X, et al. Posaconazole vs. fluconazole as invasive fungal infection prophylaxis in China: a multicenter, randomized, open-label study[J]. Int J Clin Pharmacol Ther, 2013, 51(9): 738-745.
[33]Fügi M A, Kaiser M, Tanner M, et al. Match-making for posaconazole through systems thinking[J]. Trends Parasitol, 2015, 31(2): 46-51.
[34]Maertens J, Cornely O A, Ullmannk A J, et al. Phase 1B study of the pharmacokinetics and safety of posaconazole intravenous solution in patients at risk for invasive fungal disease[J]. Antimicrob Agents Chemother, 2014, 58(7): 3610-3617.
[35]Jang S H, Colangelo P M, Gobburu J V. Exposure-response of posaconazole used for prophylaxis against invasive fungal infections: evaluating the need to adjust doses based on drug concentrations in plasma[J]. Clin Pharmacol Ther, 2010, 88(1): 115-119.
[36]Cornely O A, Maertens J, Winston D J, et al. Posaconazole vs. fluconazole or itraconazole prophylaxis in patients with neutropenia[J]. N Engl J Med, 2007, 356(4): 348-359.
[37]Eiden C, Meniane J C, Peyrière H, et al. Therapeutic drug monitoring of posaconazole in hematology adults under posaconazole prophylaxis: influence of food intake[J]. Eur J Clin Microbiol Infect Dis, 2012, 31(2): 161-167.
[38]Lebeaux D, Lanternier F, Elie C, et al. Therapeutic drug monitoring of posaconazole: a monocentric study with 54 adults[J]. Antimicrob Agents Chemother, 2009, 53(12): 5224-5229.

[专家介绍]董亚琳:毕业于西安交通大学,生物化学与分子生物学博士,主任药师,教授,博士生导师。1989年开始在西安交通大学第一附属医院药剂科工作,曾担任药学部主任(2004—2015年),现任药学学科带头人。曾获第十三届吴阶平-保罗杨森医学药学研究奖、中国药学会“优秀药师”、中国药学会“优秀领导力奖”、2015年陕西省五一巾帼标兵。
主要研究方向包括乳腺癌耐药机制及其逆转研究以及抗菌药物在危重症患者中个体化用药研究。共主持国家自然科学基金2项、参与及指导6项;主持国家“十一五”、“十二五”科技支撑计划子课题3项,主持及参与省级项目8项。参编卫生部“十二五”规划教材5部,主编3部,主译、参编专著18部;发表科研论文162篇,其中44篇被SCI收录。指导博士后2人、博士研究生16人、硕士研究生23人。
*通讯作者:董亚琳,主任药师,博士生导师;
[中图分类号]R978.5;R969
[文献标志码]A
[文章编号]1001-5094(2015)11-0810-07

