鲤春病毒血症病毒SYBR Green I 荧光定量RT-PCR 方法的建立
安 伟,肖 雨,张明辉,高晓华,何正侃
(上海市水产研究所 上海市水产技术推广站,上海 200433)
鲤春病毒血症(Spring viraemia of carp,SVC)病原为SVC 病毒(SVCV),是一种存在于鲤科鱼类的高传染性病毒性疾病,严重危害了鲤科鱼类相关产业的发展[1]。世界动物卫生组织(OIE)已将SVC 列为必报的重要疾病之一,2008 年《中华人民共和国进境动物一、二类传染病、寄生虫病名录》将其认定为一类动物疫病。
SVCV 由Fijian 等首次分离出来[2],属于弹状病毒科,水泡口炎病毒属;其病毒基因组为单股负链线性RNA,基因组RNA 为11 019 nt;病毒粒子呈典型子弹状,长80 nm~180 nm,宽60 nm~90 nm[3]。1998 年,英国从北京进口的锦鲤中检测出SVCV[4],给我国水产品出口造成了严重的经济损失。因此对养殖场中的SVC 的监测工作尤为重要,近年来SVCV 的检测技术也成为研究热点。本研究针对SVCV N 基因保守区域设计特异性引物,建立了SYBR Green I 荧光定量RT-PCR 检测方法,为SVCV的防制提供有效的技术支撑。
1 材料和方法
1.1 病毒株 SVCV 由深圳出入境检疫局动植物实验室提供;草鱼呼肠孤病毒(GCRV)由长江水产研究所提供;传染性脾肾坏死病毒(ISKNV)由上海海洋大学提供;对虾白班综合征病毒(WSSV)和传染性皮下及组织坏死病毒(IHHNV)由黄海水产研究所提供。
1.2 主要试剂 Ex Taq DNA 聚合酶、PCR 反应试剂、SYBR GreenI 试剂盒、pMD18-T 载体、RNA/DNA 提取试剂盒及PrimeScript 1st Strand cDNA Synthesis Kit 均购自TaKaRa 公司;PCR 产物回收以及质粒抽提试剂盒购自Axygen 公司。
1.3 引物的设计与合成 参考GenBank 中SVCV基因组中N 蛋白编码基因的序列(AAK60421),应用PrimerExpress 软件设计引物:5'-TCTGCCAAATCA CCATACTCA-3'/5'-CTGTCTTGCGTTCAGTGCTC-3',预期扩增目的片段为135 bp,由上海生工生物工程技术服务有限公司合成。
1.4 重组质粒标准品的制备 按照RNAiso 说明书提取SVCV 悬液中的总RNA,反转录制备cDNA 为模板,扩增目的基因。PCR 产物经回收克隆于pMD18-T 载体中,构建重组质粒,并由上海生工生物工程技术服务有限公司测序。阳性重组质粒命名为pMD-N,测定其浓度,并按照公式:拷贝数(拷贝/μL)=6.02×1023×质粒浓度(g/μL)/质粒分子量(g/mol)计算其拷贝数。将其按10 倍梯度稀释,作为重组质粒标准品。
1.5 荧光定量RT-PCR 标准曲线的建立 将pMD-N 标准品10 倍倍比稀释6 个浓度梯度(1.3×102拷贝/μL~1.3×108拷贝/μL),参照SYBR Primix Ex Taq 试剂盒20 μL 体系,对引物浓度以及从退火温度(56 ℃~66 ℃)进行筛选。选用最佳优化条件进行荧光定量PCR 扩增,并绘制标准曲线。
1.6 特异性试验 以SVCV、GCRV、ISKNV、WSSV 和IHHNV 的cDNA 或DNA 为模板,利用建立的荧光定量RT-PCR 方法进行检测,同时设置阴性对照。
1.7 敏感性试验 将含有SVCV 的细胞病毒培养液(104.76TCID50/mL)进行10 倍梯度稀释6 个梯度,各取100 μL,采用病毒核酸提取试剂盒提取RNA,cDNA 合成后按照优化的条件进行荧光定量RT-PCR检测,同时进行常规RT-PCR 检测实验,比较其灵敏度。
1.8 重复性试验 将pMD-N 标准品分为3 个不同的浓度和批次,进行批内和批间的试验测定,同时设空白对照。计算其批内和批间的变异系数。
1.9 临床样品检测 采用建立的荧光定量RT-PCR检测方法对从养殖场采集的24 份样品进行检测,并与常规RT-PCR 方法进行比较。
2 结果
2.1 重组质粒标准品的制备 以SVCV 提取的RNA 制备的cDNA 为模板,通过引物扩增N 基因DNA 片段,构建重组质粒pMD-N。经PCR 扩增鉴定,目的片段为135 bp,与预期的目的片段一致(图1)。测序后的比对结果与GenBank 中SVCV N 基因序列(AAK60421)相符,表明N 基因片段正确克隆于pMD18-T 载体中。测得重组质粒浓度为45.95 ng/μL,换算为拷贝数为1.3×1010拷贝/μL。
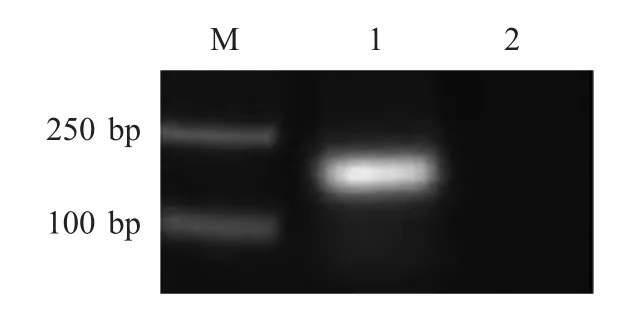
图1 重组质粒的鉴定Fig.1 Identification of the recombinant plasmid
2.2 荧光定量RT-PCR 标准曲线图的建立 经优化荧光定量RT-PCR 最佳反应体系为20 μL:SYBR Premix Ex Taq(2×)10 μL,上、下游引物(10 μmol/L)0.4 μL,荧光染料(50×)0.4 μL,Rox 为0.4 μL,模板1 μL,灭菌水7.3 μL。最佳反应程序:95 ℃30 s;95 ℃5 s,62 ℃40 s,40 个循环。
以10 倍倍比稀释重组质粒标准品pMD-N 为模板进行荧光定量PCR 扩增,由7500 Software v2.0软件自动得到相应的溶解曲线和标准曲线(图2),溶解曲线表现为峰值单一,溶解温度Tm 为85.8 ℃~86 ℃。标准曲线中Ct 值与重组质粒标准品呈良好的线性关系,曲线方程为y=-3.207x+32.2733。R2=0.99,E=105.044 %。
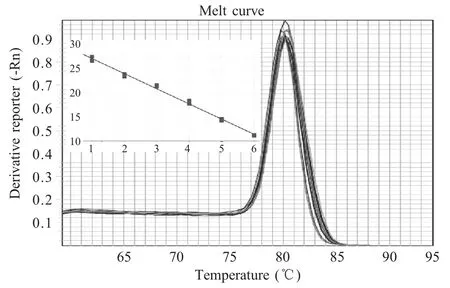
图2 荧光定量PCR 标准曲线及溶解曲线Fig.2 The standard and melting curve of real-time RT-PCR
2.3 特异性试验结果 采用建立的荧光定量RTPCR 方法对不同的病毒核酸进行检测。结果显示,仅SVCV 核酸有扩增曲线,即为阳性样品。而GCRV、ISKNV、WSSV、IHHNV 和空白对照均为阴性,表明该方法特异性良好。
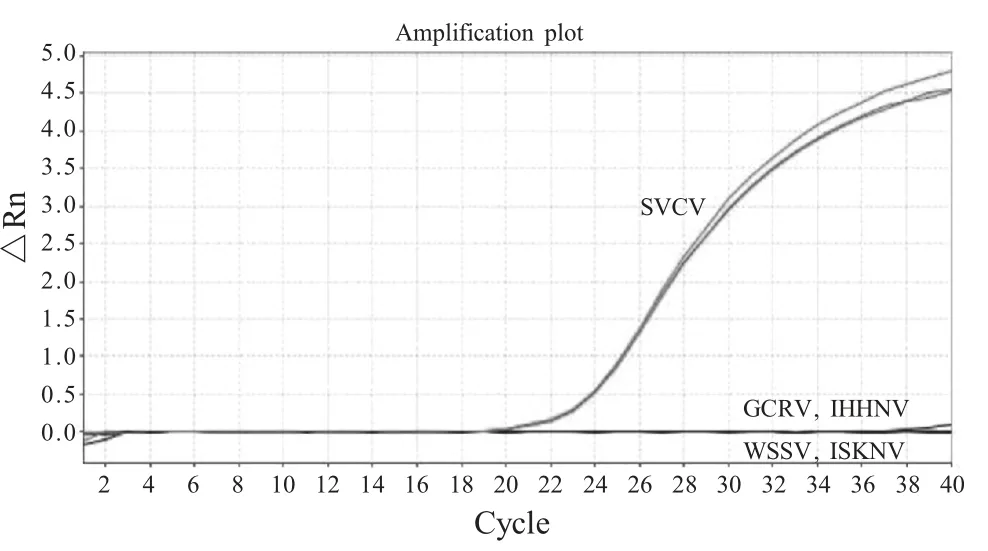
图3 荧光定量RT-PCR 特异性试验结果Fig.3 Specificity test of the real-time RT-PCR for SVCV
2.4 敏感性试验结果 对SVCV 的6 个稀释度样品所提取得病毒核酸进行检测,结果显示,荧光定量RT-PCR 检测方法在104.76TCID50/mL~100.76TCID50/mL 5 个浓度的样品中有效扩增,10-0.76TCID50/mL 和空白对照为无效扩增,而常规PCR 在102.76TCID50/mL 样品中仅显示弱阳性,表明荧光定量RT-PCR 比常规RT-PCR 方法敏感100 倍(图4)。
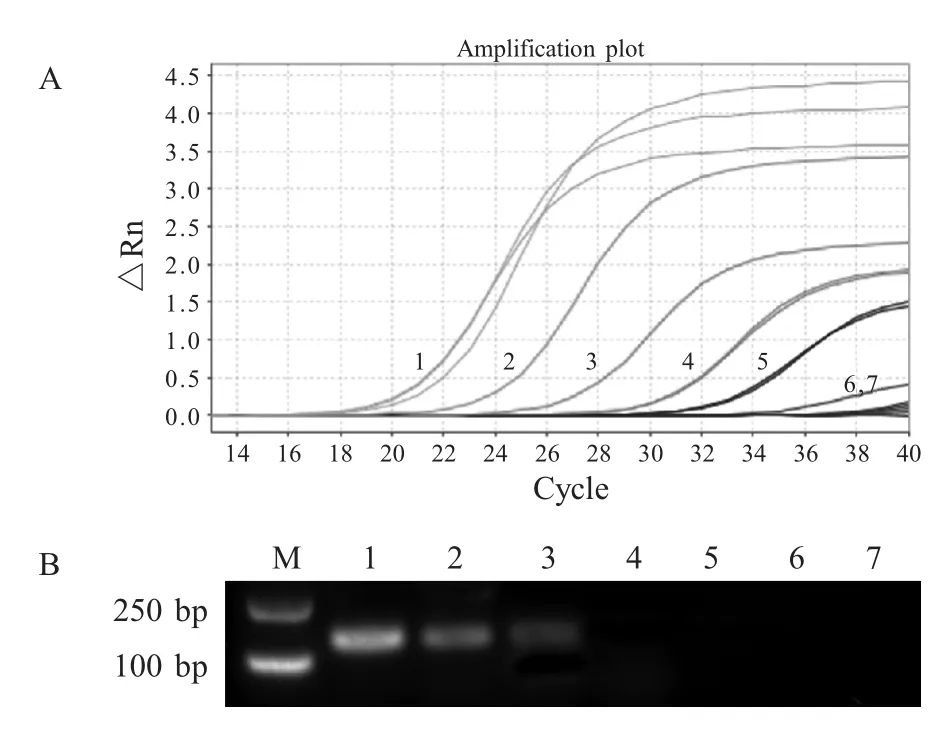
图4 荧光定量RT-PCR 敏感性试验结果Fig.4 Sensitivity of real-time RT-PCR(A)and conventional RT-PCR(B)
2.5 重复性试验结果 对1.3×105,1.3×107以及1.3×108拷贝/μL 3 个浓度的标准品质粒分别进行批内和批间重复性试验,结果数据经相关软件分析显示,批内Ct 变异系数小于4.2 %,批间变异系数小于7.6 %(表1),表明重复性良好。
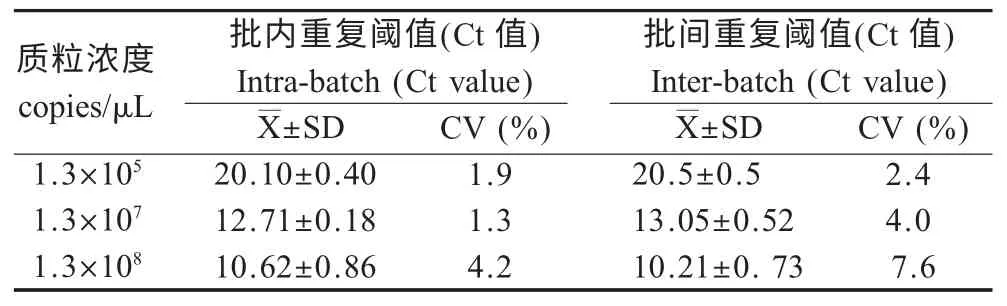
表1 荧光定量RT-PCR 检测SVCV 批内及批间重复试验结果Table 1 Intra-and inter-batch reproducibility of real-time RT-PCR assay for SVCV
2.6 临床样品的检测结果 采用建立的荧光定量RT-PCR 检测方法对从养殖场采集的24 份样品进行检测,并与常规RT-PCR 方法比较。结果显示,荧光定量RT-PCR 和常规RT-PCR 均检出4 份阳性样品,二者符合率为100%。表明本实验建立的方法可以用于SVCV 临床检测。
3 讨论
目前对SVCV 的检测有细胞培养分离病毒、酶联免疫法、免疫荧光、中和试验RT-PCR 等方法[5-6],但这些方法无法在短时间内精准的检测出低感染量的病毒粒子的样本。而荧光定量RT-PCR 具有全封闭的反应,自动化程度高,无需电泳,不使用EB等优点。从核酸提取到检测完成只需2 h~3 h,并且同批反应最多可对96 个样品检测,大大提高了检测效率,非常适合在短时间内完成大量样品的病原检测及检疫任务。该方法采用染料SYBR Green I 具有高灵敏性和特异性,降低了实验成本[7-8]。
SVCV 主要有5 个结构蛋白,其中针对G 蛋白的研究报道比较多,而有研究显示G 蛋白在不同病毒株间基因序列存在一定差异,采用G 蛋白的检测方法可能存在漏检现象[9]。而N 蛋白为SVCV 中比例最高的蛋白,在病毒的转录和复制中发挥重要的作用,而且具有高度的保守性,因此本研究选择N蛋白保守序列建立了SYBR Green I 荧光定量RTPCR 检测方法。通过优化整个反应体系各项条件,重组质粒标准品的各个浓度模板(1.3×102拷贝/μL~1.3×106拷贝/μL)的荧光定量RT-PCR 的反应均出现“S”型动力学曲线,满足荧光定量RT-PCR 扩增的指数增长,线性增长以及平台期3 个阶段,并且各个梯度间指数增长期平行,反应各浓度的扩增效率相近,符合荧光定量RT-PCR 的拷贝数与Ct 值得线性关系,直线回归相关系数达到0.99,并且溶解曲线峰窄而单一。经试验该方法特异性强、敏感性高、重复性良好,适用于大批量的病原样品的检测。
本研究建立的检测SVCV 的荧光定量RT-PCR方法不仅可以对SVCV 进行早期监测,而且有利于分析病态下SVCV 的动态变化,为SVCV 的感染机制研究提供重要参考。
[1]付峰,刘荭,黄絰,等.鲤春病毒血症病毒(SVCV)的研究进展[J].中国水产科学,2006,13(2):328-334.
[2]Fijian N,Petrinec Z,Sulimanovic D,et al.Isolation of the virus causative agent from the acute form of infectious dropsy of carp[J].Vet Arh,1971,41:125-138
[3]Walker P J,Benmansour A,Calisher C H,et al.Family Rhabdoviridae[A].San Diego:Academic Press,2000.
[4]Stone D M,Ahne W,Denham K L,et al.Nucleotide sequence analysis of the glycoprotein gene of putative spring viremia of carp virus and pike fry rhabdovirus isolates reveals four genogroups[J].Dis Aqut Org,2003,5:203-210.
[5]高隆英,史秀杰,刘荭,等.用RT-PCR 快速检测鲤春病毒血症病毒基因[J].水生生物学报,2002,26(5):452-456.
[6]张朋,刘荭,陈孝萱,等.鲤春病毒血症病毒单克隆抗体的制备及其特性鉴定[J].中国预防兽医学报,2011,33(4):305-308.
[7]周勇,曾令兵,张辉,等.鲤疱疹病毒Ⅱ型Taq Man realtime PCR 检测方法的建立及应用[J].水产学报,2013,37(4):607-613.
[8]胡月,威亭,胡哲,等.马动脉炎病毒Eva Green 荧光定量RT-PCR 检测方法的建立及初步应用[J].中国预防兽医学报,2014,36(12):943-947.
[9]耿波,孙效文,牟振波,等.鲤春病毒糖蛋白(G)基因的分离及同源性比较[J].生物技术通报,2006,增刊:450-454.

