水霉菌生物膜体外模型构建及结构特征
俞 军,袁海兰,欧仁建,胡 鲲,杨先乐
(1.上海海洋大学 国家水生动物病原库,上海 201306;2.成都市龙泉驿区水务局,四川 成都 610100)
水霉菌(Saprolegnia)为一种广泛存在于淡水水域中的条件致病真菌,对温度的适应范围广,一年四季均可发生[1]。水霉菌对寄主无严格选择性,能够感染天然或人工养殖的鱼体或鱼卵而暴发水霉病,严重危害水产养殖业的健康发展。
目前,一般认为几乎所有致病菌均能够形成生物膜(Biofilm,BF)[2]。BF 是一种附着于生物或非生物表面、包裹着由其自身产生的细胞外多聚基质(ECM)、具有三维结构的菌细胞群体。微生物可以在浮游细胞和多细胞群落两种形态之间相互转化,BF 为菌体提供庇护场所,并成为持续感染源[3]。现已证实多种致病真菌可以形成与细菌BF 相类似的BF,而且BF 的形成对真菌的环境适应能力、药物敏感性等影响较大。2013 年,Ali 首次报道了水霉菌可以形成BF,并在BF 中大量存活(即使在施用有效的药物后),从而对水产动物构成持续的感染[4]。因此,对水霉菌致病性的深入研究及防治水霉病药物的开发具有十分重要的意义。
玻片常作为体外构建细菌、真菌BF 的粘附基质;在人类致病菌BF 形成的研究中发现,致病菌往往会附于留置医疗器械表面,形成BF 结构,引起导管和医疗植入物相关医源性感染[2],BF 体外构建也常常采用这些材料作为基质,而聚乙烯网片则是作为黏性卵粘附载体广泛用于鱼卵孵化生产中。因此本研究采用这两种材料建立了水霉菌BF 体外模型,并分析其形成过程及结构特征,为水霉菌BF的进一步研究奠定基础。
1 材料和方法
1.1 菌 株 寄生水霉(Saprolegnia parasitica)ATCC200013(1990 年分离自日本神奈川患水霉病的虹鳟)购自美国典型微生物菌种保藏中心(ATCC)。
1.2 主要试剂 马铃薯葡萄糖琼脂(PDA)购自国药集团化学试剂有限公司;沙氏葡萄糖液体培养基购自杭州天和微生物试剂有限公司;细胞计数试剂盒CCK-8 购自碧云天生物技术研究所;荧光染色剂Calcofluor White M2R Tinopal UNPA-GX 购自Sigma公司;荧光DNA 染料L34952LIVE/DEAD®Funga-LightTMYeast Viability Kit(SYTO 9/PI)购自Invitrogen公司。
1.3 水霉菌孢子悬液的制备 将菌种接种于PDA平皿上,20 ℃活化[5]。在平皿上铺满油菜籽,待菌丝长上菜籽,将菜籽移至灭菌蒸馏水中。20 ℃培养48 h,待游动孢子大量产生后,以3 层灭菌纱布过滤弃去油菜籽,离心收集水霉菌孢子,血球计数板计数,浓度调至2×106个/mL。
1.4 BF 体外构建 在培养板中预先放入无菌的盖玻片和聚乙烯网片(40 目),每种材料分3 个孔放入。将1 mL 孢子悬液和1 mL 沙氏葡萄糖液体培养基加入至6 孔培养板中,20 ℃培养72 h。筛选出适宜体外构建水霉菌BF 的材料[6]。
1.5 BF 的定量分析 按以上方法选出适宜的材料,并依照同样的方法在培养板中构建BF,设不加水霉菌孢子悬液的空白对照组。静置培养6 h、12 h、24 h、48 h 及72 h 后,吸出多余的培养基,经灭菌PBS 清洗3 次以去除游离菌。试验重复3 次。
按照细胞计数试剂盒CCK-8 方法,在培养板中分别加入沙氏葡萄糖液体培养基和CCK-8 工作液,于28 ℃恒温培养3 h,将反应液平分于96 孔板中,测定每孔OD450nm值。实际OD450nm为每个实验孔的OD450nm减去空白对照孔的OD450nm。
结果以平均数加或减标准偏差表示,采用EXCEL、SPSS 13.0 软件进行统计学分析。
1.6 BF 的观察 将培养6 h、12 h、24 h、36 h、48 h、60 h 及72 h 含BF 的载体材料经灭菌PBS 冲洗3 次,200 μL Calcofluor White M2R(0.05 %[V/V])避光染色1 min,冲洗后放置于载玻片上荧光显微镜下观察[7]。
将在培养板中20 ℃培养24 h、48 h、72 h 及6 d含BF 的载体取出,制备扫描电镜标本,在Hitachi S-3400NII 扫描电镜下观察[8]。
取不同时间段的BF 载体,按文献[9]方法处理并使用激光共聚焦显微镜观察。由BF 游离面向BF与聚乙烯网片附着面逐层扫描(沿Z 轴扫描),每个标本取3 个随机视野,每个视野根据BF 的厚度,扫描8 层~30 层。
2 结果
2.1 构建水霉菌BF 载体材料筛选 水霉菌在聚乙烯网片和盖玻片上形成BF 如图1 所示,水霉菌在两种材料表面均可以形成水霉菌BF,但盖玻片上形成的水霉菌BF 较少,粘附不牢固,清洗时易脱落;而聚乙烯网片表面形成的水霉菌BF 较多,与聚乙烯网片紧密粘附,完全覆盖聚乙烯网片,形成厚厚的膜状结构。

图1 水霉菌在聚乙烯网片和玻片上BF 的形成情况Fig.1 The S.parasitica BF developed on polyethylene netting(a)and glass slide(b)
2.2 水霉菌BF 形成过程 静置培养6 h、12 h、24 h、48 h 及72 h 后,水霉菌BF 形成情况如表1所示,在培养初期,水霉菌所形成的BF OD450nm随着培养时间的延长而增加,培养后24 h 内升高较快,继续培养,48 h~72 h 逐渐趋于稳定。
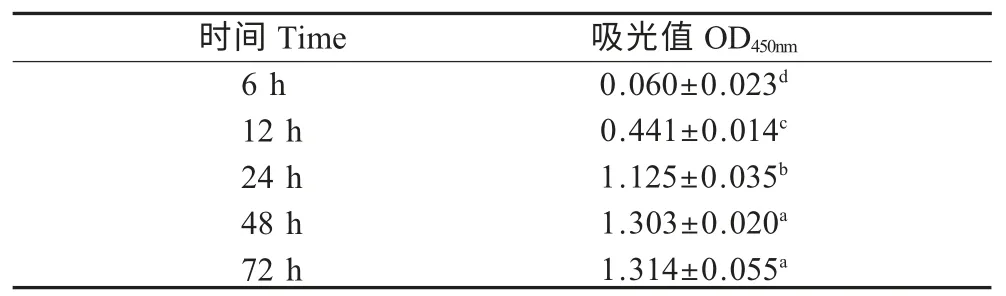
表1 不同培养时间水霉菌形成BF 的OD450nm值Table 1 OD450nmvalues of S.parasitica BF of different incubation times
2.3 水霉菌BF 形成过程及结构观察 将培养不同时间形成的水霉菌BF 进行Calcofluor White M2R 染色后观察其形成过程,结果显示,水霉菌在第6 h即开始有散在的孢子黏附于载体材料上(图2a);12 h时菌丝延长交织(图2b);24 h 水霉菌菌丝缠绕,菌丝外胞外基质增多,菌丝被胞外基质包裹,开始形成膜状结构覆盖在载体材料上(图2c);随培养时间延长,BF 形成逐渐增多,最后完全包裹在胞外基质中,覆盖整个材料(图2d-g)。并且在水霉菌BF 中可见孢子囊(图2h)和大量游动孢子(图2i),其中以水霉菌菌丝为主要结构的微生物群落。

图2 Calcofluor White M2R 染色观察水霉菌BF 形成过程及胞外基质情况Fig.2 Examination developmental phases of S.parasitica BF with Calcofluor White M2R stain by fluorescence microscopy
将在聚乙烯材料表面培养24 h、48 h、72 h 的水霉菌BF 于扫描电镜下对其形成过程进行观察。结果显示:24 h 稀疏的菌丝交织(图3a),48 h 逐渐致密(图3b),72 h 形成复杂的网状结构(图3c),而在培养后期(6d)菌丝扭曲、断裂(图3d)。在扫描电镜下可见水霉菌BF 菌丝有序排列、成簇交织生长,形成具有复杂的三维立体结构特征的多细胞菌落(图3e-f)。

图3 扫描电镜观察水霉菌BF 结构特征Fig.3 Examination structural characteristic of S.parasitica BF by scanning electron microscope
2.4 水霉菌BF 的立体结构特征 激光共聚焦显微镜观察SYTO 9/PI 染色24 h、48 h、72 h 水霉菌BF。图4 显示不同时间段BF 一个随机视野的截面红绿通道信号叠加图。其中,红色信号代表死菌(死菌被PI 着色发出红色荧光),绿色信号代表活菌(活菌被SYTO 着色发出绿色荧光),部分图像呈橙色或桔黄色,一般认为是死菌和活菌重叠造成。结果显示,24 h 时,已有水霉菌孢子萌发,菌丝交织成稀疏的BF 结构(图4-1a)。48 h 时水霉菌密集,层叠成簇延伸生长(图4-2a)。随着培养时间的延长,水霉菌密度不断的增加,至72 h 时水霉菌形成致密的网状结构(图4-3a)。同时,死菌明显增多,可见死菌(红色信号)大大增多,死菌和活菌交织共同形成BF结构。
3 讨论
相对于浮游形式而言,微生物BF 是一种具有高度组织性、协调性的微群体形式,这种复杂结构的维持对微生物生物学行为极为重要。开展BF 相关研究的前提就是建立标准规范的BF 模型。本实验采用置片法体外构建水霉菌BF,置片法即在微生物培养液中加入玻璃片或其他片状、管状物静置共培养,以提供额外的可供BF 附着并可以移动处理的表面[10]。本研究中载体材料选用40 目聚乙烯网片,因其作为鱼卵孵化生产中黏性卵的粘附载体,其上形成的BF 更能够模拟田间所形成的水霉菌BF。结果表明,玻片上形成的水霉菌BF 较少,并且易于刮落。而聚乙烯网片上的BF 与网片牢固粘附,形成致密、复杂的BF 结构。表面性质与BF 体外构建密切相关[11],糙面可能更利于BF 的形成,本研究结果表明聚乙烯网片可以作为研究水霉菌BF较好的载体。
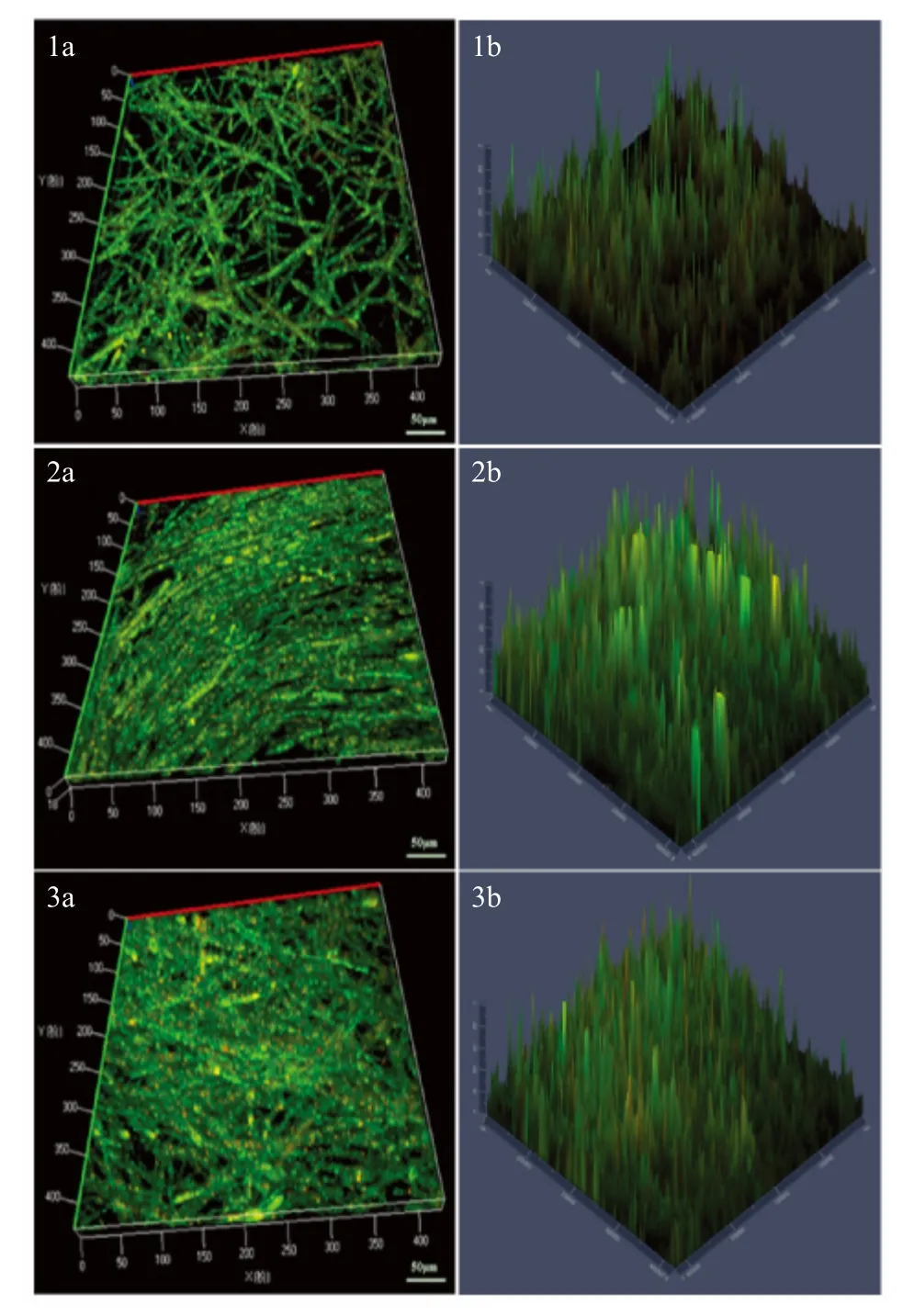
图4 激光共聚焦显微镜观察水霉菌BF 的立体结构Fig.4 Examination stereoscopic structure of S.parasitica BF by confocal laser scanning microscopy
真菌的BF 形成过程不尽相同,但大致可分为早期(≈0~11 h)、中期(≈12~30 h)及成熟期(≈38~72 h)[7]。白念珠菌芽生孢子早期粘附在有机玻璃表面,逐渐形成微菌落;中期由于细胞的生长、聚合,菌体变厚,并且胞外基质覆盖在菌体表面;成熟期BF 结构变得更加复杂,直到菌体完全被胞外基质包裹。丝状真菌BF 的形成过程,与真菌BF 典型的形成过程大致一致[12]。本研究通过测定细胞活力及显微镜观察描述水霉菌BF 的形成过程,结果显示,0~6 h 为水霉菌黏附初期;12 h~24 h 形成单细胞层;36 h~60 h 为中间形成阶段,至72 h 菌丝缠绕形成多层的、弥散着大量细胞外基质的立体结构,同时死菌随着培养时间延长而增多。该过程与烟曲霉生BF 的发育过程类似[13],只要在适合的底物上,其孢子也会发生黏附、萌芽、菌丝延长、直至形成菌丝有序排列的三维立体结构并产生细胞外基质。
荧光染色剂Calcofluor White M2R 能够与纤维素、几丁质和其他β-1,4 糖苷键碳水化合物紧密结合,吸收紫外光,发出明亮的蓝色荧光[14]。本研究利用钙荧光白染色技术证明了细胞外基质的存在,并发现随着BF 的成熟,胞外基质随之增多,最后菌丝及相关繁殖体完全被包裹在其中。这可能与BF内外信息交流和耐药性具有密切关系[15]。
综上所述,聚乙烯网片可以作为研究水霉菌BF较好的载体,水霉菌能够在聚乙烯网片上形成典型的BF 结构,即菌丝相互黏附形成的有结构的微生物群落;菌丝有序分布,菌丝周围有细胞外基质的包裹。本研究体外构建了水霉菌BF,了解其形成过程与结构特征,有助于早期干预和防止水霉菌BF的形成,也为水霉菌BF 进一步研究提供参考。
[1]陈本亮,张其中.水霉及水霉病防治的研究进展[J].水产科学,2011,07:429-434.
[2]汪雯,李玉.真菌生物被膜的研究进展[J].国际呼吸杂志,2011,31(5):398-400.
[3]O'Toole G,Kaplan H B,Kolter R.Biofilm formation as micro-bial development[J].Annu Rev Microbiol,2000,54:49-79.
[4]Ali S E,Thoen E,Vralstad T,et al.Development and reproduction of Saprolegnia species in biofilms[J].Vet Microbiol,2013,163:133-141.
[5]夏文伟.鲫卵源致病性水霉的分离与鉴定及其生物学特性研究[D].上海:上海海洋大学,2011.
[6]任萍,樊昕,杨蓉娅,等.几种不同基质对阿萨希毛孢子菌形成生物膜影响的初步观察[J].中国真菌学杂志,2010,05(4):201-205.
[7]Chandra J,Kuhn D M,Mukherjee P K,et al.Biofilm formation by the fungal pathogen Candida albicans:development,architecture,and drug resistance[J].J Bacteriol,2001,183(18):5385-5394.
[8]Toyotome T,Yamaguchi M,Iwasaki A,et al.Fetuin A,a serum component,promotes growth and biofilm formation by Aspergillus fumigates[J].Int J Med Microbiol,2012,302(2):108-116.
[9]郜向娜,余加林,芦起,等.四唑盐减低法结合激光共聚焦显微镜定量分析表皮葡萄球菌生物被膜体外模型[J].中国微生态学杂志,2010,22(12):1081-1084.
[10]李京宝,韩峰,于文功,等.细菌生物膜研究技术[J].微生物学报,2007,47(3):558-561.
[11]任晓萍,杨蓉娅,樊昕,等.真菌生物膜影响因素的研究进展[J].中国真菌学杂志,2009,4(3):183-185.
[12]Harding M W,Marques L L,Howard R J,et al.Can filamentous fungi form biofilms[J].Trends Microbiol,2009,17(11):475-480.
[13]李丽娟,陈伟,许辉,等.曲霉生物膜的形成过程与结构特征[J].中国真菌学杂志,2011,6(2):93-97.
[14]曹月青,朱祥先.应用荧光染色法检测寄主昆虫体表病原真菌孢子及其附着孢[J].微生物学杂志,2010,30(3):91-92.
[15]Virgínia M S,Nelson L.Biofilm formation by filamentous fungi recovered from a water system[J].J Mycol,2013,2013:1-9.

