夜香树叶正丁醇提取物中流份C6 和C7 对人胃癌细胞SGC7901增殖和凋亡作用的影响Δ
吴登攀,廖 文,黄金兰,陈文雅,何育炉,张晟瑞,钟振国#(.徐州医学院药学院,江苏 徐州 004;.广西中医药大学新药研究开发中心,南宁 53000)
恶性肿瘤严重威胁人类健康,给人类带来了巨大的精神压力和经济负担。随着现代技术的发展,抗肿瘤中草药的发掘和筛选成为抗肿瘤的主要发展方向之一。夜香树又名夜来香,主要分布于我国南方地区,为茄科夜香树属植物(Cestrum nocturnum,Linn.,简称CN)。CN 性温、味辛,具行气止痛、镇定之功效,民间用于治疗胃脘痛。研究报道,CN 提取物具有镇痛、中枢抑制、局部麻醉[1]和抗糖尿病[2]作用。然而,其抗肿瘤方面的研究却鲜见报道。研究发现,CN 花、叶及嫩枝具有良好的抗肿瘤作用[3-4],且其活性部位主要在正丁醇部位[5-6]。为进一步研究CN正丁醇部位抗肿瘤作用的有效组分,笔者采用不同比例氯仿-甲醇(1 ∶9、1 ∶7)梯度洗脱正丁醇提取物得到流份C6 和C7,并选用人胃癌SGC7901 细胞为受试细胞,通过体外试验研究流份C6和C7的抗肿瘤活性,为开发CN的抗肿瘤功效提供依据。
1 材料
1.1 仪器
381型CO2培养箱(美国Life Technologies 公司);TE2000-U 型倒置荧光显微镜(日本尼康株式会社);Sunrise 型酶标仪(美国Biocell Technology公司)。
1.2 药材与试剂
CN叶采自广西境内,经广西中医药大学药用植物教研室刘寿养教授鉴定为茄科夜香树属植物夜香树Cestrum nocturnum,Linn.的叶;胚胎牛血清(FBS)、RPMI1640 培养基(美国Life Technologies 公司);MTT、碘化丙啶(PI)、Hoechst 33258染液(美国Sigma-Aldrich 公司,批号:080521、P-4170、23491-45-4,纯度:98%、94%、98%);其余试剂均为国产分析纯。
1.3 细胞株
人胃癌SGC7901细胞株购自上海细胞生物研究所。
2 方法
2.1 细胞培养
人胃癌SGC7901细胞株用含10%FBS的RPMI 1640培养液于37 ℃、5%CO2培养箱中培养,0.25%胰蛋白酶消化传代,取对数生长期细胞用于试验。
2.2 CN叶正丁醇部位流份C6、C7的提取
CN 叶经日晒干燥后分别用95%、50%乙醇渗漉提取,并将两部分浸膏合并得乙醇总浸膏。乙醇总浸膏用硅胶拌匀后,用水饱和正丁醇回流提取,得正丁醇部位浸膏,将浸膏烘干至恒质量,精密称定,计算浸膏得率:浸膏得率(%)=浸膏质量/药材总质量×100%。经计算,正丁醇部位浸膏得率为1.25%。将正丁醇部位浸膏加无水乙醇溶解后用100~200目的硅胶拌样并装柱,依次用1 ∶9、1 ∶7(V/V)的氯仿-甲醇进行梯度洗脱,分别获得流份C6、C7。
2.3 分组及干预方法
将对数生长期细胞分为空白组和给药组。前期MTT试验结果显示,流份C6、C7 在20 μg/ml 时对SGC7901 细胞的增殖抑制率分别为59.2%和55.5%。为进一步探讨其对SGC7901细胞的增殖抑制作用,笔者在本次MTT 试验中将给药组C6、C7 质量浓度均设置为5、10、20、40、80 μg/ml;在集落形成试验、瑞氏-姬姆萨混染试验和Hoechst33258/PI染色试验中给药组C6、C7 的质量浓度均为10 μg/ml。上述试验中的空白对照组则加入等体积的培养液。
2.4 MTT法测定流份C6、C7对SGC7901细胞的增殖抑制率
在96 孔培养板中按1 000 个细胞/孔加入200 μl 含10%FBS的RPMI 1640培养液。将细胞置于培养箱中培养24 h,待细胞贴壁后,分别加入不同质量浓度的C6、C7,置于培养箱中培养72 h。培养结束前4 h弃去上清液,按200 μl/孔加入新鲜制备的含0.2 mg/ml MTT的无血清培养液,37 ℃继续培养4 h,弃去上清液,按200 μl/孔加入二甲基亚砜,振荡混匀后,在酶标仪上以波长为450 nm 测定光密度(OD450)值。按以下公式计算药物对肿瘤细胞增殖的抑制率:增殖抑制率(%)=(1-试验组OD450值/空白对照组OD450值)×100%;用SPSS 11.5 软件计算半数抑制浓度(IC50)。试验重复3次。
2.5 集落形成试验
取对数生长期的细胞制成单个分散细胞悬液,活细胞计数,用含10% FBS 的RPMI 1640 培养液配成细胞密度为100 ml-1的细胞悬液,于35 mm培养皿中分别加入含和不含药物的细胞悬液2 ml,置于培养箱中培养7 d,弃去培养液,先用瑞氏染色液染色5 min,然后用姬姆萨染液与Sorensen 磷钼酸缓冲液以1 ∶9 混合成工作液(现配现用)染色10 min,流水冲洗、晾干,在20倍的显微镜下计数含50个细胞以上的集落。空白对照组以培养液代替受试药物,结果以集落形成率和集落形成抑制率表示。集落形成率(%)=集落数/接种细胞数×100%,集落形成抑制率(%)=1-集落数/空白对照组集落数×100%。试验重复3次。
2.6 瑞氏-姬姆萨混染法观察细胞形态
取对数生长期细胞,用含10% FBS 的PRMI1640 培养液配成1×105ml-1的细胞悬液,接种在35 mm 的培养皿中,细胞贴壁后,分别加入含和不含药物的培养液2 ml,置于培养箱中培养72 h。培养结束后,弃培养液,用甲醇固定10 min。染色操作同“2.5”项下方法。流水冲洗、晾干,镜检。
2.7 Hoechst33258/PI染色法观察细胞形态
细胞的接种、培养同“2.6”项下方法。培养结束后,弃去培养液用PBS 洗1 次,加入2 mmol/L Hoechst 33258 2 μl 和50 μg/ml PI染色液20 μl。37 ℃下染色15 min,滴加封片液,在倒置荧光显微镜下紫外光激发,40倍物镜观察。
2.8 统计学方法
3 结果
3.1 流份C6、C7对SGC7901细胞增殖的影响
随着C6 和C7 质量浓度增加,对SGC7901 细胞增殖的抑制作用也增加,5 μg/ml C6 和C7 对SGC7901 细胞增殖的抑制率分别为22.1%和19.6%;当C6和C7质量浓度增加至80 μg/ml时,细胞增殖的抑制率分别达到80%和79.7%,表明流份C6和C7对SGC7901细胞增殖的抑制作用呈浓度依赖性。流份C6、C7对SGC7901细胞的IC50分别为16.14、18.05 μg/ml,结果详见表1。
表1 细胞增殖抑制率测定结果(,n=3)Tab 1 Results of inhibitory rate of cells(,n=3)
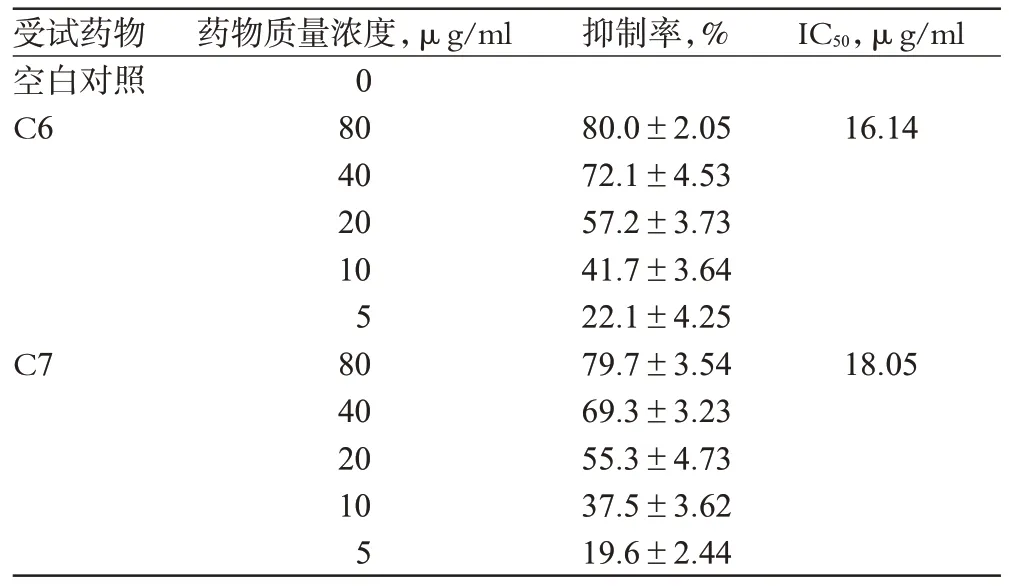
表1 细胞增殖抑制率测定结果(,n=3)Tab 1 Results of inhibitory rate of cells(,n=3)
3.2 流份C6和C7 对SGC7901细胞集落形成的影响
与空白对照组比较,流份C6、C7组(10 μg/ml)SGC7901细胞集落数、集落形成率降低,差异有统计学意义(P<0.05);C6、C7 组(10 μg/ml)细胞集落形成抑制率分别为55.26%和50.00%,结果详见表2。
表2 细胞集落形成率测定结果(,n=3)Tab 2 Results of colony formation rate of cells(,n=3)

表2 细胞集落形成率测定结果(,n=3)Tab 2 Results of colony formation rate of cells(,n=3)
注:与空白对照比较,*P<0.05Note:vs.blank control,*P<0.05
3.3 流份C6、C7对SGC7901细胞形态的影响
瑞氏-姬姆萨混染法染色结果显示,空白对照组细胞的细胞膜较完整、胞质透明、核膜完整、核大而圆;而C6和C7组的细胞均出现凋亡而变圆变小、核质固缩,详见图1A。
Hoechst33258/PI 染色结果显示,由于正常细胞对染料有拒染性,故空白对照组细胞蓝色和红色的荧光较少;C6 和C7组均出现呈强蓝色荧光的凋亡细胞及呈弱蓝色、强红色荧光的死细胞,详见图1B。
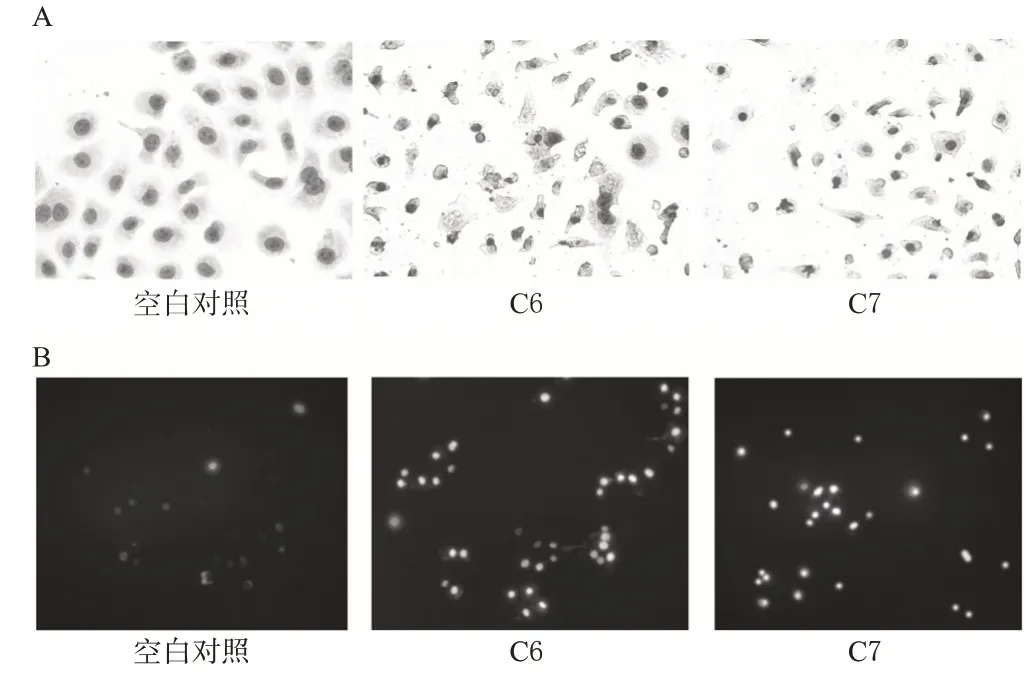
图1 细胞形态学观察结果Fig 1 Morphology of cells
4 讨论
利用MTT 和集落形成法,以抑制肿瘤细胞增殖为活性指标,是目前一种经济、快速、简便的药物筛选方法。MTT 法可通过溶解于二甲基亚砜中甲臜结晶颜色的深浅来反映活细胞的生长能力[7];而集落形成法可反映肿瘤细胞中具有增殖活性的干细胞的增殖能力[8]。细胞集落形成率下降说明肿瘤细胞群体中干细胞比例减少,对肿瘤细胞增殖产生抑制作用[9]。本试验首先对流份C6 和C7 进行MTT 试验,结果表明,流份C6和C7对SGC7901细胞的增殖有明显的抑制作用,且抑制作用呈浓度依赖性(见表1);然后采用集落形成法进一步评价流份C6 和C7 对SGC7901 细胞增殖的影响,结果表明,流份C6 和C7在质量浓度为10 μg/ml时即可显著抑制SGC7901细胞的集落形成,且集落形成率与空白对照组相比有显著性差异(P<0.05)。上述结果提示,流份C6 和C7 可显著抑制SGC7901 细胞增殖。
抗肿瘤药物的抗肿瘤作用除了体现在抑制肿瘤细胞增殖以外,还包括促进肿瘤细胞坏死或凋亡[10]。肿瘤细胞发生凋亡时,由于不断脱水,会出现细胞质不断浓缩、细胞体积减少、细胞核裂解产生凋亡小体等细胞形态学改变[11]。因此,本试验首先采用瑞氏-姬姆萨混染法观察药物作用后SGC7901 细胞的形态学变化。结果表明,给药组出现细胞变圆、体积变小、核质固缩等典型的凋亡特征(图1A)。此外,笔者还采用Hoechst33258/PI 染色法观察药物对SGC7901 细胞凋亡形态的影响。PI可使坏死细胞着色,呈强红色荧光;而Hoechst 33258可渗透过细胞膜,使活细胞染成红色荧光,凋亡细胞染成蓝色荧光[12]。由图1B 可观察到,给药组可观察到很多强蓝色荧光的调亡细胞和呈弱蓝色、强红色荧光的死细胞,而空白对照组这两种细胞少见。这些结果表明,CN 正丁醇提取物C6 和C7 可诱导SGC7901细胞凋亡。
综上,CN 叶正丁醇提取物中流份C6 和C7 可显著抑制SGC7901细胞增殖并可诱导其凋亡,具有很好的抗肿瘤作用,但其抗肿瘤作用的确切机制以及体内抗肿瘤活性还需进一步研究。此外,对筛选出的活性流份还需进一步分离纯化,以明确具有抗肿瘤活性的单体化合物。本试验为CN 叶的进一步研究提供了依据。
[1]吕金燕,白蕊,钟振国.夜香树的化学成分与药理作用研究进展[J].广西中医学院学报,2012,15(2):62.
[2]Kamboj A,Kumar S,Kumar V.Evaluation of antidiabetic activity of hydroalcoholic extract of cestrum nocturnum leaves in streptozotocin-induced diabetic rats[J].Adv Pharmacol Sci,2013,doi:10.1155/2013/150401.
[3]赵世元,黄之虎,叶海洪,等.夜香树花甾体皂苷诱导K562细胞凋亡机制研究[J].中成药,2013,35(3):445.
[4]罗发军,钟振国,赵华平,等.夜香树提取物对小鼠白血病L1210细胞生长的抑制作用[J].时珍国医国药,2009,20(2):335.
[5]钟振国,赵世元,吕金燕,等.夜香树提取物体内抗肿瘤作用的实验研究[J].中药材,2008,31(11):1 709.
[6]卢红梅,钟振国,赵世元,等.夜香树花提取物体外抗肿瘤作用的实验研究[J].时珍国医国药,2010,21(7):1 704.
[7]Angius F,Floris A.Liposomes and MTT cell viability assay:an incompatible affair[J].Toxicol In Vitro,2015,29(2):314.
[8]Masuda H,Asahara T.Clonogenic assay of endothelial progenitor cells[J].Trends Cardiovasc Med,2013,23(4):99.
[9]Joo HJ,Seo HR,Jeong HE,et al.Smooth muscle progenitor cells from peripheral blood promote the neovascularization of endothelial colony-forming cells[J].Biochem Biophys Res Commun,2014,449(4):405.
[10]Droin N,Guery L,Benikhlef N,et al.Targeting apoptosis proteins in hematological malignancies[J].Cancer Letters,2011,332(2):325.
[11]Jendrossek V.Targeting apoptosis pathways by celecoxib in cancer[J].Cancer Letters,2013,332(2):321.
[12]Cai L,Chen ZZ,Dong XM,et al.Silica nanoparticles based label-free aptamer hybridization for ATP detection using hoechst33258 as the signal reporter[J].Biosens Bioelectron,2011,29(1):46.

