绿鳍马面鲀(Navodon septentrionalis)鱼头酸溶性与酶溶性胶原蛋白的分离纯化及理化性质研究*
赵玉勤 王玉梅 王 斌① 迟长凤 丁国芳
(1. 浙江海洋学院食品与医药学院 浙江省海洋生物医用制品工程技术研究中心 舟山 316022;2. 浙江海洋学院海洋科学与技术学院 国家海洋设施养殖工程技术研究中心 舟山 316022)
已有的研究表明, 胶原蛋白是存在于动物骨骼、肌腱、软骨、皮肤及其它结缔组织中的一种相对分子量在30万以上的生物高分子, 对皮肤、血管、骨骼、筋骨、软骨等组织的形成起到重要的作用, 还参与细胞的分化、运动、化学趋向性、结缔组织的修复等过程。同时, 由于胶原蛋白优越的生物相容性、生物可降解性和弱抗原性, 被广泛地应用到食品添加剂、化妆品、生物医学材料和药品中(Duan et al, 2009; 吴铭等, 2011; Liu et al, 2012)。
目前, 胶原蛋白主要来源于猪、牛等畜产品的皮、肌腱和骨骼等原料, 但是哺乳动物疫病的暴发和人畜共患病的增加, 如牛海绵状脑病(BSE)和传播性海绵状脑病(TSE) (Jongjareonrak et al, 2005a, b; Chi et al, 2014)、禽流感、甲型H1N1流感等, 使畜产品来源的胶原蛋白的安全性更受质疑。因此, 世界各国都在积极地寻找更加安全的胶原蛋白来源。水产动物加工副产物, 如鱼皮、鱼鳞、鱼骨中胶原蛋白的含量较高, 而且, 水产养殖的大规模发展使得水产动物加工副产物的量逐年增加, 也使得水产胶原蛋白替代哺乳动物胶原蛋白成为可能。目前, 已成功从鳕鱼皮、金枪鱼鱼骨、鱿鱼皮、鲨鱼软骨、鳙鱼鱼鳞等材料制备胶原蛋白, 并对其性质进行了细致研究(Jongjareonrak et al, 2005a, b; 陈申如等, 2006; 任俊凤等, 2009; Li et al, 2013a; Liu et al, 2012; Li et al,2013b)。
绿鳍马面 鲀(Navodon septentrionalis)属脊索动物门、硬骨鱼纲、鲀形目、革鲀科、马面鲀属, 是我国的一种常见鱼类(张冬茜等, 2013)。由于其头部生有倒刺且皮质坚硬, 马面鲀的鱼头和鱼皮在食用和加工过程中经常被丢弃, 既浪费资源, 也对环境产生不利影响。基于此, 本实验以马面鲀鱼头为原料, 利用酸提法和酶提法对其胶原蛋白进行制备, 并对其理化性质进行了详细分析。本实验的研究, 将为马面鲀鱼头的高值化利用奠定数据和理论基础。
1 材料与方法
1.1 样品、试剂与仪器
绿鳍马面鲀(N. septentrionalis)购买于舟山市南珍水产市场, 种属由浙江海洋学院海洋科学与技术学院赵盛龙教授鉴定, 标本于–20°C存放于浙江海洋学院食品与医药学院药学实验室。
SDS-PAGE电泳试剂为Bio-Rad产品, 牛皮胶原蛋白标准品(CSC)、猪胃蛋白酶(Pepsin, 160 000 U/g)为Sigma产品。其他试剂为国产分析纯, 购买于上海国药集团化学试剂有限公司。
1.2 实验方法
1.2.1 马面鲀鱼头预处理 将马面鲀鱼头剪成小块, 放入组织捣碎机中破碎, 按照 1︰15(W/V)的料液比加入0.1 mol/L的NaOH溶液于4°C下搅拌浸泡24 h (NaOH溶液每6 h更换一次), 除去非胶原蛋白, 并防止内源性蛋白酶对胶原蛋白的影响。处理后的鱼头,用冷水洗涤至中性, 充分沥干后, 按 1︰20(V/V)料液比加入15%正丁醇溶液浸泡48 h(正丁醇溶液每12 h更换一次)除去残留的脂肪。处理后的鱼头按照 1︰10(W/V)加入0.5 mol/L的EDTA-2Na(pH 7.4)溶液浸泡24 h(EDTA-2Na溶液每12 h更换一次), 进行脱钙。最后将脱脂、脱钙的鱼头用蒸馏水彻底洗涤、充分沥干, 备用。
1.2.2 胶原蛋白的制备
1.2.2.1 酸溶性胶原蛋白(ASC)提取 ASC制备参照Yu等(2014)方法进行。将预处理的马面鲀鱼头按1︰15(W/V)的料液比置于0.5 mol/L的乙酸中, 搅拌提取24 h, 经4°C、20 000 g离心30 min后得上清液, 即为粗胶原蛋白。将粗胶原蛋白装入透析袋放入Tris-HCl缓冲液(0.05 mol/L, pH 7.5)中, 逐渐添加NaCl至溶液最终浓度为2.6 mol/L, 透析过夜至胶原蛋白呈絮状物沉淀析出, 于 4 °C、20000 r/min离心20 min得沉淀物。将得到的沉淀用0.5 mol/L的乙酸溶液复溶后依次用0.1 mol /L的乙酸透析24 h和蒸馏水透析 36 h, 透析液冷冻干燥得酸溶性胶原蛋白(ASC)。ASC的提取率计算按照下面公式计算:

1.2.2.2 酶溶性胶原蛋白(PSC)提取 PSC提取参照Yu等(2014)方法进行。将酸溶性胶原蛋白(ASC)提取后的鱼头残渣按照1︰15 (W/V)料液比置于0.5 mol/L的乙酸溶液, 加入 3%猪胃蛋白酶后在 4°C下连续搅拌48 h, 于 4°C、20000 g离心30 min后得上清液, 即为粗胶原蛋白。将粗胶原蛋白装入透析袋放入Tris-HCl缓冲液(0.05 mol/L, pH 7.5)中, 逐渐添加NaCl至溶液最终浓度为2.6 mol/L, 透析过夜至胶原蛋白呈絮状物沉淀析出, 于 4 °C、20000 r/min离心20 min得沉淀物。将得到的沉淀用0.5 mol /L的乙酸溶液复溶后依次用0.1 mol /L的乙酸透析24 h和蒸馏水透析 36 h, 透析液冷冻干燥得酶溶性胶原蛋白(PSC), PSC的提取率计算按照下面公式计算:

1.2.3 ASC和PSC基本成分分析 ASC和PSC的水分、灰分、脂肪和蛋白质的测定分别按照 AOAC(2003)中的 950.46B、920.153、960.39(a)和 928.08 方法进行分析。
1.2.4 氨基酸(AA)组成分析 氨基酸(AA)组成分析参照陆剑锋等(2010)和谢超等(2009)方法进行。称取1 mg冷冻干燥的ASC和PSC分别放入不同的安瓿瓶中, 加入 2 mL HCl(6 mol/L)(色氨酸测定采用KOH水解), 并充入少量氮气, 在酒精喷灯下迅速封管, 于110 °C水解24 h。水解结束后, 冷却水解物,移至坩埚, 在70 °C水浴锅中挥发剩余盐酸, 再加入少量双蒸水蒸干, 重复3次。用适量pH 2.20的缓冲液溶解后定容, 并用0.22 μm微孔滤膜除杂, 滤液用HITACH L8800氨基酸全自动分析仪进行测定。测定三次并计算数据相对应的平均值, 标准偏差低于2%。
1.2.5 SDS-PAGE电泳和蛋白质浓度测定 SDSPAGE电泳参考Chi等(2013a)方法进行。分离胶浓度为7.5%, 浓缩胶浓度为4%, 200 V电泳30 min, 用考马司亮蓝R-250染色液(考马斯亮蓝0.5 g, 甲醇225 mL,蒸馏水225 mL, 冰醋酸50 mL), 染色15 min, 脱色液(甲醇100 mL, 冰醋酸100 mL, 蒸馏水800 mL), 脱色并拍照。
1.2.6 傅里叶变换光谱(FTIR) FTIR参照宋茹等(2011)方法进行。称取冷冻干燥后的ASC和 PSC样品1—2mg按照质量比1︰100与干燥KBr压混合, 手动压片, 采用傅里叶变换红外光谱仪对样品在 450—4000 cm–1区间内进行吸收波谱扫描。
1.2.7 ASC和PSC溶液黏度测定 ASC和PSC黏度的测定按照 Kittiphattanabawon等(2005)的方法用黏度计进行测定。胶原蛋白水溶液(0.6%)的温度按照4 °C /min的速度从4°C上升到40°C。相对黏度为测定时的黏度与4°C黏度的比值。Td定义为相对黏度降低50%时的温度。黏度分数按照下列公式计算:

1.2.8 ASC和PSC溶解度的测定 ASC和PSC的溶解度测定按照Montero等(1991)方法进行。将ASC和PSC按照3 mg/mL的比例加入到0.5 mol/L的乙酸溶液中, 4°C 搅拌 24 h之后, 于 4 °C、15 000 rmp 离心30 min。取离心后的上清液用于溶解度的测定。
1.2.8.1 pH值对胶原蛋白溶解度的影响 将上述配制的ASC和PSC溶液8 mL加入到50 mL离心管中, 用6 mol/L的NaOH/HCl溶液调节溶液pH值从1-11。用相同pH的NaOH/HCl溶液将体积补足至10 mL,4 °C 下轻轻搅拌 30 min 后, 于 4 °C、15 000 rmp 离心60 min。离心得到的上清液, 测定其蛋白质的含量,相对溶解度为当前pH值下蛋白浓度与最大溶解度的pH值下的蛋白浓度的比值。
1.2.8.2 NaCl浓度对胶原蛋白溶解度的影响 取ASC和PSC溶液(6 mol/L, 5 mL)加入0.5 mol/L的乙酸溶液和5 mL NaCl使最终得到的溶液浓度(W/V )中其NaCl含量分别为0 %, 1 %, 2 %, 3 %, 4 %, 5 %和6 %。将调好浓度的溶液于4°C下轻轻搅拌30min后, 于4 °C、15000 r/min离心60 min, 离心得到的上清液用来测定蛋白质的含量, 相对溶解度为当前 NaCl浓度下蛋白浓度与最大溶解度的 NaCl浓度下的蛋白浓度的比值。
2 结果与讨论
2.1 ASC和PSC的提取率与成分分析
马面鲀鱼头中 ASC和 PSC的提取率分别为0.94% ± 0.07%和 3.91% ±0.14%, PSC 的提取率是ASC的 4.16倍。因此, 胃蛋白酶可以作为一种辅助工具, 用于提高胶原蛋白的提取率。
马面鲀鱼头、ASC和PSC中成分如表1所示: 相对于鱼头的营养成分, ASC和PSC中蛋白含量显著升高, 而灰分和脂肪的含量显著降低。结果表明试验中采用的脱脂和脱钙方法可有效消除原料中的脂肪和钙, 既减少了原料中杂质的含量, 也有利于胶原蛋白的提取。
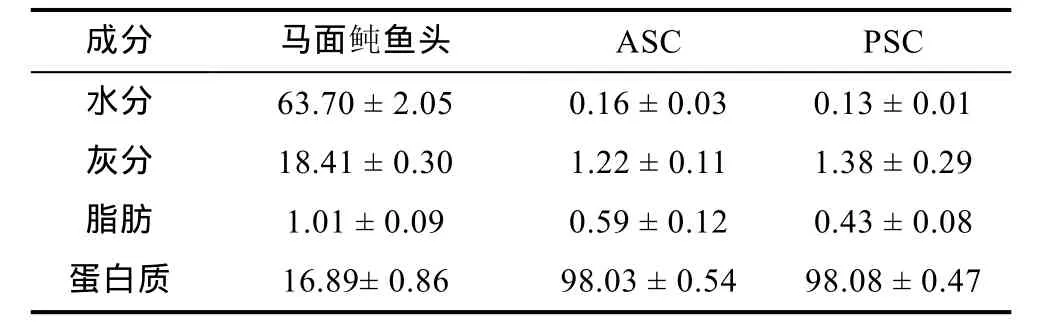
表1 马面鲀鱼头、ASC和PSC中营养成分分析(n=3)Tab.1 Composition of head of bluefin leatherjacket, ASC andPSC (n=3)
2.2 ASC和PSC氨基酸组分分析
ASC和 PSC的氨基酸组成及含量见表 2。结果表明: ASC和PSC具有相似的氨基酸组分, 含量最高的氨基酸是Gly(265.0和251.8残基/1000残基), 其次是 Ala(111.0和 107.6残基/1000残基)和 Pro(87.0和83.1残基/1000残基)。而His和Tyr的含量较少, 并且未检测到Cys。ASC和PSC中亚氨基酸(Pro+Hyp)含量为169.3和160.6残基/1000残基。

表2 ASC、PSC和CSC的氨基酸组成及含量(残基/1000残基)(n=3)Tab.2 Amino acids compositions of ASC, PSC and CSC(residues/1000 residues) (n=3)
已有研究表明 Gly的空间结构可使多肽链折叠的构象得到优化, 是唯一适合螺旋结构内部位置的氨基酸, 因此成为胶原蛋白中每个三肽段的第三个残基, 从而产生重复的(Gly-X-Y)n结构。在溶液中,Gly被包埋在螺旋结构的内部, 难与溶剂接触, 其与溶剂作用力的大小就取决于X、Y位上的氨基酸种类。研究发现, Gly-X-Y肽段的X位多由Pro占据, Y位由Hyp占据(Balti et al, 2011)。因此, 亚氨基酸的含量对胶原蛋白与溶剂的分子间作用力具有重要影响。另外,Sionkowska等(1999)和李卫林等(2005)研究表明: 亚氨基酸的吡咯环对胶原蛋白二级结构所起的固定化以及由 Hyp的羟基所形成的氢键对胶原螺旋的稳定化起着重要的作用, 亚氨基酸(Pro和 Hyp)的含量与胶原稳定性存在正相关性。从马面鲀鱼头中提取的ASC和 PSC的亚氨基酸含量低于牛皮胶原蛋白(CSC)(217.8残基/1000残基), 说明从绿鳍马面鲀提取的ASC和PSC的螺旋结构较哺乳动物胶原蛋白热稳定性差。另外, 从表2还可看出, 本实验未从ASC和PSC样品中检测到Cys, 说明马面 鲀鱼头胶原蛋白中二硫键含量很少。
2.3 ASC和PSC的SDS-PAGE
ASC和PSC的SDS-PAGE结果如图1所示: ASC和PSC均具有较高的纯度, 并且两者都由至少两种α肽链(α1和α2)组成, 它们的分子量大小、亚基构成非常相似。其中, α1肽链的分子量都约为130 kDa, 含量较高, α2肽链的分子量约为 110 kDa, 含量较低;除α肽链外, ASC和PSC尚含有大量β肽链(α肽链二聚体), 其分子质量约为 200 kDa, 与 α1肽链含量相近。另外, 在β肽链上方还检测到一条高分子质量的条带, 为γ肽链(α肽链三聚体), 相对分子质量为300 kDa左右。ASC和PSC的SDS-PAGE图谱与马鲛鱼、鳙鱼、大眼鲷, 尼罗尖吻鲈, 深海红鱼狭鳕、条纹鲶鱼、大斑刺鲀、鲤鱼等大多数鱼类的 I型胶原蛋白相似(Montero et al, 1991; Jongjareonrak et al, 2005a, b;Kittiphattanabawon et al, 2005; Balti et al, 2011; Liu et al, 2012; Chi et al, 2013; Li et al, 2013b)。因此, 可以推断ASC和PSC也属于I型胶原蛋白。

图1 马面鲀鱼头ASC和PSC的SDS-PAGE图谱Fig.1 SDS-PAGE pattern of ASC and PSC from the head of bluefin leatherjacket
2.4 傅里叶变换红外光谱(FTIR)
ASC和PSC的傅里叶变换红外光谱(4000—450 cm–1)如图2所示。结果表明: ASC和PSC的红外谱图具备I型胶原蛋白的红外光谱特征。3400 cm–1附近是N-H伸缩振动峰, 2900 cm–1附近是酰胺B带的C-H伸缩振动峰, 1650 cm–1附近是酰胺Ⅰ带的C=O伸缩振动峰,1540 cm–1附近是酰胺Ⅱ带的N-H弯曲振动峰, 1240 cm–1附近吸收峰为酰胺Ⅲ带的 N-H伸缩振动的变形峰,1450—1230cm–1附近的吸收峰表明胶原蛋白具有完整的3股螺旋结构(Li et al, 2013b)。ASC 和 PSC的红外图谱与文献报道的牛皮Ⅰ型胶原蛋白红外图谱基本吻合, 说明两者微观结构有很大的相似性。
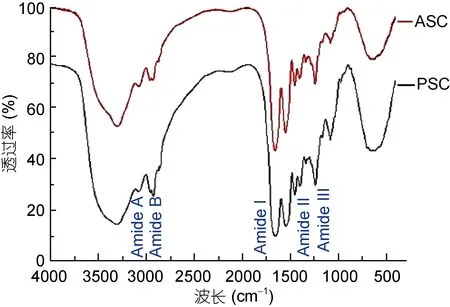
图2 马面鲀鱼头ASC和PSC的红外光谱(FTIR)Fig.2 FTIR spectra of ASC and PSC from the head of bluefin leatherjacket
2.5 ASC和 PSC的黏度(Viscosity)与热变性温度(Td)
黏度, 又称粘性系数、剪切黏度或动力黏度, 是流体的一种物理属性, 用以衡量流体的粘性。黏度的大小取决于液体的性质与温度, 而胶原蛋白溶液的性质取决于其分子量大小及氨基酸组成, 其中分子量大小起到了决定性的作用。因此, 黏度的大小在一定程度上可反应胶原蛋白分子量的大小。天然状态下的胶原蛋白由3条多肽链缠绕而成, 随着温度的升高,胶原蛋白的氢键会逐渐断裂, 胶原分子解开螺旋, 分子量减小, 天然构象被破坏, 分子从伸展的纤维态转变为无规则的卷曲状态, 并伴随着多种理化性质的改变, 如粘滞性、溶解度、沉淀反应、扩散、光散射和光学活性等(Usha et al, 2004)。因此, 对胶原蛋白溶液黏度和热变性温度(thermal denaturation temperature,Td)的研究可有助于了解其分子结构和稳定性。
胶原蛋白的热变性温度(Td)是反映其天然螺旋结构稳定性的一项重要指标, 可以通过胶原蛋白的热变曲线(ηsp/c-t)来反映, 同时 Td也表示胶原蛋白螺旋被破坏时的温度。ASC和PSC黏度随温度变化的趋势如图3所示。结果表明: ASC和PSC溶液随着温度由 4°C上升到 24°C, 其黏度迅速降低, 而从 24°C上升到40°C, 黏度变化很小。ASC和PSC的热变性温度分别为 17.6 °C和 16.5 °C, 低于牛皮胶原蛋白的Td(37 °C)。已有研究证实热变性温度与亚氨酸含量呈正相关(Nagai et al, 2002; Huang et al, 2011)。氨基酸组成的分析表明ASC和PSC的亚氨酸含量显著低于牛皮胶原蛋白, 从而导致其热稳定性较牛皮胶原蛋白差。

图3 温度对马面鲀鱼头ASC和PSC黏度的影响(n=3)Fig.3 Thermal behaviours of ASC and PSC from the head of bluefin leatherjacket measured by viscosity change in deionized water (n=3)
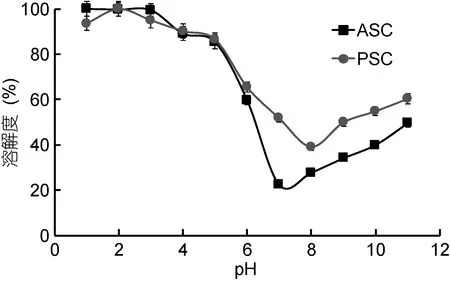
图4 pH值对马面鲀鱼头ASC和PSC溶解度的影响(n=3)Fig.4 Solubility of ASC and PSC from the head of bluefin leatherjacket at different pH (n=3)

图5 NaCl浓度对马面鲀鱼头ASC和PSC溶解度的影响(n=3)Fig.5 Solubility of ASC and PSC from the head of bluefin leatherjacket at different NaCl concentrations (n=3)
2.6 溶解度
2.6.1 pH对 ASC和 PSC溶解度的影响 从图 4中可以看出, pH值在1和3之间时, ASC的溶解度处于较高水平, 当pH值从4到7时, ASC的溶解度显著减小。在pH为7时, ASC的溶解度达到最小值(22.3% ±3.6%)。当pH值从7到11时, ASC的溶解度有所增加, 但始终低于pH 1—6范围时的溶解度。PSC的溶解度在pH 1—4时较大, 在pH为8时溶解度达到最低(39.1% ± 3.8%)。在pH从1到11范围内, ASC和PSC溶解度的变化趋势基本相同。当pH值低于或高于等电点时其负电荷或正电荷会随着增加, 相互之间排斥力变大, 增加其溶解度, 而在等电点时蛋白分子的总净电荷为零, 从而导致蛋白聚集沉淀。实验证明, 马面鲀鱼头中 ASC和 PSC的等电点为 pH值 7和8。这一结果与已报道的胶原蛋白的等电点在6到9之间相一致(Nagai et al, 2002; Kittiphattanabawon et al, 2005; Huang et al, 2011; Chi et al, 2013)。
2.6.2 NaCl对 ASC和 PSC溶解度的影响 图 5表明, NaCl浓度在0%—2% (W/V)范围内, ASC和PSC可保持较大的溶解度(>90%); 但当NaCl的浓度从2%增加到 5% (W/V), ASC和 PSC的溶解度急剧下降,而NaCl浓度从5%到6% (W/V)时, ASC和PSC的溶解度缓慢降低。NaCl浓度在 0%—6% (W/V)范围内,ASC和 PSC的溶解度变化趋势基本相同, 但多数浓度下PSC的溶解度高于ASC。
NaCl浓度对ASC和PSC溶解度的影响与Bae 等(2008)报道相一致。在低浓度时, Na+与胶原蛋白结合,使胶原蛋白所带正电荷数增加, 蛋白质分子间彼此排斥, 分散性好, 稳定了蛋白质的结构, 溶解度较大;然而在较高浓度时, 盐离子破坏了分布于表面与周围水分子结合形成的水膜, 发生盐析效应, 使得蛋白质变得不溶而析出, 导致溶解度降低。
3 结论
本实验成功地从马面鲀鱼头中制备酸溶性胶原蛋白(ASC)和酶溶性胶原蛋白(PSC), 并对其性质进行分析。主要结论如下:
(1) 成分分析和 SDS-PAGE电泳结果表明提取并纯化的马面鲀鱼头酸溶性胶原蛋白(ASC)和酶溶性胶原蛋白(PSC)纯度均较高。
(2) 氨基酸组成分析、SDS-PAGE和红外光谱(FTIR)证实ASC和PSC属于I型胶原蛋白。
(3) ASC和PSC的热变性温度相近, 但显著低于陆源哺乳类动物胶原蛋白, 说明其热稳定性较差, 易于降解, 可作为胶原肽的制备原料进行开发。
(4) 在酸性pH值中ASC和 PSC的溶解度较高,但随着NaCl溶液浓度的增大, ASC 和PSC的溶解度逐渐降低。
任俊凤, 任婷婷, 朱蓓薇, 2009. 河豚鱼皮胶原蛋白肽的提取及其抗氧化活性的研究. 中国食品学报, 9(1): 77—83
李卫林, 曹 健, 汤克勇等, 2005. 胶原蛋白结构和稳定性关系研究. 中国皮革, 34(23): 14—16
吴 铭, 徐珍珍, 孙 旸等, 2011. 胶原蛋白在化妆品中的应用及研究进展. 日用化学品科学, 34(2): 19—23
宋 茹, 李仁伟, 俞群娣等, 2011. 不同精制方法对鱿鱼(Ommastrephes bartrami)墨黑色素的微观形态、光谱特征及金属元素的影响. 海洋与湖沼, 42(6): 839—843
张冬茜, 温海深, 钱 焜等, 2013. 绿鳍马面鲀(Navodon septentrionalis)CYP19a基因克隆与表达特征分析. 海洋与湖沼, 44(4): 1086—1094
陆剑锋, 万 全, 殷章敏等, 2010. 中华鳖裙边胶原蛋白的提取及其特征. 水产学报, 34(6): 801—808
陈申如, 蔡扬鹏, 周 琼等, 2006. 鲨鱼鱼皮、鱼骨胶原蛋白的纯化及其特性的初步研究. 中国食品学报, 6(1): 173—178
谢 超, 邓尚贵, 夏松养等, 2009. 带鱼(Trichiurus lepturus)下脚料蛋白水解物的成分分析及抗高血脂功效的研究. 海洋与湖沼, 40(3): 307—312
Bae I, Osatomi K, Yoshida A et al, 2008. Biochemical properties of acid-soluble collagens extracted from the skins of underutilised fishes. Food Chem, 108(1): 49—54
Balti R, Jridi M, Sila A et al, 2011. Extraction and functional properties of gelatin from the skin of cuttlefish (Sepia officinalis) using smooth hound crude acid protease-aided process. Food Hydrocolloid, 25(5): 943—950
Chi C F, Wang B, Li Z R et al, 2013. Characterization of acid-soluble collagens from the cartilages of scalloped hammerhead (Sphyrna lewini), red stingray (Dasyatis akajei), and skate (Raja porosa). Food Sci Biotechnol, 22(4):909—916
Chi C F, Wang B, Li Z R et al, 2014. Characterization of acid-soluble collagen from the skin of hammerhead shark(Sphyrna lewini). J Food Biochem, 38(2): 236–247
Duan R, Zhang J J, Du X Q et al, 2009. Properties of collagen from skin, scale and bone of carp (Cyprinus carpio). Food Chem, 112(3): 702—706
Huang Y R, Shiau C Y, Chen H H et al, 2011. Isolation and characterization of acid and pepsin-solubilized collagens from the skin of balloon fish (Diodon holocanthus). Food Hydrocolloid, 25(6): 1507—1513
Jongjareonrak A, Benjakul S, Visessanguan W et al, 2005a.Isolation and characterisation of acid and pepsin-solubilised collagens from the skin of brownstripe red snapper (Lutjanus vitta). Food Chem, 93(3): 475—484
Jongjareonrak A, Benjakul S, Visessanguan W et al, 2005b.Isolation and characterization of collagen from bigeye snapper (Priacanthus macracanthus) skin. J Sci Food Agr,85(7): 1203—1210
Kittiphattanabawon P, Benjakul S, Visessanguan W et al, 2005.Characterisation of acid-soluble collagen from skin and bone of bigeye snapper (Priacanthus tayenus). Food Chem, 89(3):363—372
Li Z R, Wang B, Chi C F et al, 2013a. Influence of average molecular weight on antioxidant and functional properties of cartilage collagen hydrolysates from Sphyrna lewini,Dasyatis akjei and Raja porosa. Food Res Int, 51(1):283—293
Li Z R, Wang B, Chi C F et al, 2013b. Isolation and characterization of acid soluble collagens and pepsin soluble collagens from the skin and bone of Spanish mackerel(Scomberomorous niphonius). Food Hydrocolloid, 31(1):103—113
Liu D S, Liang L, Regenstein J M et al, 2012. Extraction and characterisation of pepsin-solubilised collagen from Fins,scales, skins, bones and swim bladders of bighead carp(Hypophthalmichthys nobilis). Food Chem, 133(4): 1441—1448
Montero P, Jiménnez-Colmenero F, Borderìas J, 1991. Effect of pH and the presence of NaCl on some hydration properties of collagenous material from trout (Salmo irideus Gibb)muscle and skin. J Sci Food Agr, 54(1): 137—146
Nagai T, Araki Y, Suzuki N, 2002. Collagen of the skin of ocellate puffer fish (Takifugu rubripes). Food Chem, 78(2):173—177
Sionkowska A, Kamińska A, 1999. Thermal helix-coil transition in UV irradiated collagen from rat tail tendon. Int J Biol Macromol, 24(4): 337—340
Usha R, Ramasami T, 2004. The effects of urea and n-propanol on collagen denaturation: using DSC, circular dicroism and viscosity. Thermochim Acta, 409(2): 201—206
Yu D, Chi C F, Wang B et al, 2014. Characterization of acid-and pepsin-soluble collagens from spines and skulls of skipjack tuna (Katsuwonus pelamis). Chin J Nat Med, 12(9):712—720

