阿托伐他汀预处理对缺血再灌注小鼠心肌微血管内皮屏障的保护作用*
赵世杰 齐国先 田 文 史立业 陈 玲 卢彦昭
阿托伐他汀预处理对缺血再灌注小鼠心肌微血管内皮屏障的保护作用*
赵世杰齐国先#田文史立业陈玲卢彦昭
【摘要】目的:探讨阿托伐他汀预处理对缺血再灌注小鼠心肌微血管血流灌注和渗透性的作用及其机制。方法:60只昆明小鼠随机分为6组:假手术组(C组)、缺血组(I组)、再灌注组(I/R组)、再灌注前2h阿托伐他汀10mg/kg灌胃组(A102组)、再灌注前2h阿托伐他汀20mg/kg灌胃组(A202组)、再灌注前2h阿托伐他汀20mg/kg灌胃+再灌注前15min L-NAME(N-硝基-L-精氨酸甲酯)15mg/kg尾静脉注射组(AL202组),每组均10只小鼠。于光镜下结扎冠脉制备心肌缺血再灌注模型,以活体冷冻技术(IVCT)摘取心脏,其中5只小鼠心脏行冷冻置换、石蜡包埋,之后切片行HE染色及Albumin免疫组织化学染色,并对间质中的Albumin免疫组织化学染色强度进行半定量分析;另5只小鼠采用 Western Blotting检测心肌组织内皮型一氧化氮合酶(eNOS)、黏附连接蛋白VE-cadherin和紧密连接蛋白Claudin-5的表达水平。 结果:与I组及I/R组相比,A202组小鼠心肌细胞界限较清晰,降落伞型红细胞的顶端指向血流方向,Albumin无明显向间质等部位渗漏。A102组镜下所见与A202组类似,但微血管内红细胞数量、形态及心肌细胞界限清晰度等不及A202组,Albumin向间质渗漏。AL202组可见心肌细胞肿胀,微血管内红细胞减少、缺如,但微循环血流灌注好于I/R组,Albumin渗漏少于I/R组。与I组和I/R组对比,A202组和A102组心肌组织中eNOS蛋白表达均明显升高(P<0.01),尤以A202组最为明显(P<0.05)。与A202组相比,AL202组eNOS蛋白表达降低(P<0.05),且与I/R组差异无统计学意义(P>0.05)。与C组相比,I组和I/R组VE-cadherin蛋白和Claudin-5蛋白表达显著降低(P<0.05),而A102和A202组VE-cadherin蛋白和Claudin-5蛋白表达较I组和I/R组明显升高(P<0.05),尤以A202组升高最为明显(P<0.05)。AL202组VE-cadherin及Claudin-5蛋白水平较I/R组升高(P<0.05)。结论:再灌注前短时间内大剂量阿托伐他汀预处理可改善缺血再灌注心肌微循环血流灌注及微血管渗透性,其机制可能不完全依赖于eNOS/NO途径。
【关键词】阿托伐他汀;缺血再灌注;微循环;血管渗透性;活体冷冻技术;小鼠
The Protective Effect of Atorvastatin on Microvascular Barrier in Myocardial Ischemia Reperfusion Injury*
ZHAO Shi-jie, QI Guo-xian#, TIAN Wen, SHI Li-ye, CHEN Ling, LU Yan-zhao
Department of Geriatric Cardiology, The First Affiliated Hospital of China Medical University, Shenyang 110001, China;#Corresponding author
【Abstract】Objective: To explore the effect and the probably mechanism of atorvastatin pretreatment before ischemia-reperfusion on epicardial microvascular blood flow and microvascular permeability. Method: 60 mice divided into 6 groups randomly: sham-operated group(C), ischemia group(I), ischemia-reperfusion group(I/R), atorvastatin 10mg/kg gavage 2h before reperfusion group(A102), atorvastatin 20mg/kg gavage 2h before reperfusion group(A202), atorvastatin 20mg/kg gavage 2h before reperfusion+L-NAME 15mg/kg tail vein injection 15min before reperfusion group(AL202). The myocardial ischemia reperfusion model was prepared under light microscopy. IVCT
[作者单位]中国医科大学附属第一医院老年心血管内科, 沈阳110001;#通讯作者,Tel:024-83282300;E-mail:qigx2002@medmail.com.cn
本文2015-08-20收到,2015-09-29修回
followed by freeze-substitution fixation was used to prepare the heart sample of half of the mice in each group, and then stained with hematoxylin-eosine (HE) and albumin antibody for light microscopy observation. The heart samples of another half of each group were prepared for the expression test of eNOS, VE-cadherin and Claudin-5 by Western Blotting. Results: Compared with I and I/R group, A202 group showed the structure of microenvironment was more clear, the apiculus of parachute-shape erythrocytes directed the orientation of blood flow, and less leakage of albumin in the blood vessel. A102 group showed a similar effect, but less than A202 group. In AL202 group, the slices showed myocardial microvascular slightly narrow and myocardial cell swelling, but the blood flow and leakage of plasma albumin is still less than I/R group. Compared with I and I/R group, the expression level of eNOS in A202 and A102 group were significantly increased (P<0.01), especially in A202 group (P<0.05).Compared with A202 group, the expression level of eNOS in AL202 group reduced significantly (P<0.05), and there was no statistically significant difference with I/R group (P>0.05).Compared with C group, the expression level of VE-cadherin and Claudin-5 significantly reduced (P<0.05). Meanwhile, compared with I and I/R group, the expression level of VE-cadherin and Claudin-5 increased significantly in A102 and A202 group (P<0.05), especially in A202 group (P<0.05). Furthermore, compared with I/R group, the expression level of VE-cadherin and Claudin-5 were also increased in AL202 group (P<0.05). Conclusion: High dose atorvastatin pretreatment 2h before reperfusion can significantly improve the blood flow state and the plasma albumin leakage in microvascular, and the mechanism may related to the protection effect of atorvastatin on microvascular endothelial cell junction proteins such as VE-cadherin and Claudin-5, which probably does not totally depend on the eNOS/NO pathway.
【Key words】Atorvastatin; Ischemia reperfusion; Microcirculation; Microvascular permeability; In vivo cryotechnique (IVCT); Mice
缺血再灌注损伤(Ischemic Reperfusion Injury,IRI)是困扰临床的重大难题。心脏再灌注过程中,冠脉血管内皮屏障受损、渗透性增加是损伤的主要始动因素,而病理性的微血管渗透性增加主要由内皮细胞间紧密连接和黏附连接处的细胞间黏附分子来调节[1]。近年来,一系列研究证实他汀类药物可能直接保护内皮细胞间紧密连接及黏附连接组分,从而在内皮屏障调节中起关键作用[2]。然而,目前大部分使用他汀类药物防治IRI的研究都是在缺血或再灌注前12h或数天给予他汀类药物治疗[4],这种给药方式在急性心肌梗死的再灌注治疗中仍有很大的局限性。有研究[4]表明,在心脏移植过程中,于移植前2h给予供体他汀类药物口服,可以有效防止心肌再灌注时微血管内皮细胞的渗透性增加和无复流现象。本研究应用活体冷冻技术(In Vivo Cryotechnique,IVCT),观察再灌注前2h采用阿托伐他汀预处理对缺血再灌注小鼠心肌心外膜下微血管血流状态及渗透性的影响,探讨阿托伐他汀对微血管内皮屏障的保护作用及机制。
1材料与方法
1.1 实验动物及分组
60只清洁级昆明小鼠由中国医科大学实验动物中心提供,动物许可证号:SCXK(辽)2013-0001,雄性,鼠龄5-6w,体重25-30g,普通鼠饲料喂养,自由饮水。随机分为6组:假手术组(C组)、缺血组(I组)、再灌注组(I/R组)、再灌注前2h阿托伐他汀10mg/kg灌胃组(A102组)、再灌注前2h阿托伐他汀20mg/kg灌胃组(A202组)、再灌注前2h阿托伐他汀20mg/kg灌胃+再灌注前15min L-NAME(N-硝基-L-精氨酸甲酯)15mg/kg尾静脉注射组(AL202组)。每组均10只小鼠。
1.2 主要药物、试剂和仪器
阿托伐他汀片(Pfizer,美国);兔源性抗eNOS抗体(Thermo,美国);兔源性抗Claudin-5抗体(Santa Cruz,美国);山羊源性抗VE-Cadherin抗体(Santa Cruz,美国);超纯水系统(NW10LVF,Heal Force,香港);小动物呼吸机(HX-100E,成都泰盟科技有限公司);多导生理记录仪(PowerLab15T,AD Instrument,澳大利亚);光学显微镜(SMZ-168,Olympus,日本);电子天平(PB303,METTLER TOLEDO,瑞士);电泳仪(BIO-RAD,Model250/2.5,瑞典);冷冻离心机(Sorvall Super T21,Thermo,美国);超声细胞破碎机(Dr.HIELSCHER,德国)。
1.3 小鼠心肌缺血再灌注模型的建立[5]
戊巴比妥钠100mg/kg腹腔麻醉,气管插管,接小动物呼吸机,四肢连接生理记录仪,胸骨左缘第三肋间开胸,逐层分离暴露心脏,在左心耳与肺动脉圆
锥间,冠状动脉起始点下方2-3mm处,用6-0带针线穿线,穿线后垫一乳胶圈,结扎冠状动脉前降支。生理记录仪观察到小鼠心电图ST段抬高即可确认心肌梗死模型制备成功[6]。再灌注时连同乳胶圈一并剪开结扎线,解除阻断血流。
1.4 各组小鼠处理方法
C组:以6-0带针线由冠脉下穿过,不结扎;I组:结扎冠脉30min;I/R组:结扎冠脉30min,再灌注1h;A202组及A102组:再灌注前2h予阿托伐他汀20mg/kg或10mg/kg灌胃,结扎冠脉30min,再灌注1h;AL202组:再灌注前2h予阿托伐他汀20mg/kg灌胃,结扎冠脉15min(即再灌注前15min)时予L-NAME 15mg/kg尾静脉注射,至结扎冠脉30min后再灌注1h。均以IVCT技术摘取心脏,其中5只小鼠心脏行冷冻置换、石蜡包埋,之后切片,行苏木素-伊红(HE)染色及Albumin免疫组织化学染色;另5只小鼠心肌组织采用 Western Blotting检测内皮型一氧化氮合酶(eNOS)、黏附连接蛋白(VE-cadherin)和紧密连接蛋白-5(Claudin-5)的表达水平。
1.5 IVCT与冷冻置换
将预先在液态氮(-196℃)中预冷的异戊烷-丙烷制成的冷冻剂(-193℃)直接倾倒在小鼠跳动的心脏组织表面,然后将小鼠迅速移到液态氮中。在液态氮中分离心脏组织后将心脏移到由干冰丙酮制冷的含2%多聚甲醛的丙酮溶液中(-80℃)进行冷冻至少48h,之后分别在-30℃、-10℃、4℃和室温下放置2h。纯丙酮脱水3次,每次1h。二甲苯透明,低温石蜡(50-52℃)温箱(60℃)过夜,混合蜡(56-58℃石蜡与低温石蜡按3∶1混合)孵育6h后包埋。
1.6 HE染色
将上述包埋的心脏组织切片(厚3μm),常规去石蜡后行HE染色,于显微镜下观察心肌微血管(约5μm)内红细胞灌注情况。
1.7 心肌间质Albumin水平检测
采用免疫组化染色法。将上述石蜡切片常规去石蜡后用0.3%过氧化氢溶液去除内源性过氧化酶活性,之后用5%鱼精蛋白封闭,一抗(1∶100)4℃过夜,二抗(1∶1 000)室温孵育1h,ABC-DAB显色5min,0.04%锇酸处理1min,以降低背景,增加显色对比效果。显微镜下观察,拍照。每只小鼠随机抽取5张显微照片(每组共25张),观察记录心肌间质内Albumin染色强度,分为5级:阴性(-),弱阳性(±),阳性(+),中强度阳性(2+),强阳性(3+)。结果分别来自3名观察者。Albumin阳性呈棕黄色。
1.8 心肌组织蛋白表达的检测
采用Western Blotting。取-80℃冻存的各组心肌组织,参考文献[7]方法配制细胞裂解液,提取胞浆总蛋白,按BCA蛋白含量测定试剂盒说明书进行蛋白定量,SDS-PAGE后蛋白转印于PVDF膜,一抗孵育:分别加入兔源性抗eNOS抗体(1∶500)、抗Claudin-5抗体(1∶200)及山羊源性抗VE-Cadherin抗体(1∶100);4℃封闭过夜,洗膜后二抗孵育:加入羊抗兔二抗,驴抗山羊二抗(1∶500),室温孵育1h。洗膜后于暗室中行ECL显色。用凝胶图像处理系统(Gel-Pro-Analyzer软件)分析目标条带和β-actin条带的光密度值,用两者比值表示其相对表达量。
1.9 统计学处理

2结果
2.1 各组小鼠心肌血流灌注情况比较
显微镜下,C组可见大量具有方向性和流动状态的降落伞样红细胞保存在心肌细胞间的各级血管内,心肌细胞界限清晰。I组和I/R组血管内红细胞形态不一,或破碎,部分血管内红细胞明显减少或缺如,心肌细胞肿胀,界限模糊。与I/R组相比,A202组心肌细胞界限较清晰,降落伞样红细胞的顶端指向血流方向。A102组镜下所见与A202组类似,但微血管内红细胞数量、形态及心肌细胞界限等不及A202组。AL202组可见心肌细胞肿胀,微血管内红细胞减少、缺如,存在少量破碎红细胞,但微血管血流灌注情况仍优于I/R组。见图1。
2.2 各组小鼠心肌血管渗透性比较
免疫组织化学染色结果显示,C组Albumin主要分布于微血管内,间质、闰盘等处仅有少量分布。I组和I/R组微血管与心肌细胞界限模糊,结构破坏,Albumin向心肌间质渗出。与I/R组相比,A202组微血管、心肌细胞等各结构间界限清晰,Albumin主要分布于微血管内,向心肌间质等渗漏不明显。A102组与A202组类似,但微血管、心肌细胞等各结构间界限清晰程度稍差,Albumin向心肌间质的渗漏稍多。AL202组心肌细胞肿胀,各结构间界限模糊,Albumin向心肌间质内渗漏明显增多,但仍少于I/R组。见图2。各组Albumin免疫组织化学染色强度的统计学比较结果见表1。
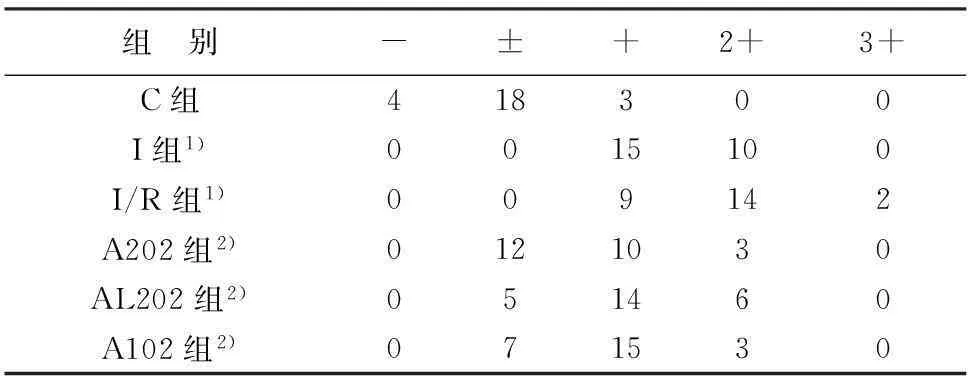
表1 各组心肌间质Albumin染色强度比较
注:与C组比较,1)P<0.05;与I组和I/R组比较,2)P<0.05
2.3 各组小鼠心肌组织eNOS、VE-cadherin、Claudin-5蛋白表达
2.3.1eNOS蛋白表达:I组和I/R组与C组比较,eNOS表达差异无统计学意义(P>0.05),A202组和A102组与I组和I/R组比较,eNOS表达均明显升高(P<0.01),A202组升高更明显(P<0.05)。AL202组与A202组比较,eNOS表达降低(P<0.05),且与I/R组差异无统计学意义(P>0.05)。见图3。
2.3.2VE-cadherin蛋白表达:与C组相比,I组和I/R组VE-cadherin蛋白表达显著降低(P<0.05)。A102和A202组VE-cadherin蛋白表达较I组和I/R组明显升高(P<0.05),A202组升高更明显(P<0.05)。AL202组VE-cadherin蛋白水平较I/R组升高(P<0.05)。见图4。
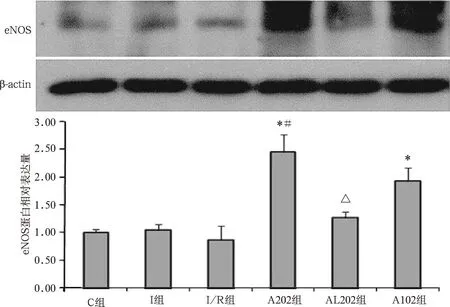
注:与I组和I/R组比较,*P<0.01;与A102组比较,
2.3.3Claudin-5蛋白表达:与C组相比,I组和I/R组Claudin-5蛋白表达显著降低(P<0.05)。A102和A202组Claudin-5蛋白表达较I组和I/R组明显升高(P<0.05),A202组升高更明显(P<0.05)。AL202组Claudin-5表达较I/R组升高(P<0.05)。见图5。
[本文图1、图2见封2]
3讨论
IRI是指组织、器官供血中断一定时间后再恢复血供时,组织器官功能障碍和结构损伤反而进一步加重的现象,是临床亟待解决的关键问题之一。再灌注过程中,冠脉血管内皮屏障受损、渗透性增加是构成IRI病理生理过程的基础,并可导致微血管受压、血管痉挛、血栓形成等一系列病理过程[8]。本文结果显示,I组和I/R组小鼠心肌血管内红细胞形态紊乱、破碎,部分区域红细胞明显减少或缺如,血管和心肌界限明显模糊,结构破坏,Albumin向心肌间质明显渗出。而A102组和A202组血管内红细胞数量较I/R明显增加,形态较I/R组明显改善,微血管和心肌细胞界限清晰,Albumin向间质渗漏不明显,尤以A202组作用更显著,表明再灌注前2h给予小鼠阿托伐他汀20mg/kg灌胃可明显改善缺血再灌注心肌微循环的血流状态及微血管渗透性,且效果优于10mg/kg,进一步证实了再灌注前短时间大剂量他汀类药物强化治疗的额外获益。

注:与C组比较,*P<0.05;与I/R组比较,#P<0.05;
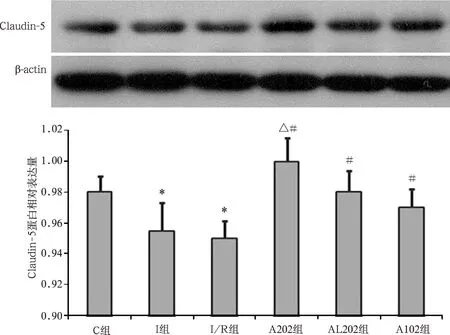
注:与C组比较,*P<0.05;与I/R组比较,#P<0.05;
构成血管内皮屏障的连接结构中,黏附连接主要由黏附连接蛋白Cadherin及Catenin组成,其中Cadherin的作用更为关键[9]。紧密连接则主要由紧密连接蛋白Occludins及Claudins等组成,既往研究报道Occludin缺失并不显著影响紧密连接的形态及内皮屏障功能[10],因而Claudin-5在调节紧密连接组成及血脑屏障功能中起重要作用[11],且可能是雌激素保护心血管内皮屏障新的作用靶点[12]。而本研究结果显示,阿托伐他汀预处理可明显改善缺血再灌注引起的心肌微血管渗透性增加,改善内皮细胞间黏附连接蛋白VE-cadherin和紧密连接蛋白Claudin-5的表达,且该作用不可能被L-NAME所完全消除,进一步证实阿托伐他汀对缺血再灌注过程中细胞间连接蛋白的保护作用,而且该保护作用并非既往研究认为的完全通过eNOS/NO途径实现[13],其具体机制可能与他汀类药物对微血管中RhoA(一种小GTP酶)/Rho激酶通路活性的抑制作用相关[14]。
传统组织制备方法因血液组分丢失及可溶性血清蛋白移位等问题易致微环境内的人工假象,故检测心脏IRI微血管渗透性多需通过尾静脉注射伊文斯蓝等染色剂,观察其在心脏大体标本中的渗出来完成。本研究应用IVCT技术实现了活体状态下于微循环水平直接评估血流状态及微血管渗透性的变化,具备良好的可信性。
综上,本研究证实再灌注前短时间内大剂量阿托伐他汀强化治疗可明显改善缺血再灌注心肌微循环血流状态,降低微血管渗透性,并可增加内皮细胞间连接蛋白VE-cadherin、Claudin-5等的表达,其机制不完全依赖于eNOS/NO途径。
◀
赵世杰(1982—),男,满族,博士,主治医师,从事冠心病的临床防治研究
参考文献
1Wallez Y, Huber P. Endothelial adherens and tight junctions in vascular homeostasis, inflammation and angiogenesis[J]. Biochim Biophys Acta,2008,1 778(3):794-809.
2Haidari M, Zhang W, Chen Z, et al. Atorvastatin preserves the integrity of endothelial adherens junctions byinhibiting vascular endothelial cadherin tyrosine phosphorylation[J]. Exp Cell Res, 2012, 318(14): 1 673-1 684.
3Iliodromitis EK, Andreadou I, Prokovas E, et al. Simvastatin in contrast to postconditioning reduces infarct size in hyperlipidemic rabbits: possible role of oxidative/nitrosative stress attenuation[J]. Basic Res Cardiol,2010,105(2):193-203.
4Tuuminen R, Syrjala S, Krebs R, et al. Donor simvastatin treatment abolishes rat cardiac allograft ischemia/reperfusion injury and chronic rejection through microvascular protection[J]. Circulation,2011,124(10):1 138-1 150.
5Ke Q, Yang Y, Rana JS, et al. Embryonic stem cells cultured in biodegradable scaffold repair infarcted myocardium in mice[J]. Sheng Li Xue Bao,2005,57(6):673-681.
6Shi L, Li Z, Zhai X, et al. Application of "in vivo cryotechnique" to morphological and immunohistochemical analyses of living mouse subepicardial microcirculation under various pathological conditions[J]. Appl Immunohistochem Mol Morphol,2012,20(3):304-317.
7Hori H, Sasaoka T, Ishihara H, et al. Association of SH2-containing inositol phosphatase 2 with the insulin resistance of diabetic db/db mice[J]. Diabetes,2002,51(8):2 387-2 394.
8Schmauss D, Weis M. Cardiac allograft vasculopathy: recent developments[J]. Circulation,2008,117(16):2 131-2 141.
9Potter MD, Barbero S, Cheresh DA. Tyrosine phosphorylation of VE-cadherin prevents binding of p120 and beta-catenin and maintains the cellular mesenchymal state[J]. J Biol Chem,2005,280(36):31 906-31 912.
10Furuse M. Knockout animals and natural mutations as experimental and diagnostic tool for studying tight junction functions in vivo[J]. Biochim Biophys Acta,2009,1 788(4):813-819.
11Morofuji Y, Nakagawa S, So G, et al. Pitavastatin strengthens the barrier integrity in primary cultures of rat brain endothelial cells[J]. Cell Mol Neurobiol,2010,30(5):727-735.
12Burek M, Arias-Loza PA, Roewer N, et al. Claudin-5 as a novel estrogen target in vascular endothelium[J]. Arterioscler Thromb Vasc Biol,2010,30(2):298-304.
13Balakumar P, Kathuria S, Taneja G, et al. Is targeting eNOS a key mechanistic insight of cardiovascular defensive potentials of statins?[J]. J Mol Cell Cardiol,2012,52(1):83-92.
14Liu PY, Liu YW, Lin LJ, et al. Evidence for statin pleiotropy in humans: differential effects of statins and ezetimibe on rho-associated coiled-coil containing protein kinase activity, endothelial function, and inflammation[J]. Circulation,2009,119(1):131-138.
作者简介:本文第一
*[基金项目]国家自然科学青年基金项目(81200083);教育部重点实验室课题(KF201312)
[中图分类号]R541.4
[文献标识码]A
[文章编号]1005-1740(2015)04-0001-06
doi:10.3969/j.issn.1005-1740.2015.04.001
微循环学杂志,2015,25(4):1-6
© 2015 CHINESE JOURNAL OF MICROCIRCULATION