初发2型糖尿病患者内脂素与铁代谢关系研究*
孙 雪,张亚华,徐淑静,时立新,彭年春,张 巧
(1.湖北医药学院附属东风总医院内分泌科,湖北十堰442008;2.贵阳医学院附属医院急诊内科,贵阳550004;3.贵阳医学院附属医院内分泌科,贵阳550004)
肥胖与2型糖尿病关系密切,胰岛素抵抗被认为是肥胖和2型糖尿病发病的重要环节之一。内脂素主要由内脏脂肪组织分泌的一种脂肪细胞因子,其表达水平高的组织是内脏脂肪、肝脏,其次是肌肉,这些组织与胰岛素敏感性、铁代谢密切相关[1]。内脂素在骨髓中也有较高的表达,而骨髓是循环铁的主要来源[2]。内脂素在富含铁的组织中高度表达,而内脂素与铁代谢均可能与胰岛素抵抗有关,那么内脂素和铁代谢之间是否存在着某种联系,目前这方面的研究国外鲜有报道,国内尚未见报道。本研究通过检测内脂素及3个反应铁代谢的重要指标[血清铁蛋白、铁调素、可溶性转铁蛋白受体(sTfR)]水平,研究初发2型糖尿病患者上述指标的变化及其之间的关系,现报道如下。
1 资料与方法
1.1 一般资料 选择2011年4月至2012年12月在本院就诊的初发2型糖尿病患者85例,同期选取年龄和性别与之相匹配的健康体检者86例。171例受试对象被分为健康对照组(A组)43例、正常体质量初发2型糖尿病组(B组)43例、单纯性肥胖组(C组)43例、肥胖初发2型糖尿病组(D组)42例。根据2003年卫生部公布的《中国成人超重和肥胖症预防与控制指南》,肥胖诊断:体质量指数(BMI)18.5~23.9kg/m2为正常,≥28kg/m2为肥胖。糖尿病者均符合1999年WHO糖尿病诊断和分型标准,对照组及单纯性肥胖组均经75g口服葡萄糖耐量试验(OGTT)排除糖尿病、空腹血糖受损及糖耐量减量。为排除月经对铁代谢的影响,受试对象选择男性及绝经后女性。纳入标准:(1)无急慢性感染、贫血、血色病、肿瘤、嗜酒;(2)无急、慢性肝病史,肝功能正常;(3)无心、肾功能不全及其他内分泌疾病;(4)近1年未服用铁剂,无输血、静脉用过大剂量糖皮质激素、免疫调节剂史;(5)无手术、外伤等应激情况。(6)所有糖尿病患者均为初诊患者,均不伴糖尿病酮症、高血糖高渗状态等急性并发症。
1.2 方法
1.2.1 血清采集 受试者禁食12h,次晨空腹抽取肘静脉血5mL于室温静置2h,1 000r/min离心20min,分离血清,置于-80℃冰箱保存。血清铁蛋白的检测采用直接化学发光法,试剂由西门子医疗诊断设备有限公司提供;铁调素、sTfR的检测采用酶联免疫吸附法,试剂由美国R&D Systems公司提供。
1.2.2 数据测量 测定身高、体质量、腰围(WC),计算:BMI=体质量(kg)/身高(m2)。
1.3 统计学处理 数据采用PASW Statistics18.0统计分析软件包建立数据库及统计分析处理。计量资料服从正态分布描述用±s表示,其中三酰甘油不符合正态分布,将其转换为对数进行分析,4组间均数的比较采用方差分析及两两比较采用LSD法;内脂素与铁代谢指标之间的相关性采用Pearson相关分析和多元线性回归分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 4组基本特征比较 4组研究对象年龄、性别构成差异均无统计学意义(P>0.05);C组、D组腰围、BMI分别明显高于A组和B组(P<0.05),而C组与D组之间、A组与B组之间腰围、BMI无明显差异(P>0.05),具有可比性,见表1。
2.2 血清内脂素、铁蛋白、铁调素、sTfR水平比较 D组内脂素水平相对高于其他3组,B组血清铁蛋白及铁调素水平相对高于A组(P<0.05),D组血清铁蛋白及铁调素水平也相对高于A、B、C组(P<0.05);4组sTfR水平差异无统计学意义(P>0.05),见表2。
表1 4组研究对象基本特征(±s)
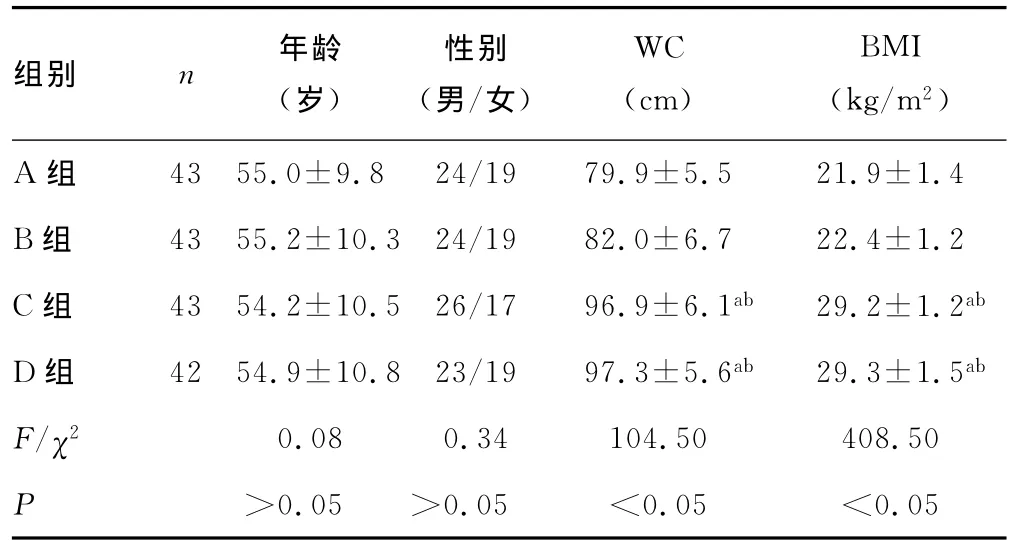
表1 4组研究对象基本特征(±s)
a:P<0.05,与 A组比较;b:P<0.05,与B组比较。
组别 n年龄(岁)性别(男/女)WC(cm)BMI(kg/m2)19 79.9±5.5 21.9±1.4 B组 43 55.2±10.3 24/19 82.0±6.7 22.4±1.2 C组 43 54.2±10.5 26/17 96.9±6.1ab 29.2±1.2ab D 组 42 54.9±10.8 23/19 97.3±5.6ab 29.3±1.5ab F/χ2 0.08 0.34 104.50 408.50 P>0.05 >0.05 <0.05 <A组 43 55.0±9.8 24/0.05
表2 4组血清内脂素、铁蛋白、铁调素、sTfR均值(±s)

表2 4组血清内脂素、铁蛋白、铁调素、sTfR均值(±s)
a:P<0.05,与 A组比较;b:P<0.05,与B组比较;c:P<0.05,与C组比较。
组别 n 内脂素(μg/L) 铁蛋白(ng/L) 铁调素(μg/L) sTfR(nmol/L)48±8.00 B组 43 17.62±4.97 249.10±151.20a 124.67±34.31a 29.93±7.82 C 组 43 17.30±5.47 207.30±123.90 112.50±38.69 32.75±7.97 D组 42 19.97±5.46abc 313.10±181.50abc 140.96±36.76abc 30.87±7.37 F 3.05 6.81 3.37 1.84 P A组 43 16.85±4.79 185.40±88.70 108.86±36.93 29.0.03 0.00 0.02 0.14
2.3 内脂素与铁代谢指标相关分析结果 采用Person相关分析法进行研究,4组研究对象血清内脂素与血清铁蛋白、铁调素、可溶性转铁蛋白无相关性(P>0.05)。(1)A组:r分别为0.059、-0.142、0.161,P>0.05;(2)B 组:r分 别 为-0.072、0.153、-0.250,P>0.05;(3)C 组:r分 别 为-0.049、-0.027、0.276,P>0.05;(4)D 组:r分别为0.174、0.189、0.080,P>0.05。
2.4 内脂素与其他因素多元回归分析 以内脂素为应变量,进行多元线性逐步回归分析,提示血清铁蛋白、铁调素、可溶性转铁蛋白均不为内脂素独立相关因素(r=0.111,P>0.05)。
3 讨 论
目前国内外有关研究中,肥胖、2型糖尿病患者血清内脂素水平既有升高,又有降低或无明显差异的报道[3-5]。本研究结果显示肥胖糖尿病组血清内脂素水平较其他3组增高,但未发现正常体质量糖尿病组、单纯性肥胖组与对照组之间血清内脂素有差异,其意义有待进一步研究。
血清铁蛋白现多用来表示铁储存情况,是判断体内铁缺乏及铁超负荷的有效指标之一。铁调素是一种极为重要的铁调节激素[6],其通过对铁的代谢的2个重要途径即铁在十二指肠上皮细胞的吸收过程和铁在巨噬细胞重吸收利用中产生影响而改变铁的代谢[7-8]。转铁蛋白受体是细胞膜上的一种跨膜糖蛋白,能特异性地与血浆携铁的转铁蛋白结合并经受体介导的内吞作用将铁运至细胞内,其表达主要是根据细胞内铁水平进行转录后水平的调节[9]。铁超载可致铁调素增加,下调血清sTfR水平,从而抑制肠道铁吸收及网状内皮系统巨噬细胞铁的释放,储存铁的动员减少[10]。本研究发现,血清铁蛋白在初发2型糖尿病组尤其是肥胖糖尿病组明显增高,提示初发2型糖尿病患者体内可能存在铁超载,这与Arredondo等[11]研究一致。铁调素水平与血清铁蛋白类似,在初发2型糖尿病组表达增高,与Jiang等[12]研究结果一致。本研究未发现4组研究对象之间sTfR水平有差异,其意义有待于进一步研究。
目前国内尚未见2型糖尿病患者血清内脂素与铁蛋白、铁调素、sTfR之间关系的研究报道。本研究未发现4组研究对象血清内脂素与铁代谢指标血清铁蛋白、铁调素、sTfR之间存在相关性,考虑初发2型糖尿病患者血清内脂素与铁代谢之间可能无关。虽内脂素表达高的组织恰好与铁代谢相关组织有关,但两者可能以各自不同的机制在体内发挥作用。本研究结果与Fernández-Real等[13]研究结果不一致,该研究发现在正常糖耐量组血清内脂素与铁代谢指标均不相关,但在2型糖尿病及糖调节受损患者(包括空腹血糖受损、糖耐量减低)血清内脂素与sTfR呈负相关,与铁调素前体呈正相关。进一步将后者分为肥胖及非肥胖组,血清内脂素分别亦与铁调素前体正相关,并发现糖代谢异常合并低sTfR浓度患者内脂素水平高,认为铁储存增加会导致内脂素合成增加,在正常糖耐量者内脂素与铁代谢失去关联可能需要界定一个铁超载的阈值。但该研究中研究对象并非均为2型糖尿病患者,且例数较少,其中2型糖尿病患者仅18例、糖调节受损患者25例;其次,该研究肥胖标准是BMI大于30kg/m2,非肥胖标准为BMI小于30 kg/m2;再者,该研究分析的是铁调素前体而非铁调素。Young等[14]研究认为,铁调素前体不能准确反映铁调素的浓度,铁调素前体不是一个可用于临床或研究的有用指标。这些因素可能在一定程度上影响了研究结果。
综上所述,内脂素与铁代谢可能无关,两者可能通过各自不同的机制在体内发挥作用,这还需进一步深入研究。
[1] Saddi-Rosa P,Oliveira CS,Giuffrida FM,et al.Visfatin,glucose metabolism and vascular disease:a review of evidence[J].Diabetol Metab Syndr,2010,2:21.
[2] Samal B,Sun Y,Stearns G,et al.Cloning and characterization of the cDNA encoding a novel human pre-B-cell colony-enhancing factor[J].Mol Cell Biol,1994,14(2):1431-1437.
[3] Kaminska A,Kopczynska E,Bronisz A,et al.An evaluation of visfatin levels in obese subjects[J].Endokrynol Pol,2010,61(2):169-173.
[4] Koerner A,Boettcher Y,Enigk B,et al.Effects of genetic variation in the visfatin gene(PBEF1)on obesity,glucose metabolism,and blood pressure in children[J].Metabolism,2007,56(6):772-777.
[5] Boettcher Y,Teupser D,Enigk B,et al.Genetic variation in the visfatin gene(PBEF1)and its relation to glucose metabolism and fat-depot-specific messenger ribonucleic acid expression in humans[J].J Clin Endocrinol Metab,2006,91(7):2725-2731.
[6] Le Gall JY,Jouanolle AM,Mosser J,et al.Human Iron metabolism[J].Bull Acad Natl Med,2005,189(8):1635-1647.
[7] Frazer DM,Anderson GJ.The orchestration of body iron intake:how and where do enterocytes receive their cues?[J].Blood Cells Mol Dis,2003,30(3):288-297.
[8] Nemeth E,Tuttle MS,Powelson J,et al.Hepcidin regulates cellular iron efflux by binding to ferroportin and inducing its internalization[J].Science,2004,306(5704):2090-2093.
[9] 蔡迪娅,常艳敏.转铁蛋白受体及可溶性转铁蛋白受体[J].中国医学检验杂志,2011,12(2):94-96.
[10] Ausk KJ,Ioannou GN.Is obesity associated with anemia of chronic disease?A population-based study[J].Obesity,2008,16(10):2356-2361.
[11] Arredondo M,Fuentes M,Jorquera D,et al.Cross-Talk between body iron stores and diabetes:iron stores are associated with activity and microsatellite polymorphism of the heme oxygenase and type 2diabetes[J].Biol Trace Elem Res,2011,143(2):625-636.
[12] Jiang F,Sun ZZ,Tang YT,et al.Hepcidin expression and iron parameters change in Type 2diabetic patients[J].Diabetes Res Clin Pract,2011,93(1):43-48.
[13] Fernández-Real JM,Moreno JM,Chico BA,et al.Circulating visfatin is associated with parameters of iron metabolism in subjects with altered glucose tolerance[J].Diabetes Care,2007,30(3):616-621.
[14] Young MF,Glahn RP,Ariza-Nieto MA,et al.Serum hepcidin is significantly associated with iron absorption from food and supplemental sources in healthy young women[J].Am J Clin Nutr,2009,89(2):533-538.

