龙葵碱对人结肠癌鸡胚移植模型血管生成的影响*
张 桃,谢 铭,贺新媛,杨雪峰
(遵义医学院附属医院胃肠外科,贵州遵义563000)
结肠癌是消化道最常见的恶性肿瘤之一,其发生、发展及转移与肿瘤血管生成密切相关,因此抑制肿瘤血管生成过程对于抗肿瘤研究有着重要意义。寻找高效、低毒、较少产生耐药性的血管生成抑制剂是抗肿瘤血管生成治疗的热点之一。作为传统中草药龙葵,其提取物龙葵碱,近年来备受关注,龙葵碱在抗肿瘤方面已取得了较好的成果,但能否抑制人结肠癌诱导的血管生成,使肿瘤发展受到影响,至今无相关报道。因此设计本实验观察龙葵碱对人结肠癌HT-29细胞株移植瘤的血管生成的影响,现报道如下。
1 材料与方法
1.1 材料 人结肠癌细胞系HT-29细胞株由遵义医学院中心实验室提供。实验试剂RPMI 1640培养基、南美胎牛血清、胰蛋白酶为Hyclone公司产品。龙葵碱(纯度95%)购自陕西慈缘生物技术有限公司;明胶海绵由遵义医学院附属医院赠送。受精鸡蛋购自广东南雄养鸡场,平均55~60g/个,全自动数显型孵化机购自德州德兴孵化设备有限公司。
1.2 方法
1.2.1 细胞培养 HT-29细胞生长于含10%灭活胎牛血清的RPMI 1640培养基中,37℃、5%CO2及饱和湿度的恒温培养箱中培养,3~5d传代1次,实验时采用对数生长期的细胞。
1.2.2 鸡胚孵育 将受精鸡蛋予以高锰酸钾液消毒后,气室向上置于温度为38.2℃、湿度60%的孵化机中孵育,每天翻蛋1次。
1.2.3 龙葵碱液的制备 将纯度95%的龙葵碱5mg溶于1 mL二甲基亚砜(DMSO)液中,用磷酸盐缓冲液(phosphate buffered saline,PBS)999mL调整含龙葵碱的 DMSO,使DMSO液浓度在0.1%以下,抽取100mL含龙葵碱的PBS液分别溶于30、40、50mL的 PBS液,配置成剂量为150、200、250 μg/mL的龙葵碱,无菌保存备用。
1.2.4 明胶海绵制备 将明胶海绵剪成大小约0.5mm×0.5mm,无菌保存备用。
1.2.5 人结肠癌鸡胚移植模型的建立
1.2.5.1 鸡胚绒毛尿囊膜(CAM)制备 参照参考文献[1]方法并加以改进,在照蛋器下,选取孵育至9d生长较好的鸡胚,距胎头下方0.5~1.0cm处划定开窗位置,其大小约1cm×1 cm,予75%乙醇消毒后置于超净台上,用无菌锯片在鸡胚上沿划定的开窗大小轻轻划开,用无菌眼科镊沿开口打开蛋壳,用5mL的无菌注射器刺破卵壳膜,并加入无菌生理盐水1滴后使卵壳膜与CAM分离,制造人工气室后去除卵壳膜后暴露CAM。
1.2.5.2 HT-29细胞接种 取生长对数期的细胞,消化、离心,用PBS调整细胞数为4×106个/mL[2],以制作好的明胶海绵为载体,取20μL HT-29细胞悬液接种于CAM相对无血管区域。用无菌封口膜封口,置于孵化机继续孵育。
1.2.6 分组治疗 将接种HT-29细胞的鸡胚于继续孵育后的第2天,分为对照组10个和实验组(低、中、高剂量)各10个。实验组去除封口膜后分别加入20μL,剂量为150、200、250μg/mL的龙葵碱,做好标记;对照组给予等量的PBS。封口膜封口后继续孵育5d,每天观察鸡胚的生长情况及血管特性。
1.2.7 固定取膜 给药后第5天,用4%的甲醛溶液原位固定移植瘤15~20min,以接种区为中心用眼科镊剪下CAM,平铺于平皿中立体显微镜拍照,收集CAM上移植瘤血管图片,用Image-pro plus 6.0图像分析软件处理图像,收集数据;取下的移植瘤进行苏木精-伊红(HE)染色,常规石蜡包埋、切片,采用Envision二步法,检测肿瘤组织的CD34抗原标记的微血管密度(MVD)及ki-67抗原表达。
1.3 统计学处理 采用SPSS17.0统计软件进行统计分析,计量资料用±s表示,采用方差分析,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 HT-29细胞移植后肿瘤新生血管的生成 接种HT-29细胞24h内,细胞呈淡白色黏附于CAM接种区,除CAM上原有的正常血管外,未见明显的血管变化。2d后接种区域的癌细胞开始聚集,并可见少量微细的血管向瘤体集中。3~5d后移植瘤迅速生长,直径可达5mm,大量的新生血管接近肿瘤组织,呈放射状,部分血管长入或跨越瘤体表面,排列紊乱,甚至原有的CAM上粗大血管也向移植瘤靠近,瘤体也由最初的苍白色变成深褐色,部分瘤体表面有白色小点,同时鸡胚活动明显,见图1。
表1 不同剂量的龙葵碱对微血管面积、MVD、ki-67抗原的影响(±s)

表1 不同剂量的龙葵碱对微血管面积、MVD、ki-67抗原的影响(±s)
a:P<0.01,与对照组比较。
组别 微血管面积 MVD ki-67抗原低剂量 13.21±0.89a 24.45±3.86a 34.12±3.48a中剂量 11.53±0.82a 20.30±3.68a 28.24±3.33a高剂量 8.92±0.79a 16.40±3.51a 24.74±2.31a对照组22.91±1.45 37.83±4.03 58.75±4.29
2.2 龙葵碱对肿瘤微血管面积及ki-67抗原的作用 在实验组中,应用Image-pro plus 6.0图像分析软件定量处理图片和收集数据后,结果表明:不同给药剂量的龙葵碱,CAM移植后肿瘤的微血管面积分别为(13.21±0.89)、(11.53±0.82)、(8.92±0.79),明显低于对照组(22.91±1.45)(P<0.01),其组间的微血管面积也有明显差异(P<0.01),见表1、图2。
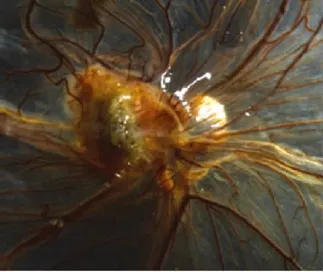
图1 HT-29细胞移植后肿瘤新生血管的生成
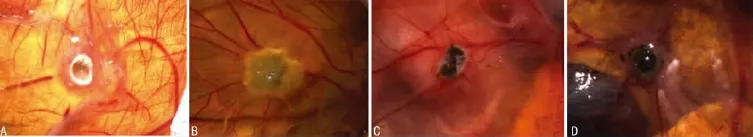
图2 不同剂量龙葵碱血管新生面积

图3 不同剂量龙葵碱ki-67抗原表达

图4 不同剂量龙葵碱CD34抗原表达
对移植瘤行HE染色后,光镜下可见瘤体组织结构与人结肠腺癌组织相似,表现为细胞分化差,异型性明显,核分裂相常见。部分肿瘤组织形成类似腺管样组织。免疫组织化学显示随着龙葵碱剂量的增加,肿瘤MVD也相应降低,且具有剂量依赖性,各组间差异有统计学意义(P<0.01),明显低于对照组(37.83±4.03)(P<0.01),与微血管面积的降低程度相一致;ki-67抗原表达分别为(34.12±3.48)、(28.24±3.33)和(24.74±2.31),与龙葵碱剂量呈负相关(r=-0.789),同时低于对照组(58.75±4.29)(P<0.01),且各组间差异有统计学意义(P<0.01),见表1,图3、4。
3 讨 论
现有的临床研究表明,中药龙葵的提取物能通过诱导细胞凋亡、改变细胞膜通透性以及抑制血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达等多种途径达到抗肿瘤作用。Lin等[3]、高世勇等[4]研究发现龙葵提取物能增加Bcl-2相关X蛋白的表达、下调B淋巴细胞瘤-2蛋白,使B淋巴细胞瘤-2蛋白/Bcl-2相关X蛋白比值下降,激活caspase家族的活性,诱导细胞凋亡;也有文献报道龙葵碱也可通过活化卡巴蛋白的表达,抑制核转录因子传导通路而诱导细胞凋亡[5-6];同时研究发现龙葵碱能显著降低膜电位,开放线粒体通透性转变孔道,使细胞外Ca2+顺浓度梯度转运至细胞内,使细胞内 Ca2+升高启动细胞凋亡机制[7];季宇彬等[8]研究发现龙葵碱能增加细胞内α-微管蛋白,使细胞内微管系统发生紊乱,细胞阻滞在S期,从而抑制乳腺癌MCF-7细胞的“正常”代谢。常乐等[9]研究表明龙葵多糖粗提物能使人胃癌 MGC-803细胞在G0/G1期和G2/M期的数量下降,阻止细胞周期的进程。聂巧珍等[10]研究表明激光照射联合龙葵多糖能抑制细胞中VEGF mRNA的表达,导致新生血管受到抑制,肿瘤组织增生程度减弱。但龙葵碱是否能抑制结肠癌细胞诱导的血管发生与发展未见报道。本实验发现将不同剂量的龙葵碱于接种HT-29细胞成活鸡胚模型中2d后加入接种区域,3~5d后肿瘤组织与对照组相比较,周围血管数明显减少,肿瘤组织生长缓慢,且随着龙葵碱的剂量增加,新生血管减少越显著,表现为剂量依赖性。推测龙葵碱可能通过抑制血管内皮细胞的增殖、转移,改变内皮细胞通透性,甚至引起内皮细胞凋亡,继而使新生血管生成减少,肿瘤组织发生缺血坏死。龙葵碱对肿瘤血管内皮细胞的影响机制有待进一步研究。
肿瘤血管的生成是在宿主微血管床基础上,由肿瘤组织诱导内皮细胞增殖和迁移而产生管型血管的过程,也是肿瘤生长、侵袭和转移的必要条件。目前对鸡胚尿囊膜新生血管面积的计数方法主要有:直接计数CAM上血管数目,另一个是应用Image-pro plus 6.0图像分析软件对图片进行分析,后者可靠程度高,避免了人为因素的影响而造成的误差,本实验用Image-pro plus 6.0图像分析软件分析龙葵碱抑制人结肠癌诱导的CAM新生血管,发现不同给药剂量的CAM上血管新生面积明显低于对照组,差异有统计学意义(P<0.01)。证实了龙葵碱对肿瘤血管有着明显的影响,可致肿瘤生长缓慢。
MVD与肿瘤组织分级、生长、侵袭及转移密切相关,可以作为恶性肿瘤生物学行为的主要参数。目前诸多学者较多采用CD31、CD34或者Ⅷ因子抗体标记血管内皮细胞,运用Weidner技术对标记的细胞计数,进而检测MVD[11]。本研究发现龙葵碱组MVD值明显低于对照组MVD(P<0.01),且不同剂量间的MVD值差异有统计学意义(P<0.01)。提示龙葵碱能降低肿瘤MVD值,抑制肿瘤组织生长,可影响肿瘤的侵袭及转移。
Ki-67抗原与肿瘤细胞增殖标记的相关核抗原,主要分布于细胞核中,其作用与细胞的有丝分裂密切相关,不表达于细胞的G0期,S、G2期开始升高,在 M期达到高峰。研究显示Ki-67蛋白表达对早期诊断结直肠癌有较高的价值[12],其表达越高,显示肿瘤组织恶性越高,但与结直肠癌组织是否有转移及淋巴结转移等无相关性。结果表明Ki-67抗原可反映肿瘤组织增生情况,为研究抗肿瘤增殖提供重要依据。本研究结果表明,不同剂量的龙葵碱干扰HT-29细胞移植瘤中Ki-67抗原的表达明显低于对照组,且随着剂量的增加,低表达越显著,其差异有统计学意义(P<0.01)。这现象是龙葵碱直接作用于瘤体组织,还是通过抑制肿瘤诱导的新生血管而抗肿瘤作用,或者同时作用于二者,还待进一步研究。同时在本实验研究中发现,ki-67的免疫表达背景像更多的脂肪组织,染色较浅,这可能受鸡胚活动的影响。
综上所述,中药龙葵的提取物龙葵碱能明显抑制鸡胚尿囊膜模型上人结肠癌诱导的微血管的生长,阻断了肿瘤组织生长需要的营养物质,从而达到抗肿瘤增殖作用,为临床指导龙葵碱治疗肿瘤方面提供了新的依据。
[1] 付生法,陆应磷,张朝山,等.检测血管生长因子作用的鸡胚绒毛尿囊膜技术[J].军事医学科学院刊,1993,17(4):294-297.
[2] 陈茂松,黄卓垣,张进华,等.人大肠癌鸡胚移植模型的建立及其形态学和肿瘤生物学研究[J],解放军医学杂志,1998,23(4):284-286.
[3] Lin HM,Tseng HC,Wang CJ,et al.Induction of autophagy and apoptosis by the extract of Solanum nigrum Linn in HepG2cells.[J]Agric Food Chem,2007,55(9):3620-3628.
[4] 高世勇,徐丽丽,季宇彬.龙葵碱调控Bcl-2与Bax蛋白表达及caspase-3活性诱导HepG2细胞凋亡的研究[J].中草药,2009,40(10):1607-1612.
[5] 章俊,施国伟.龙葵碱对前列腺癌细胞系PC-3的体外抑制作用[J],中华男科学杂志,2011,17(3):284-287.
[6] Wang HC,Wu D H,Chang YC,et al.Solanum nigrum Linn.water extract inhibits metastasis in mouse melanoma cells in vitro and in vivo[J],Agric Food Chem,2010,58(22):11913-11923.
[7] 季宇彬,高世勇.龙葵碱诱导HepG2细胞凋亡的线粒体通路研究[J].中国药学杂志,2008,43(4):272-275.
[8] 季宇彬,刘家源,高世勇.龙葵碱对乳腺癌MCF-7细胞微管系统的影响[J].中草药,2012,43(1):111-114.
[9] 常乐,刘艺.龙葵多糖对人胃癌MGC-803细胞增殖的影响[J].牡丹江医学院学报,2012,33(4):24-26.
[10] 聂巧珍,韩伊林,苏秀兰.激光照射联合龙葵多糖对荷瘤小鼠肿瘤增殖的影响[J].内蒙古中医药,2007,26(10):37-38.
[11] Weidner N,Folkm an J,Pozza F,et al.Tumor angiogenesis:a new significant and independent prognostic indicator in early stage breast carcinoma[J].J Natl Cancer Inst,1992,84(24):1875-1887.
[12] 王玉环,王春,孙振柱.Her-2、P-53和Ki-67在结直肠癌中的表达及意义[J].临床荟萃,2011,26(14):1228-1232.

