蓝莓对四氯化碳所致急性肝损伤大鼠肝组织GCLC mRNA及蛋白表达的影响*
赵雪珂,吴荣敏,姚玉梅,田 涛,周明玉,张宝芳
(1.贵阳医学院附属医院感染科,贵阳550004;2.贵州省妇幼保健院功能科,贵阳550003;3.贵州省思南县人民医院感染科 565100)
蓝莓富含花青素、超氧化物歧化酶(SOD)等多种营养成分,是一种天然的具有抗氧化功能的食品,可改善记忆力、降血压、防癌等[1-4]。近年国内外研究发现,蓝莓可减轻四氯化碳(CCl4)、D-半乳糖胺和脂质多糖诱导的急性肝损伤,可能与蓝莓的抗氧化活性有关[5-6]。为进一步明确蓝莓减轻大鼠急性肝损伤的可能机制,本实验用CCl4诱导大鼠急性肝损伤模型,采用实时荧光PCR、免疫组织化学、Western blot方法检测蓝莓对急性肝损伤大鼠肝组织中γ-谷氨酰半胱氨酸合成酶催化亚基(GCLC)的mRNA及蛋白表达的影响,现报道如下。
1 材料与方法
1.1 材料
1.1.1 实验动物 雄性 Wistar大鼠50只,清洁级,体质量(180±20)g,购自重庆医科大学实验动物中心[批号SCXK(渝)2007-0001]。普通饲料喂养,自由饮水,自然采光,室温15~25℃,实验前适应环境1周。
1.1.2 实验材料 蓝莓(兔眼品种),贵州省麻江县蓝莓基地提供,-20℃保存,临用时解冻榨汁,2g干果榨汁1mL。联苯双酯(北京协和药厂,批号11020980)。
1.1.3 主要试剂 CCl4分析纯(成都市科龙化工,批号20121019),丙二醛(MDA)、过氧化氢酶(CAT)、SOD、还原型谷胱甘肽(GSH)检测试剂盒(南京建成,批号20130226,20130215,20130218,20130228),GCLC 一 抗 (英 国 abcam,ad80841),GCLC上游引物序列:5′-TGG CCA CTA TCT GCC CAA TT-3′,下 游 引 物 序 列:5′-CCC CAG CGA CAA TCA ATG TC-3′,引物扩增片段长度213bp;β-actin上游引物序列:5′-TCC TCC TGA GCG CAA GTA CTC T-3′,下游引物序列:5′-GCT CAG TAA CAG TCC GCC TAG AA-3′,引物扩增片段长度1 536bp,均由上海生工生物工程有限公司合成。
1.1.4 主要仪器 752紫外分光光度计(上海菁华科技),核酸定量仪(美国Amersham Biosciences),核酸扩增实时荧光检测系统(DA7600型,中山大学达安基因),Gel Doc EQ凝胶成像仪(美国Bio-Rad),显微图像采集系统(日本Olympus)等。
1.2 方法
1.2.1 动物分组及处理 将大鼠分为5组,即空白组、模型组、蓝莓汁低剂量预防组(蓝低组)、蓝莓汁高剂量预防组(蓝高组)、联苯双酯预防组(联苯双酯组),每组10只。蓝低组、蓝高组及联苯双酯组大鼠按文献[7-8]分别予10.0、20.0g/kg及0.15g/kg剂量灌胃,1次/天,连续7d,模型组和空白组灌胃等容量0.9%氯化钠溶液。末次给药后1h,参照文献[7]的方法,除空白组外,其余4组大鼠分别腹腔注射20%CCl4花生油溶液5mL/kg,空白组大鼠腹腔注射等容量0.9%氯化钠溶液。全部大鼠禁食,自由饮水,间隔24h后,采用腹股沟动脉采血,常规制备血清,全自动生化分析仪测定丙氨酸氨基转移酶(ALT)及天冬氨酸氨基转移酶(AST)活性。大鼠麻醉后处死,制备肝组织匀浆,严格按试剂盒操作测定各组大鼠肝匀浆MDA、CAT、SOD、GSH水平。
1.2.2 肝脏组织形态学观察 取相同部位肝脏用4%甲醛固定,石蜡包埋,切片,行苏木精-伊红(HE)染色,光镜下观察肝脏病理变化。
1.2.3 反转录PCR(RT-PCR)检测GCLC基因转录水平 采用Trizol-酚-氯仿一步法提取总RNA并纯化,测定RNA浓度,逆转录合成cDNA后行RT-PCR。实验过程中以β-actin作内对照,进行标准化转换得到各样本的拷贝数(Ct值)。以Ct值的均数来反映目的基因的表达。
1.2.4 免疫组织化学法检测GCLC蛋白的表达 采用EnVision二步法,光镜下观察。结果判定:肝细胞胞质染成棕黄色为阳性。每张切片随机选取5个高倍视野(×400),计数100个细胞中的阳性细胞百分比。
1.2.5 Western Blot检测GCLC蛋白的表达 提取蛋白并测定蛋白含量,取蛋白质样品40μg,10%十二烷基-聚丙烯酰胺凝胶电脉(SDS-PAGE)电泳,转膜,封闭,用 GCLC抗体(1∶1 000)4℃孵育过夜,二抗(1∶3 000)室温1h,ECL曝光显影,Gel Doc EQ凝胶成像仪扫描,Quantity One软件分析结果。以β-actin表达水平作为内参照,目标蛋白的表达量以目标蛋白与内参照蛋白灰度值的相对比值表示。
1.3 统计学处理 采用SPSS16.0统计学软件进行分析。计量资料以±s表示,多组间比较采用单因素方差分析,组间两两比较时,方差齐的情况采用LSD法,方差不齐的情况采用Tamhane法,以P<0.05为差异有统计学意义。
2 结 果
2.1 肝组织病理学观察 空白组大鼠肝小叶结构清晰,肝细胞以中央静脉为中心呈放射性排列,肝细胞无变性、坏死,汇管区无炎性细胞浸润。模型组大鼠肝细胞弥漫性水肿及脂肪变性,中央静脉周围肝细胞大片状坏死,炎性细胞浸润。蓝低组和模型组相比,坏死区域小,但肝细胞仍部分肿大。蓝高组、联苯双酯组肝组织结构正常,可见肝细胞水肿,但水肿的程度较模型组明显减轻,未见气球样变,肝细胞坏死程度也明显减轻,大部分病例肝细胞未见坏死,仅少部分病例可见肝细胞点状坏死(P<0.05),见图1。
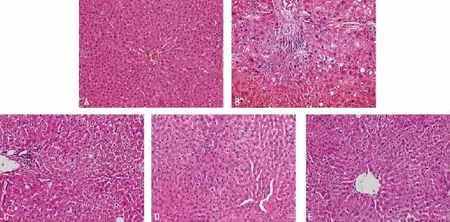
图1 蓝莓对CCl4所致急性肝损伤大鼠肝组织病理形态的影响(HE染色,×400)
2.2 各组大鼠血清ALT、AST活性比较 模型组ALT、AST显著高于空白组(P<0.01),蓝低组、蓝高组及联苯双酯组ALT、AST均显著低于模型组(P<0.01),蓝高组及联苯双酯组均显著低于蓝低组(P<0.01),F值分别 1 185.158、641.771,见表1。
表1 各组大鼠血清ALT、AST活性比较(±s)

表1 各组大鼠血清ALT、AST活性比较(±s)
a:P<0.01,与空白组比较;b:P<0.01,与模型组比较;c:P<0.01,与蓝低组比较。
组别 n ALT(U/L) AST(U/L)空白组10 40.01±3.84 80.79±5.67模型组 10 391.86±11.97a 299.14±10.23a蓝低组 10 275.63±17.64ab 240.38±11.80abc蓝高组 10 193.94±6.55abc 178.90±8.11abc联苯双酯组 10 187.41±11.32abc 182.01±11.43abc
2.3 各组大鼠肝匀浆中 MDA、CAT、SOD、GSH水平比较模型组 MDA显著高于空白组(P<0.01),蓝低组、蓝高组及联苯双酯组MDA均显著低于模型组(P<0.01),蓝高组及联苯双酯组 MDA均显著低于蓝低组(F=231.700,P<0.01);模型组CAT、SOD、GSH均显著低于空白组(P<0.01),蓝低、蓝高组及联苯双酯组CAT、SOD、GSH均显著高于模型组(P<0.01),蓝高组及联苯双酯组CAT、SOD、GSH 均显著高于蓝低组(P<0.01),F值分别为117.781、576.582、725.135,见表2。
2.4 各组大鼠肝组织GCLC mRNA和蛋白表达水平的比较模型组GCLC mRNA和蛋白质表达水平均高于空白组,但差异无统计学意义(P>0.05),蓝低组、蓝高组及联苯双酯组均显著高于模型组(P<0.01),蓝高组及联苯双酯组均显著高于蓝低组(P<0.01),F值分别为257.112、138.666、823.471,见表3、图2。
表2 各组大鼠肝匀浆中MDA、CAT、SOD、GSH水平比较(±s)

表2 各组大鼠肝匀浆中MDA、CAT、SOD、GSH水平比较(±s)
a:P<0.01,与空白组比较;b:P<0.01,与模型组比较;c:P<0.01,与蓝低组比较。
组别 n MDA(nmol/mg) CAT(U/g) SOD(U/g) GSH(mg/g)空白组 10 0.70±0.03 360.47±11.77 618.02±16.97 2.59±0.07模型组 10 1.46±0.05a 197.42±23.52a110.35±19.67a0.81±0.05a蓝低组 10 1.23±0.07ab 254.02±11.97ab 386.47±22.73ab 1.35±0.09ab蓝高组 10 1.06±0.06abc 295.04±17.04abc 439.77±25.33abc 1.90±0.07abc联苯双酯组 10 1.03±0.05abc 287.94±17.38abc 447.16±26.37abc 1.87±0.07abc
表3 各组大鼠肝组织GCLC mRNA和蛋白质表达(±s)
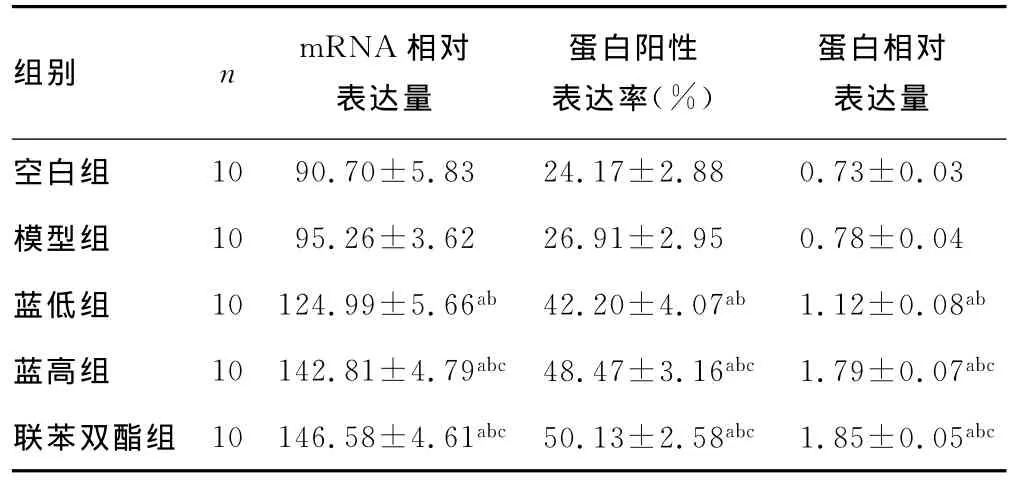
表3 各组大鼠肝组织GCLC mRNA和蛋白质表达(±s)
a:P<0.01,与空白组比较;b:P<0.01,与模型组比较;c:P<0.01,与蓝低组比较。
组别 n mRNA相对表达量蛋白相对表达量空白组蛋白阳性表达率(%)10 90.70±5.83 24.17±2.88 0.73±0.03模型组 10 95.26±3.62 26.91±2.95 0.78±0.04蓝低组 10 124.99±5.66ab 42.20±4.07ab 1.12±0.08ab蓝高组 10 142.81±4.79abc 48.47±3.16abc 1.79±0.07abc联苯双酯组 10 146.58±4.61abc 50.13±2.58abc 1.85±0.05abc
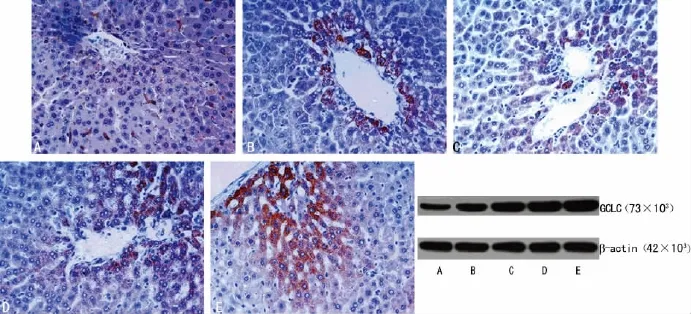
图2 免疫组织化学法与Western blot检测各组大鼠肝组织GCLC蛋白的表达(DAB,×400)
3 讨 论
蓝莓是一种小浆果类蓝色水果,因其富含营养和药用保健成分,被誉为“黄金浆果”,并被联合国粮农组织(FAO)列为全球五大健康食品之一。蓝莓果实除了富含叶酸、花青甙、类黄酮、果糖及维生素A、C、E外,还含有多种抗氧化剂,其SOD含量超过其他果品数倍,这些化合物与人体清除自由基、增强夜间视力、抗癌等密切相关[9-10]。Wang等[11-13]研究发现,蓝莓可激活小鼠肝脏核转录相关因子2(Nrf2)、血色素加氧酶-1(HO-1)、醌氧化还原酶(NqO1)和金属硫蛋白(MT)的表达,减轻CCl4所致大鼠急性肝损伤以及肝纤维化。
CCl4所致的急性肝损伤模型是最常用的经典模型之一,其所致肝损伤是典型的氧化应激及脂质过氧化连锁反应[14]。氧化应激时,体内氧自由基大量增多,CAT、SOD、GSH等抗氧化物质大量耗竭,从而引起肝脏疾病[15]。MDA为脂质过氧化的最终产物,可严重破坏细胞膜结构,导致细胞膜肿胀坏死,其血清及组织中的含量反映了组织过氧化损伤的程度和细胞受损程度[16]。GSH主要在肝脏合成,是细胞内主要的还原剂,能够清除体内的超氧离子和自由基,保护细胞膜的完整性,是肝脏抗氧化系统的重要组成部分[17]。GSH的生物合成是在γ-谷氨酰半胱氨酸合成酶(γ-GCS)、GSH合成酶催化下将底物谷氨酸、半胱氨酸及甘氨酸按顺序合成。γ-GCS是由Nrf2和抗氧化反应元件(ARE)调控的Ⅱ相酶,是合成GSH的限速酶,该酶由催化亚基GCLC和调节亚基GCLM组成,其中GCLC含有γ-GCS所有底物的结合位点和催化功能,在GSH的合成中起决定性作用[18]。研究发现,肝细胞内GCLC的缺失会导致肝细胞脂肪变性和肝衰竭[19],小剂量蛋白酶抑制剂可上调GSH合成酶及GCLC的表达以治疗大鼠酒精性肝病[20]。可见,GCLC在缓解多种病因导致的氧化应激性肝损伤方面发挥着至关重要的作用。
本实验采用CCl4腹腔注射复制大鼠急性肝损伤模型,检测GCLC在急性肝损伤大鼠肝脏的表达情况,并观察蓝莓对急性肝损伤大鼠肝组织GCLC的影响,探讨蓝莓对CCl4所致大鼠急性肝损伤的干预效果及可能机制。
结果表明,模型组大鼠肝匀浆GSH显著低于空白组,而肝组织GCLC表达较空白组虽有所升高,但差异并无统计学意义,提示在大鼠急性肝损伤进程中,GSH大量消耗,而诱导GSH合成的限速酶γ-GCS的催化亚基GCLC反馈性上调不足,致使GSH的合成进一步减少,机体抗氧化防御功能减弱,可能是CCl4诱导大鼠急性肝损伤的发病机制之一。
对蓝莓汁预防组大鼠的检测发现,血清ALT、AST、肝匀浆MDA显著低于模型组,肝匀浆CAT、SOD、GSH显著高于模型组,病理组织学检查发现其肝细胞变性及坏死程度显著减轻,蓝高组与联苯双酯组相当。表明蓝莓可改善肝功能,减轻氧化应激及脂质过氧化所致的肝损伤程度,对CCl4诱导的大鼠急性肝损伤具有一定预防作用。对大鼠肝组织GCLC的检测发现,蓝莓汁预防组GCLC mRNA及蛋白表达显著高于模型组,同时,上述指标在蓝低组、蓝高组之间也存在显著差异,提示两组间存在量效关系。本研究推测,蓝莓预防CCl4诱导的大鼠急性肝损伤的机制,可能与上调GCLC表达,刺激抗氧化因子GSH的合成,进而对抗氧化应激有关。
[1] Malin DH,Lee DR,Goyarzu P,et al.Short-term blueberry-enriched diet prevents and reverses object recognition memory loss in aging rats[J].Nutrition,2011,27(3):338-342.
[2] Wiseman W,Egan JM,Slemmer JE,et al.Feeding blueberry diets inhibits angiotensin II-converting enzyme(ACE)activity in spontaneously hypertensive strokeprone rats[J].Can J Physiol Pharmacol,2011,89(1):67-71.
[3] Kristo AS,Kalea AZ,Schuschke DA,et al.A wild blueberry-enriched diet(Vaccinium angustifolium)improves vascular tone in the adult spontaneously hypertensive rat[J].J Agric Food Chem,2010,58(22):11600-11605.
[4] Zu XY,Zhang ZY,Zhang XW,et al.Anthocyanins extracted from Chinese blueberry (Vaccinium uliginosum L.)and its anticancer effects on DLD-1and COLO205cells[J].Chin Med J(Engl),2010,123(19):2714-2719.
[5] 王豫萍,张宝芳,周明玉,等.蓝莓预防大鼠肝损伤实验研究[J].肝脏,2009,14(1):33-35.
[6] Osman N,Adawi D,AhrnéS,et al.Endotoxin-and D-galactosamine-induced liver injury improved by the administration of lactobacillus,bifidobacterium and blueberry[J].Dig Liver Dis,2007,39(9):849-856.
[7] 王豫萍,程明亮,张宝芳.蓝莓对急性肝损伤大鼠抗氧化能力的影响[J].肝脏,2012,17(9):633-635.
[8] 祁平,樊惠,梁颖娥,等.4-羟基苯并恶唑-2-酮对小鼠急性肝损伤的保护作用[J].时珍国医国药,2012,23(7):1668-1669.
[9] Torri E,Lemos M,Caliari V,et al.Anti-inflammatory and antinociceptive properties of blueberry extract(Vaccinium corymbosum)[J].J Pharm Pharmacol,2007,59(4):591-596.
[10] Neto CC.Cranberry and blueberry:evidence for protective effects against cancer and vascular diseases[J].Mol Nutr Food Res,2007,51(6):652-664.
[11] Wang YP,Cheng ML,Zhang BF,et al.Effect of blueberry on hepatic and immunological functions in mice[J].Hepatobiliary Pancreat Dis Int,2010,9(2):164-168.
[12] Wang YP,Cheng ML,Zhang BF,et al.Effects of blueberry on hepatic fibrosis and transcription factor Nrf2in rats[J].World J Gastroenterol,2010,16(21):2657-2663.
[13] Wang YP,Cheng mL,Zhang BF,et al.Dietary supplementation of blueberry juice enhances hepatic expression of metallothionein and attenuates liverfibrosis in rats[J].PLoS One,2013,8(3):e58659.
[14] 梁道明,胡智兴,罗敏,等.不同剂量CCl4急性肝损伤模型的评价[J].重庆医学,2014,43(1):18-20.
[15] Ohta Y,Nishida K,Sasaki E,et al.Attenuation of disrupted hepatic active oxygen metabolism with the recovery of acute liver injury in rats intoxicated with carbon tetrachloride[J].Res Commun Mol Pathol Pharmacol,1997,95(2):191-207.
[16] Martin-Aragón S,de las Heras B,Sanchez-Reus MI,et al.Pharmacological modification of endogenous antioxidant enzymes by ursolic acid on tetrachloride-induced liver damage in rats and primary cultures of rat hepatocytes[J].Exp Toxicol Pathol,2001,53(2/3):199-206.
[17] 朱润芝,李京敬,谢超,等.过氧化作用与肝脏疾病[J].世界华人消化杂志,2010,18(11):1134-1140.
[18] Seelig GF,Simondsen RP,Meister A.Reversible dissociation of gamma-glutamylcysteine synthetase into two subunits[J].J Biol Chem,1984,259(15):9345-9347.
[19] Chen Y,Yang Y,Miller ML,et al.Hepatocyte-specific Gclc deletion leads to rapid onset of steatosis with mitochondrial injury and liver failure[J].Hepatology,2007,45(5):1118-1128.
[20] Bardag-Gorce F,Oliva J,Lin A,et al.Proteasome inhibitor up regulates liver antioxidative enzymes in rat model of alcoholic liver disease[J].Exp Mol Pathol,2011,90(1):123-130.

