荧光量子点在神经毒理学研究中的应用及前景
吴添舒,唐萌
东南大学公共卫生学院环境医学工程教育部重点实验室,江苏省生物材料与器件重点实验室,南京 210009
荧光量子点在神经毒理学研究中的应用及前景
吴添舒,唐萌*
东南大学公共卫生学院环境医学工程教育部重点实验室,江苏省生物材料与器件重点实验室,南京 210009
如今纳米生物技术的研究正以迅猛的势头不断发展。量子点作为一种新型的纳米荧光探针,由于其优越的光电学特性在生物学和毒理学领域有着广阔的应用前景。神经毒理学作为毒理学的一个重要分支,量子点的应用也给该领域带来了技术上的革命。本文重点阐述了量子点作为一种新型单分子技术和一种优秀的荧光探针在神经毒理学研究中的应用。同时,作者还简要介绍了量子点进入机体神经系统的途径和影响其应用的一些因素,为今后量子点的生物安全性研究和更好地应用提供了有价值的参考。
纳米技术;量子点;神经毒理学;荧光探针;药物转运
随着纳米技术在生物医学领域的迅猛发展,“纳米医学”作为一个新兴领域由此诞生。在纳米技术中所研究的纳米颗粒是指粒径在1~100 nm范围内的物质和材料,具有很多独特的特性。随着对纳米药物、载体及材料等研究的深入,研究者们发现可将纳米技术更多的应用于神经生物学基础研究中。量子点作为一种新型的纳米荧光探针,由于其在光学及电学上独特的特性受到研究者的广泛关注。虽然目前有关量子点在生物学基础研究中应用的研究报道很多,但在毒理学,特别是神经毒理学领域的研究相对较少。以下将就量子点在神经毒理学中的应用及其前景进行综述。
1 量子点及其在生物学中的应用
量子点(quantum dots,QDs)是一种由Ⅲ~Ⅴ族或Ⅱ~Ⅵ族元素组成的,粒径小于或接近激子波尔半径的半导体纳米微晶体,典型的量子点直径通常在1~10 nm[1]。量子点的结构一般以一种半导体材料为内核,外面包裹第二种半导体材料。通常内核决定了量子点的光学特性,而外壳则加强了量子点的光稳定性[2]。量子点的种类很多,每种量子点由于其材料、大小、形状或结构等的不同而表现出不同的光电学特性。目前应用最广泛的为内核含镉(Cd)和碲(Te)的量子点,因为它们的量子限制区域横跨整个光谱[3]。此外,已经报道的量子点种类还有InP量子点、PbS量子点、含硅量子点、CuInS2量子点、Ag2S量子点等[4-8]。由于本身材料特性,它们或有更强的光学稳定性,或有更低的毒性,或有更好的水分散性,从而能适应不同的应用需求。
大约三十年前,量子点首次被发现,由于其独特的半导体和冷光特性,仅仅被应用于电学领域。在本世纪初,随着纳米科技的不断进步,量子点优异的光学特性使得其十分适合作为有效的能量供体用于荧光共振能量转移(FRET)分析。FRET是一个很好的定量测量两个发光基团间的距离的方法,可以用于观察蛋白构象变化,监控蛋白相互作用和酶活性。很多研究团队已经将包被特定生物分子(通常为抗体)的量子点用于免疫检测[9]。量子点也可用来追踪细胞,检测病原体和毒素[10,11]。近年来,量子点技术的发展在癌症的诊断和治疗上带去了很大的影响。量子点可用于癌细胞定位,探测原发性癌症及其转移,识别目标分子,协助治疗[12,13]。
此外,生物共轭的量子点还可以靶向结合DNA或mRNA,杂交作为基因探针检测相关基因。与传统有机荧光探针相比,量子点表现出更大的耐光性和信号强度。研究显示量子点荧光探针已经应用于检测乳腺癌相关基因ERBB2/HER2/神经膜轨迹[14]。但是量子点产生荧光存在闪烁现象,使得信号稳定性较差,另外,量子点表面包覆的寡核苷酸涂层会破坏其长期稳定性,若这些缺点不能得到解决,量子点将失去相较于传统有机荧光材料的优越地位。
量子点在生物科学上的一项重要应用为活体成像。由于用同一激发光源激发不同尺寸和组成的量子点可获得从红到蓝的一系列不同颜色的光[15],尤其是适当组分和大小的量子点可发射近红外波长(700~2,000 nm)的光谱,组织散射和吸收都较蓝绿光低很多,从而能够得到最大组织穿透深度的光学信号,对于体内深组织,如血管或淋巴管的效果会十分理想[16]。应用量子点可以在医学上将活体内的生物过程在细胞和分子水平上进行特征的显示,有利于疾病的无创诊断,有助于制定更合适的治疗方案。
与传统的有机荧光材料相比,量子点有其独特的优势,包括:光辐射的大小依赖性,即纳米粒子半导体核心的大小变化与光辐射波长之间的相关性,又称为量子限域;发射高强度高亮度的光信号;光稳定性强,与其他光学显影剂相比有更长的时间周期;抗漂白能力强;不易被组织自身荧光掩盖;经修饰后生物相容性好等[16-18]。如果量子点的毒性可以得到控制,这些优势使得量子点同样可以作为优秀的荧光探针应用于毒理学的研究中,在分子水平上实时监测或可视化受试化学物对机体生物学过程的干扰以及造成的负面影响;例如在毒物代谢/效应动力学的研究中,量子点可以帮助我们深入了解进入机体的毒物的吸收、分布、代谢和排泄(ADME)过程,提供各主要器官中毒物沉积和排除情况的信息,明确不同毒物作用的靶器官。量子点的应用可以将毒理学研究变得更加简单有效,而作为毒理学的一个重要分支,量子点将在,或已经在神经毒理学研究中带来了技术上的革新。
2 量子点在神经毒理学中的应用
2.1 量子点的暴露途径
Hardman总结了量子点的三条暴露途径:职业暴露,环境暴露和生物医学暴露[19]。职业暴露是量子点的主要暴露途径,其来源有气溶胶吸入、意外事故、皮肤接触和经口摄入等。主要暴露人群为量子点生产车间工作者、工程师、研究人员等。通过环境暴露的量子点,由于环境介质的存在,量子点暴露所造成的健康效应要受到环境转化,环境转运和环境降解等的影响。生物医学方面的暴露途径则是随着量子点在生物医学领域越来越多的应用而逐渐受到研究者的关注。但是由于量子点还未被允许应用人体,目前暴露的方法多是针对研究动物的,如腹腔、静脉注射,灌胃,鼻腔滴注等,而主要暴露的高危人群为进行动物试验的实验室研究人员。通过大量的体内和体外实验研究我们发现一定浓度的量子点可以降低细胞存活率和繁殖率,破坏细胞结构与功能,蓄积于实验动物主要脏器内造成氧化应激和炎症损伤,破坏机体免疫系统,还可以影响相关基因和蛋白的正常表达[20]。
进入机体的量子点,由于突出的尺寸效应,可以很轻易地跨越血脑屏障进入中枢神经系统。因而,跨越血脑屏障是存在于循环系统中的量子点进入中枢神经系统的主要途径之一。除了血脑屏障途径,已有研究证实,吸入的纳米颗粒也可以通过嗅觉神经通路进入中枢神经系统,并转移沉积于不同的大脑区域[21]。根据此相似纳米颗粒的研究结果可以推测,量子点也可能经嗅神经转运进入中枢神经系统。
2.2 量子点作为神经电动力学探针
近年来,神经科学家一直致力于弄清分子水平上突触重塑导致学习与记忆的改变,虽然研究者已经明确突触传递的机制依赖于神经递质受体的横向运动,但是却没有有效的方法追踪单个突触膜受体的空间动力学。目前,越来越多的研究者将单量子点追踪看做一种单分子技术,用于研究神经电动力学。早在2003年,Dahan等[22]首次利用量子点标记单个甘氨酸受体从而检测其扩散动力学。其后,2007年,De Koninck等[23]运用量子点追踪突触上谷氨酸的进出来检测单个突触受体的神经回路。该研究在突触效应机制研究方面的贡献甚至可能影响我们对于学习与记忆分子基础的理解。此外,Marshell等[24]研究报导了量子点可以作为荧光传感器监测神经元细胞膜电压,其不但有更优秀的荧光性能,还可以弥补传统荧光传感器的缺点:无法协同监测大量单个神经元间的强化活动。
同时,量子点还可用于实时可视化监控神经元细胞膜上的电压门控通道的生理作用。Gómez-Varela等[25]利用与特定抗体结合的量子点揭示并描述了Eag1在大鼠海马神经元细胞膜上通过Eag1通道的扩散情况,并且发现横向扩散为Eag1进出突触为内生性Eag1离子通道的最快的作用机制。该研究为其后通过量子点对细胞膜上电压门控离子通道活动的深入研究提供了参考依据。
Chang等[26]以量子点标记作为神经信号传导平台的RN46A神经细胞质膜脂筏,从而了解脂筏的扩散动力学和模条块分割。与常用的有机荧光团相比,量子点虽然尺寸相对大了些(有机荧光团的直径≤1 nm;所用量子点直径一般10~20 nm),但却可以显著弥补有机荧光团实时追踪仅仅几秒钟的不足。并且,通过两种方法最终得出的扩散系数区别很小,说明量子点完全可以代替有机荧光团用于单分子追踪技术。
研究者还发现量子点可以应用于探索海马神经元细胞膜上蛋白合成过程与新合成蛋白的动力学,并克服了原来只能在同一时间在位可视化一或两个蛋白的局限性[28]。最近,Arizono等[29]应用量子点单颗粒示踪来阐明星形胶质细胞中内源性代谢型谷氨酸受体(mGluR5)动力学,从而明确了mGluR5在细胞质膜上横向扩散对细胞内Ca2+信号的重要性,也为今后继续研究神经元和星形胶质细胞间作用关系提供新的方法。由此可见,量子点独特的特性使其有能力作为一种高级的工具应用于研究外源化学物对机体神经系统生理过程中神经电动力学方面的影响。
2.3 量子点标记神经细胞
量子点作为一种优秀的纳米级荧光材料,标记细胞可以作为其一项主要功能。早在2011年,国内实验室已经成功以量子点标记、追踪神经干细胞,并且确定量子点对神经干细胞分化能力和由神经干细胞分化的神经元和星形胶质细胞的蛋白表达没有明显影响[30]。Minami等[31]研究显示量子点可以用于特异性地标记和调节体外原代培养脑皮层和活体动物脑部的小神经胶质细胞,并且其荧光效果可维持较长时间。小神经胶质细胞为脑内原位免疫细胞,广泛参与各种脑损伤和神经障碍,然而它们在脑部不同生理病理学状态下的作用还不清楚。量子点对小神经胶质细胞的标记帮助阐述了其在生物活性物质传递中的作用机制,从而便于选择合适的药物完善小神经胶质细胞的功能,治疗神经系统疾病。
经过特殊修饰的量子点通过适当的方法也可以在活体内标记神经系统细胞。Slotkin等[32]应用新颖的母体子宫内电穿孔和超声定位的技术,在活体上直接高效地以量子点标记哺乳动物发育中的中枢神经系统里的神经干细胞,并且其没有表现出长期副反应。该研究证实了量子点可以应用于哺乳动物活体发育过程中原基分布图绘制、细胞迁移和神经干细胞分化的研究。此外,量子点独特的理化性质还可以使其标记的神经细胞呈现独特的表现。Rao等[33]发现生物分子功能化的CdSe量子点可以根据特定方向自我装配,从而促进神经细胞生长和分化呈现极化现象。该特性也可用于探索细胞定位、成像和生物传感等。
2.4 量子点追踪生物活性分子
能够有效地将细胞间或细胞内的生物活性分子可视化从而监视追踪一直是生物学研究的一个重要目标,也是毒理学中外源化学物导致生物效应的作用机制的研究基础。在分子神经科学领域,研究者们发现单量子点技术可以在单分子水平上很好地追踪调查神经细胞膜蛋白[34]。目前,量子点作为荧光探针在标记活体中或体外培养中的神经生物活性分子上已经取得了很大的突破。神经生物活性分子连接上量子点后,神经系统中的神经递质的释放和受体的迁移等可以被很好的实时追踪。最近,Levi等[35]的一篇研究计划就描述了量子点可以作为一种高敏感性方法用于长时间追踪神经细胞膜受体活动,从微观角度探索细胞膜上分子运动。
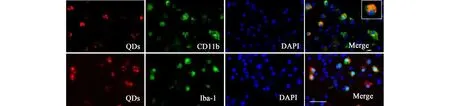
图2 在原代培养的大鼠脑皮层组织中,量子点(红色)主要被标记了anti-CD11b(绿色)或Anti-lba-1(绿色)的抗体内在化;细胞核被DAPI标记(蓝色)[31]Fig. 2 In mixed primary cortical cultures from rats, QDs (red) were internalized primarily by microglia labeled with anti-CD11b (green) or anti-Iba-1 (green) antibodies. Nuclei were labeled with DAPI (blue)[31]
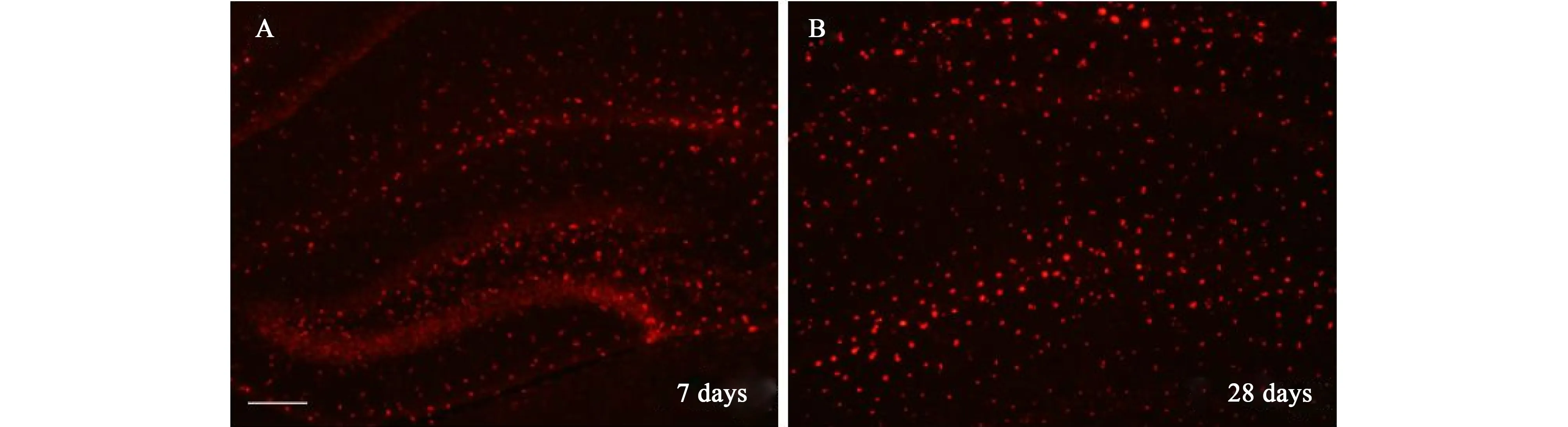
图3 量子点的长期表达;量子点注射入C57BL/6小鼠海马体7天后的观察图(A)与28天后的观察图(B)[31]Fig. 3 Long-term expression of QDs. QDs are observed 7 days (A) and 28 days (B)after injection into the hippocampus of adult C57BL/6 mice[31]
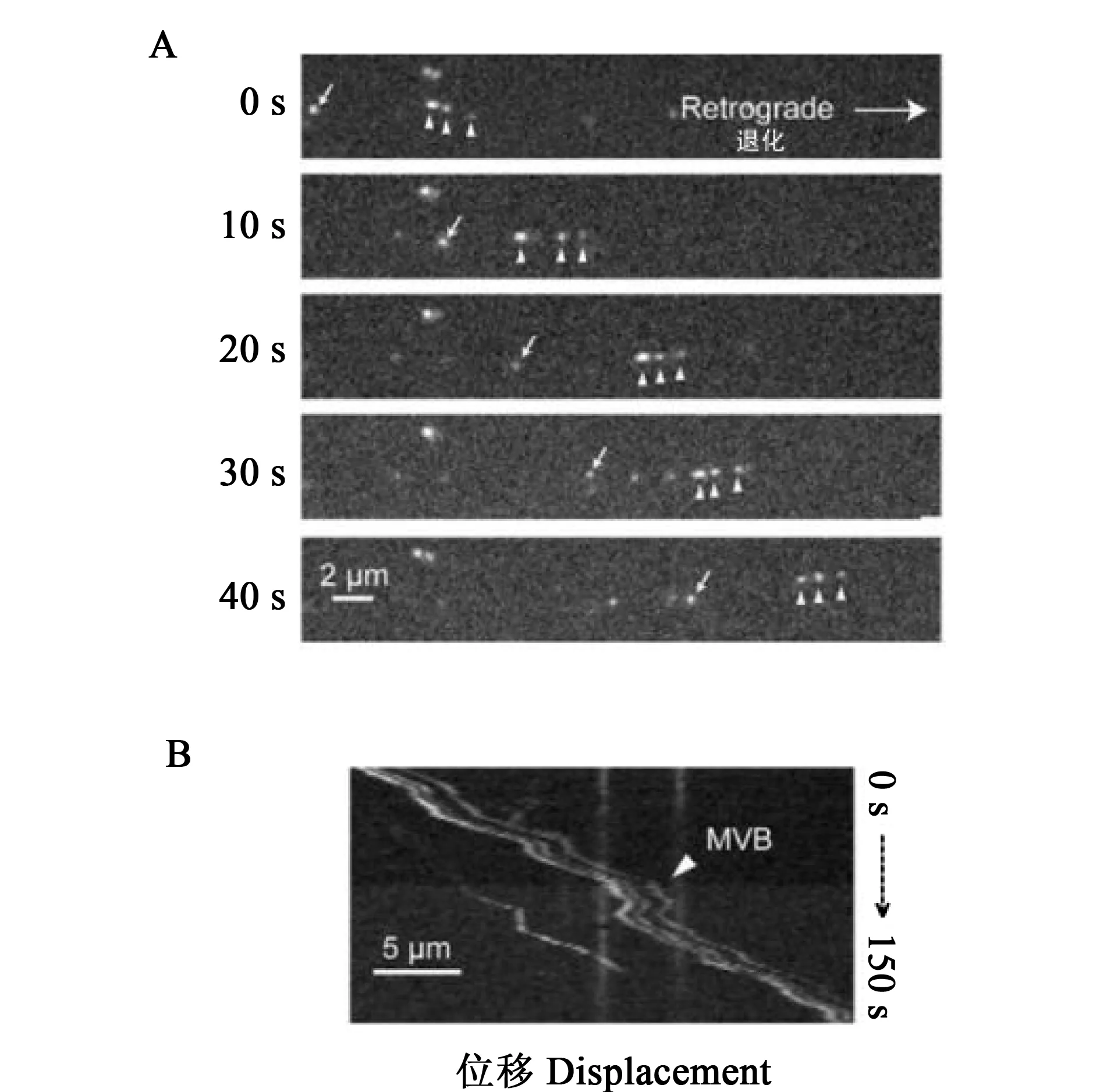
图4 (A)实时图像显示了量子点的两种转送运动。白色箭头指示单个BDNF-核内体;白色三角指示了三个量子点标记的BDNF在类MVB结构中同时运动。(B)一个波动曲线记录仪记录了三个量子点标记的BDNF在类MVB结构中的并发运动和停顿模式[39]。Fig. 4 (A) Time-lapse images showing both transporting modes. White arrows indicated an individual BDNF-endosome while white arrow heads denoted three QD-BDNF moving together in a MVB-like structure.(B) A kymograph clearly showed the concurrent moving and pausing patterns of the three QD-BDNFs in a MVB-like structure[39].
量子点在标记追踪神经递质受体方面已有的研究还有很多。Park等[36]应用了与亲和素(NTV)生物共轭的量子点来探测海马神经元上分布的络氨酸激酶B(TrkB)受体,并发现TrkB受体在神经元胞体上分布集中,而在轴突上却呈点状分布。因而,特定功能化的量子点可以用于建立神经元的纳米尺寸三维结构形态。Geng等[37]已经应用链霉亲和素共轭的量子点单分子标记追踪乙酰胆碱受体,从而证实肌肉细胞上受神经突触刺激后产生的乙酰胆碱受体装配集群反应经由两种明显不同的分子过程:细胞膜上的受体布朗运动和突触特化作用下的捕获与固定。
此外,神经系统中还有许许多多的生物活性分子的运输与作用也可以通过量子点一一弄清。Osakada等[38]应用量子点在全内反射显微镜上实时可视追踪了高空间和时间分辨率的背根神经节上神经生长因子运输。Xie等[39]发现被量子点标记的脑源性神经营养因子(BDNF),能够毫无影响地被轴突终末的受体识别接受进入海马神经元细胞。BDNF在中枢和外周神经系统生长、发育和维持中扮演着重要的角色。为了能够了解BDNF信号的传播,追踪BDNF进出轴突终末会是很有效的方法。量子点优越的光亮度与光稳定性更使得对该蛋白的追踪更清晰和长效。
目前,Chang等[40]已经系统综述了已有的量子点在分子神经学中的应用,其不但可以标记神经元受体和转运蛋白,还可以用于研究目标蛋白与神经细胞的结合后揭露潜在的神经信号机制所造成的特定生理反应,为未来量子点在神经生物学和药理学研究中的应用提供了指南。但该应用还有一定的局限性,目前无法做到在不引起后续细胞反应的前提下标记目标蛋白。
2.5 量子点的实时成像功能
活体成像一直被认为是量子点在生物科学上最重要的应用。由于目前使用的实时成像中使用的荧光材料或荧光蛋白都存在很强的光漂白现象,量子点卓越的光稳定性可以很好地解决此问题。优秀的体内成像将活体内的生物过程在细胞和分子水平上进行特征显示,有利于无创诊断外源化学物所导致的负面健康效应或系统疾病。
已有研究显示量子点可以用于视网膜变性大鼠的完整神经视网膜组织的标记和成像,特别在构造胶质瘢痕和胶质增生上显示了量子点的突出性能[41]。Kantelhardt等[42]发现将上表皮生长因素(EGF)或单克隆抗体(MAb) anti-EGFR修饰的量子点用于特异性神经胶质瘤活组织检测,可以在单细胞水平上从正常大脑组织中显著区分出原位神经胶质瘤细胞,并且成像时不需要加强的MRI检测图像。若量子点被允许应用于人体,该性能将更好地用于术中指导切除残留的肿瘤细胞,提高病人存活率。
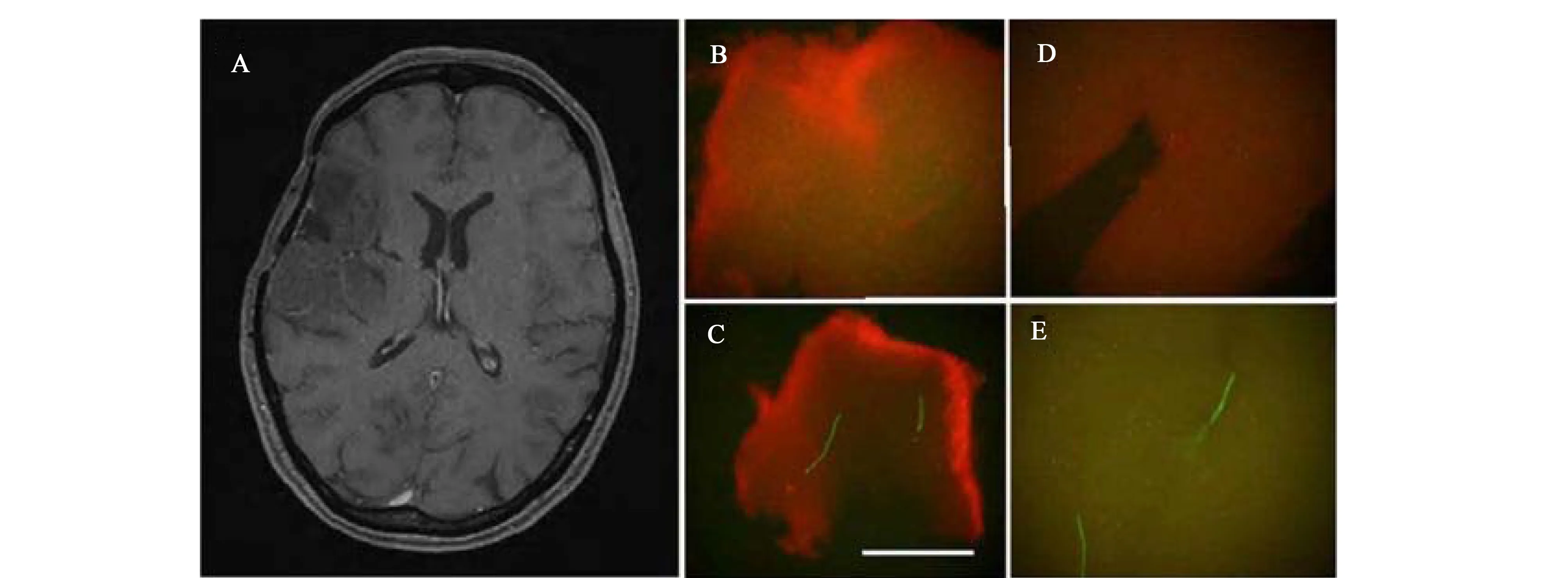
图5 一间胶质瘤Ⅱ期的MRI影像(A)和量子点为探针的数字低倍放大影像(B-E)[42]Fig. 5 MRI (A) and QD-probe digital macroimages (B-E) from glioblastoma multiforme, grade IV biopsy X[42]
此外,量子点同样能用于哺乳动物中枢神经系统神经突触前端单个突触囊泡的成像,从而更敏感准确地监测神经突触的运动[43]。神经突触传导期间使用了胞外分泌的两种模式:称为经典模式的全衰竭的融合(FCF),即完全的囊泡融合,以及一种不完全的囊泡融合形式,被称为“吻与跑”(K&R)。 然而,传统的荧光探针很难实时以及高分辨率地区分并确定突触囊泡的这两种运动和行为。Zhang等[44]利用羧基修饰的量子点使得以纳米精确度在三维空间实时监测区分囊泡运动成为可能。由于量子点的尺寸只能通过FCF的融合孔,而不能通过K&R的,FCF能够被观察到一个突发的并且彻底的荧光性损失,从而区分两种运动。虽然量子点在实时成像方面的应用还有很多问题有待解决,但同样昭示了其具大的潜力,值得研究者深入发掘。
2.6 量子点在外源物质转运中的运用
早有报道,量子点可以携带药物治疗特定疾病[45],其特异性和长期作用等优点使其在外源物质转运,尤其是药物转运中发挥了越来越重要的作用。然而,如要携带外源物质进入脑部的中枢神经系统还将面临一个最大的阻碍——血脑屏障(BBB)。血脑屏障作为一个复杂的生理检查站,具有很高的选择性,可以阻止血液中的很多异物从血液向中枢神经系统扩散。然而由于量子点的直径为1~10 nm,Kato等[46]研究发现经CdSe/ZnS修饰的量子点腹腔注射6小时后可经血循环进入实验小鼠的肝脏、脾脏、肾脏和大脑。虽然量子点主要集中在肝脏、肾脏和大脑的血管中,但依旧有少量在大脑实质分布。
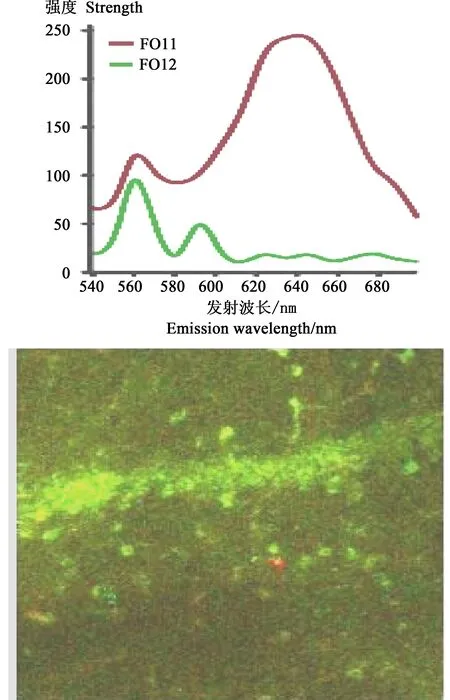
图6 量子点在海马体中荧光图像(右)与发射光谱(左);ROI1为粒子值,ROI2为背景值[46]Fig. 6 Fluorescence image (right) and emission spectral profile (left) of QDs in hippocampus. In each figure, ROI (region of interest) 1 was placed on the particle, whereas ROI 2 was placed on the background[46]

图7 转铁蛋白修饰的量子点跨越血脑屏障示意图。荧光图显示内皮细胞与星形胶质细胞摄取入量子点[48]Fig. 7 Visulizing the trancytosisi of QDs-Tf across BBB real-time. The endothelial cells and astrocytes were imaged by laser scanning confocal microscope to confirm the uptake of QDs by both cells[48]
Walters等[47]在体外培养海马神经切片模型上以多聚两性电解质CL4修饰的量子点靶向神经元,发现量子点可以携带生物活性物质进入特定的神经元亚细胞空间,并且即使量子点暴露1年后,也没有明显的毒性反应。揭示了量子点携带外源活性物质进入中枢神经系统的突出贡献。Xu等[48]研究讨论了经特异生物分子功能化的量子点携带药物跨越血脑屏障进入大脑治疗HIV相关脑病。量子点携带药物转运入脑不但提高了药物利用率,减少药物使用剂量,降低不良反应率,还可以特定脑内区域做靶向治疗。同时由于量子点的荧光特性,我们更可以追踪药物在大脑中的转运,一举多得。
转运的外源物质除了药物,还可以是基因信息。Bardi等[49]发现氨基修饰的量子点混合SiO2纳米颗粒具有优秀的能力结合、转运、释放DNA进入人类神经母细胞瘤SH-SY5Y细胞,允许GFP质粒转染。目前,量子点在神经毒理学领域的应用大致可分为以上五种,但我们相信,随着量子点研究的逐渐深入,其应用面将越加广阔。
3 影响量子点应用的因素
若要使量子点能够在机体神经系统,尤其是中枢神经系统研究方面发挥作用,量子点首先要能够顺利进入神经系统。量子点由于体积微小和特殊的理化性质,可以很轻易地跨越血脑屏障进入中枢神经系统。可以说跨越血脑屏障(BBB)是存在于循环系统中的量子点进入中枢神经系统的主要途径。并且有研究结果显示,如果将量子点进行一定的表面修饰,可以明显提高进入脑组织的量子点数量[50]。除了血脑屏障途径,吸入的纳米颗粒也可以通过嗅觉神经通路进入中枢神经系统,并转移沉积于不同的大脑区域[21],但由于大鼠与人明显不同的生理和解剖特点,这就使得实验动物的结果外推到人存在一定的局限性。除了嗅神经可以转运纳米颗粒外,三叉神经发出的感觉神经末梢贯穿于鼻腔粘膜及嗅粘膜,呼吸暴露后鼻腔沉积的纳米颗粒可以直接经末梢神经转运入脑[51]。目前,该途径受到的关注不多,但该神经途径在今后可能的鼻吸量子点的研究与开发上有重要的意义。
以往大量研究可知,量子点的毒性大小和诸多因素有关,包括选用的化学材料、粒径大小、结构、修饰材料等[52]。而在量子点的应用中,同样有诸多因素会影响量子点或标记、或成像的能力。首先,由于越来越多的研究者将目光放到了量子点活体成像的应用上去,以求最大程度的发挥量子点的优越性能,量子点的毒性大小就变得至关重要。由于不同器官组织对毒性的耐受性不同,我们可以根据需要成像的部位不同对所用量子点的优缺点进行适当取舍,选择最好的平衡点。
如上文中提到,为了使量子点能更好的适应不同的应用环境,我们常常需要对其进行表面修饰,而该涂层常常决定了胶质稳定性,不同溶剂的溶解性,物理特性和细胞毒性,因而,表面修饰涂层的化学性质和结构对量子点应用于生物成像至关重要。Bakalova等[53]发现无交联PAMAM化合物和氨基官能化的CdSe/ZnS量子点不适合活体脉管系统成像,因为其不但具有细胞毒性且无生物相容性,而且可以渗透入血管,影响成像质量。而交联羧基的CdSe/ZnS量子点则更适合体内成像,因为此量子点将变得低毒并有良好的生物相容性。
该研究小组又以硅壳的量子点深入实验,发现聚乙二醇(PEG)化是提高量子点成像能力不可缺少的一步。无PEG修饰的量子点胶质稳定性较低,易降解。PEG修饰既没有显著增加量子点的尺寸,又增加了其在循环中的半衰期。并且当其浓度达到2.5 nmol/kg体重时,也没有影响机体生理指标,如血压,心跳等,因而,PEG修饰的量子点十分适合活体动物的毛细血管成像,调查影响血管收缩、舒张和脑血循环的各项因素。Gao等[54]也通过实验建立了包裹PEG涂层的量子点活体大脑成像平台,该经过很好修饰的量子点通过鼻吸转运进大脑,表现出优越安全的脑靶向和成像性能。
量子点的尺寸同样是决定量子点在何种情况下应用的一项重要因素。虽然量子点的尺寸只在1~10 nm之间,但是由于其多用于研究分子作用,即使很小的差距在应用上也可能产生很大的差异。例如为了能够替代常用的有机荧光团用于成像,量子点需要根据成像的部位、细胞或组织选择合适的与所用的有机荧光团尺寸大小最接近者,以求获得最接近或更准确的研究结果。
4 展 望
大量的研究结果已经显示,量子点在神经毒理学研究中有着广阔的应用前景。量子点优越的光电学特性使其能用于可视化、测量与追踪单分子物质,并在较长的时间段内(与有机荧光团相比)研究分析动态的分子过程,这些都是很难通过其他科技方法获得的。不可否认,量子点将作为更简单有效的研究方法在常规神经毒理学实验与医疗中逐渐得到应有的重视。
但是,目前量子点在此方面的研究只单纯停留在理论或动物实验阶段,依旧存在很多问题阻碍了量子点在生物学分支领域的广泛应用。大量研究显示了量子点的细胞毒性和对细胞结构功能的损伤,在活体动物上进行的量子点研究也显示了其对机体的负面生物效应,如氧化应激损伤、免疫反应等;更在分子水平上探讨了量子点的毒性机制问题,如量子点会导致凋亡相关的蛋白和基因表达异常,促进细胞死亡[20, 55]。因而若要使量子点可以通过审批,应用于人体,如何降低其毒性,明确进入机体的最佳浓度等将成为今后量子点生物安全性的研究重点。
此外,与现有的荧光探针相比,量子点相对较大的尺寸降低了其标记细胞分子的稳定性,并且降低了大规模的组织渗透性。除了尺寸效应外,量子点进入机体是否有可能产生抗体,以及温度和环境pH值对其稳定性是否存在影响都还并不清楚。另外,由于应用于生物体的量子点通常需要在表面包裹涂层以增加生物相容性,但是涂层的化学物理性质在不同情况下对量子点的应用效果和毒性的影响并不清楚。许多应用量子点于免疫荧光检测试验的结果显示其敏感性显著低于其他分析试验。而究其原因是实验设计的固有弱点,或应用的抗体,还是量子点合并的结果,都还需要进一步调查研究。
由此可见,虽然量子点优越的光电学特性使其在生物学分子成像等方面的能力毋庸置疑,但是只有克服上述问题,解决潜在忧患才能保证量子点应用于人体,在疾病的诊断和治疗上做出突破性的贡献。因而,我们还需要更多优秀的实验数据更好地理解量子点与生物系统间的相互作用,已达到其最有效的应用效果。不可否认,我们还有很长的一段路要走。
[1] Leutwyler W K, Bürgi S L, Burgl H. Semiconductor clusters, nanocrystals, and quantum dots [J]. Science, 1996, 271: 933
[2] Michalet X, Pinaud F, Bentolila L, et al. Quantum dots for live cells, in vivo imaging, and diagnostics [J]. Science, 2005, 307(5709): 538-544
[3] Yong K T, Law W C, Hu R, et al. Nanotoxicity assessment of quantum dots: From cellular to primate studies [J]. Chemical Society Reviews, 2013, 42(3): 1236-1250
[4] Xu S, Ziegler J, Nann T. Rapid synthesis of highly luminescent InP and InP/ZnS nanocrystals [J]. Journal of Materials Chemistry, 2008, 18(23): 2653-2656
[5] Hyun B R, Chen H, Rey D A, et al. Near-infrared fluorescence imaging with water-soluble lead salt quantum dots [J]. The Journal of Physical Chemistry B, 2007, 111(20): 5726-5730
[6] Erogbogbo F, Yong K T, Roy I, et al. Biocompatible luminescent silicon quantum dots for imaging of cancer cells [J]. ACS Nano, 2008, 2(5): 873-878
[7] Yong K T, Roy I, Hu R, et al. Synthesis of ternary CuInS2/ZnS quantum dot bioconjugates and their applications for targeted cancer bioimaging [J]. Integrative Biology, 2010, 2(2-3): 121-129
[8] Zhang Y, Zhang Y, Hong G, et al. Biodistribution, pharmacokinetics and toxicology of Ag2S near-infrared quantum dots in mice [J]. Biomaterials, 2013, 34(14): 3639-3646
[9] Hohng S, Ha T. Single-molecule quantum-dot fluorescence resonance energy transfer [J]. Chemphyschem, 2005, 6(5): 956-960
[10] Wang S, Mamedova N, Kotov N A, et al. Antigen/antibody immunocomplex from CdTe nanoparticle bioconjugates [J]. Nano Letters, 2002, 2(8): 817-822
[11] Medintz I L, Uyeda H T, Goldman E R, et al. Quantum dot bioconjugates for imaging, labelling and sensing [J]. Nature materials, 2005, 4(6): 435-446
[12] Akhter S, Ahmad I, Ahmad M Z, et al. Nanomedicines as cancer therapeutics: Current status [J]. Current Cancer Drug Targets, 2013, 13(4): 362-378
[13] Juzenas P, Chen W, Sun Y P, et al. Quantum dots and nanoparticles for photodynamic and radiation therapies of cancer [J]. Advanced Drug Delivery Reviews, 2008, 60(15): 1600-1614
[14] Jamieson T, Bakhshi R, Petrova D, et al. Biological applications of quantum dots [J]. Biomaterials, 2007, 28(31): 4717-4732
[15] Costa-Fernández J M, Pereiro R, Sanz-Medel A. The use of luminescent quantum dots for optical sensing [J]. TRAC Trends in Analytical Chemistry, 2006, 25(3): 207-218
[16] Mattoussi H, Palui G, Na H B. Luminescent quantum dots as platforms for probing in vitro and in vivo biological processes [J]. Advanced Drug Delivery Reviews, 2012, 64(2): 138-166
[17] Shao L, Gao Y, Yan F. Semiconductor quantum dots for biomedicial applications [J]. Sensors, 2011, 11(12): 11736-11751
[18] Kairdolf B A, Smith A M, Stokes T D, et al. Semiconductor quantum dots for bioimaging and biodiagnostic applications [J]. Annual Review of Analytical Chemistry, 2013, 6(1):143-162
[19] Hardman R. A toxicologic review of quantum dots: Toxicity depends on physicochemical and environmental factors [J]. Environmental Health Perspectives, 2006, 114(2): 165
[20] Wu T, Tang M. Toxicity of quantum dots on respiratory system [J]. Inhalation Toxicology, 2014, 26(2): 128-139
[21] Elder A, Gelein R, Silva V, et al. Translocation of inhaled ultrafine manganese oxide particles to the central nervous system [J]. Environmental Health Perspectives, 2006, 114(8): 1172-1178
[22] Dahan M, Levi S, Luccardini C, et al. Diffusion dynamics of glycine receptors revealed by single-quantum dot tracking [J]. Science, 2003, 302(5644): 442-445
[23] De Koninck P, Labrecque S, Heyes C D, et al. Probing synaptic signaling with quantum dots [J]. HFSP Journal, 2007, 1(1): 5-10
[24] Marshall J D, Schnitzer M J. Optical strategies for sensing neuronal voltage using quantum dots and other semiconductor nanocrystals [J]. ACS Nano, 2013, 7(5): 4601-4609
[25] Gomez-Varela D, Kohl T, Schmidt M, et al. Characterization of Eag1 channel lateral mobility in rat hippocampal cultures by single-particle-tracking with quantum dots [J]. PloS One, 2010, 5(1): e8858
[26] Chang J C, Rosenthal S J. Visualization of lipid raft membrane compartmentalization in living RN46A neuronal cells using single quantum dot tracking [J]. ACS Chemical Neuroscience, 2012, 3(10): 737-743
[27] Murcia M J, Minner D E, Mustata G M, et al. Design of quantum dot-conjugated lipids for long-term, high-speed tracking experiments on cell surfaces [J]. Journal of the American Chemical Society, 2008, 130(45): 15054-15062
[28] Dieterich D C, Hodas J J, Gouzer G, et al. In situ visualization and dynamics of newly synthesized proteins in rat hippocampal neurons [J]. Nature Neuroscience, 2010, 13(7): 897-905
[29] Arizono M, Bannai H, Mikoshiba K. Imaging mGluR5 dynamics in astrocytes using quantum dots [J]. Current Protocols in Neuroscience, 2014, 662: 211-218
[30] Zhang J, Lv X J, Jia X, et al. Labeling primary nerve stem cells with quantum dots [J]. Journal of Nanoscience and Nanotechnology, 2011, 11(11): 9536-9542
[31] Minami S S, Sun B, Popat K, et al. Selective targeting of microglia by quantum dots [J]. Journal of Neuroinflammation, 2012, 9(1): 22
[32] Slotkin J R, Chakrabarti L, Dai H N, et al. In vivo quantum dot labeling of mammalian stem and progenitor cells [J]. Developmental Dynamics, 2007, 236(12): 3393-3401
[33] Rao V N, Kishore A, Sarkar S, et al. Norbornene-derived poly-D-lysine copolymers as quantum dot carriers for neuron growth [J]. Biomacromolecules, 2012, 13(9): 2933-2944
[34] Pinaud F, Clarke S, Sittner A, et al. Probing cellular events, one quantum dot at a time [J]. Nature Methods, 2010, 7(4): 275-285
[35] Lévi S, Dahan M, Triller A. Labeling neuronal membrane receptors with quantum dots [J]. Cold Spring Harbor Protocols, 2011, 2011(3): prot5580
[36] Park J W, Park A Y, Lee S, et al. Detection of TrkB receptors distributed in cultured hippocampal neurons through bioconjugation between highly luminescent (quantum dot-neutravidin) and (biotinylated anti-TrkB antibody) on neurons by combined atomic force microscope and confocal laser scanning microscope [J]. Bioconjugate Chemistry, 2010, 21(4): 597-603
[37] Geng L, Zhang H L, Peng H B. The formation of acetylcholine receptor clusters visualized with quantum dots [J]. BMC Neuroscience, 2009, 10: 80
[38] Osakada Y, Cui B. Real-time visualization of axonal transport in neurons [J]. Methods in Molecular Biology, 2011, 670: 231-243
[39] Xie W, Zhang K, Cui B. Functional characterization and axonal transport of quantum dot labeled BDNF [J]. Integrative Biology, 2012, 4(8): 953-960
[40] Chang J C, Kovtun O, Blakely R D, et al. Labeling of neuronal receptors and transporters with quantum dots [J]. Wiley Interdisciplinary Reviews: Nanomedicine and Nanobiotechnology, 2012, 4(6): 605-619
[41] Silva G A. Chapter 2-Quantum dot nanotechnologies for neuroimaging [J]. Progress in Brain Research, 2009, 180: 19-34
[42] Kantelhardt S R, Caarls W, de Vries A H, et al. Specific visualization of glioma cells in living low-grade tumor tissue [J]. PLoS One, 2010, 5(6): e11323
[43] Zhang Q. Imaging single synaptic vesicles in mammalian central synapses with quantum dots [J]. Methods in Molecular Biology, 2013, 1026: 57-69
[44] Zhang Q, Cao Y Q, Tsien R W. Quantum dots provide an optical signal specific to full collapse fusion of synaptic vesicles [J]. Proceeding of the National Academy of Sciences of the United States of America, 2007, 104(45): 17843-17848
[45] Gessler T. Inhalative pharmacotherapy in the future-nanocarriers for pulmonary drug delivery [J]. Pneumologie, 2009, 63: Suppl 2S113-116
[46] Kato S, Itoh K, Yaoi T, et al. Organ distribution of quantum dots after intraperitoneal administration, with special reference to area-specific distribution in the brain [J]. Nanotechnology, 2010, 21(33): 335103
[47] Walters R, Kraig R P, Medintz I, et al. Nanoparticle targeting to neurons in a rat hippocampal slice culture model [J]. ASN Neuro, 2012, 4(6): 383-392
[48] Xu G, Mahajan S, Roy I, et al. Theranostic quantum dots for crossing blood-brain barrier and providing therapy of HIV-associated encephalopathy [J]. Frontiers in Pharmacology, 2013, 4: 140
[49] Bardi G, Malvindi M A, Gherardini L, et al. The biocompatibility of amino functionalized CdSe/ZnS quantum-dot-Doped SiO2nanoparticles with primary neural cells and their gene carrying performance [J]. Biomaterials, 2010, 31(25): 6555-6566
[50] Chen Z, Chen H, Meng H, et al. Bio-distribution and metabolic paths of silica coated CdSeS quantum dots [J]. Toxicology and Applied Pharmacology, 2008, 230(3): 364-371
[51] Hunter D D, Dey R D. Identification and neuropeptide content of trigeminal neurons innervating the rat nasal epithelium [J]. Neuroscience, 1998, 83(2): 591-599
[52] Wu T, Tang M. Toxicity of quantum dots on respiratory system [J]. Inhalation Toxicology, 2014, 26(2): 128-139
[53] Bakalova R, Zhelev Z, Kokuryo D, et al. Chemical nature and structure of organic coating of quantum dots is crucial for their application in imaging diagnostics [J]. International Journal of Nanomedicine, 2011, 6: 1719-1732
[54] Gao X, Chen J, Chen J, et al. Quantum dots bearing lectin-functionalized nanoparticles as a platform for in vivo brain imaging [J]. Bioconjugate Chemistry, 2008, 19(11): 2189-2195
[55] Liu X, Tang M, Zhang T, et al. Determination of a threshold dose to reduce or eliminate CdTe-induced toxicity in L929 cells by controlling the exposure dose [J]. PloS one, 2013, 8(4): e59359
◆
Applications and Perspectives of Quantum Dots in Neurotoxicology
Wu Tianshu, Tang Meng*
Key Laboratory of Environmental Medicine Engineering, Jiangsu Key Laboratory for Biomaterials and Devices, School of Public Health, Southeast University, Nanjing 210009, China
Received 17 May 2014 accepted 20 June 2014
With the rapid development of nanotechnology, quantum dots (QDs), as a new type of nano-fluorescence probes, have been widely used in biology and toxicology due to their unique photoelectric properties. Moreover, QDs have introduced a technological innovation in the field of neurotoxicology, which as an important branch of toxicology. The primary focus of this review is the application of QDs in neurotoxicological studies as a novel single molecular technology and an excellent fluorescent probe. The routes of QDs entering into the nervous system and potential factors that could impact QDs’ applications were also briefly introduced here in order to guide further related researches on the biosafety and better applications of QDs.
nanotechnology; quantum dots; neurotoxicology; fluorescence probe; drug delivery
国家自然科学基金(30972504,81172697,81302461);国家重大科学研究计划项目(2011CB933404);江苏省基础研究计划 (No. BK2011606)
吴添舒(1989-),女,博士研究生,研究方向为纳米毒理学,E-mail: ninatshwu@gmail.com;
*通讯作者(Corresponding author), E-mail: tm@seu.edu.cn
10.7524/AJE.1673-5897-20140517001
2014-05-17 录用日期:2014-06-20
1673-5897(2015)3-001-10
X171.5
A
唐萌(1958-),男,博士,教授,博士生导师,主要研究方向为纳米毒理学。
吴添舒,唐萌. 荧光量子点在神经毒理学研究中的应用及前景[J]. 生态毒理学报,2015, 10(3): 1-10
Wu T S, Tang M. Applications and perspectives of quantum dots in neurotoxicology [J]. Asian Journal of Ecotoxicology, 2015, 10(3): 1-10 (in Chinese)

