冷处理下3种桉树过氧化物酶基因的转录变化1)
黄真池 彭信海 欧阳乐军
(岭南师范学院,湛江,524048) (湖南省森林植物园) (岭南师范学院)
责任编辑:潘 华。
桉树原产澳大利亚,是桃金娘科(Myrtaceae)杯果木属(Angophora)、伞房属(Corymbia)和桉属(Eucalyptus)植物的统称,有1 039 个种、亚种和变种[1]。桉树具有生长速度快、轮伐期短、耐干旱、耐瘦瘠等诸多优点,是世界公认的三大人工林树种之一[2]。据统计,全世界桉树人工林面积超过2 000 万hm2[3]。由于桉树纸浆得率高,品质好,经济效益显著,其栽种范围在不断北移[4]。随着栽种地的不断北移,桉树生产面临低温逆境的巨大威胁,极端低温冻害甚至会导致其大面积死亡[5]。
低温条件下,植物的生物膜结构、可溶性糖含量、激素含量、蛋白质组成、基因表达等都会发生改变[6],并且低温可引起ROS(reactive oxygen species)积累,使蛋白质、DNA 和脂质受损,导致细胞损伤[7]。植物细胞中ROS 的代谢平衡影响到分裂、分化、发育、抗逆等细胞代谢的多个过程[8]。过氧化物酶类(E.C.1.11.1.x)催化以过氧化物为电子受体的氧化还原反应。目前把过氧化物酶划分为从EC1.11.1.1 到EC1.11.1.16(其中EC1.11.1.4 类被划出)的15 小类[9]。
过氧化物酶类中,NADPH 氧化酶由rboh(respiratory burst oxidase homologue)基因编码,定位在细胞质膜上[10],通过将电子传递给O2生成超氧阴离子,后者很快生成过氧化氢、羟自由基等活性氧分子,是产生ROS 的主要位点[11]。在受到外来信号的刺激时,该酶能通过自身的激活或失活迅速引起ROS 的升高或降低,进而在植物生长发育及应答生物或非生物胁迫中发挥重要作用[12]。低温可以诱导葡萄NADPH 氧化酶活性升高,引起H2O2含量升高。H2O2作为信号分子可激活水稻应答低温胁迫早期的转录调节网络,提高水稻增强对低温胁迫抗性[13]。
抗坏血酸过氧化物酶(ascorbate peroxidase APX),谷胱甘肽过氧化物酶(glutathione peroxidase GPX),过氧化物酶(Class III plant Peroxidases POX)等在清除ROS,维持植物细胞ROS 的平衡过程中发挥着重要作用[14-15]。APX 以抗坏血酸为电子供体,将H2O2分解成H2O 和O2。APX 的同工酶在细胞中有明显的定位,分布在叶绿体、线粒体、过氧化物体和胞质溶胶等亚细胞组分中。植物细胞发育过程、生物或非生物逆境等调节APX 的表达[16]。低温贮藏的马铃薯块茎胞质中的APX mRNA 含量较常温贮藏下明显增多[17]。过表达APX 和CuZnSOD的地瓜对低温逆境的耐受力明显增强[18]。Sato et al.[19]报道,颖花发育初期过表达APX1 基因的水稻,低温胁迫下可维持其高水平的APX 活性,并提高水稻在孕穗的耐寒性。曾秀存等[20]报道,白菜型冬油菜的APX 活性越高植株的抗寒性越强。
GPX 是植物细胞中清除ROS 的关键酶类,以谷胱甘肽为电子供体,将H2O2、有机氢过氧化物或脂质过氧化物等分解成H2O 和O2[21],保护细胞膜免受氧化损伤[22]。GPX 定位于胞质、叶绿体、线粒体和内质网,多种非生物逆境都可显著增强拟南芥各种组织中AtGPX6 表达[23]。LePHGPX 的瞬时表达可保护烟草免遭盐胁迫和高温的伤害,同时稳定表达的LePHGPX 可增强烟草对灰霉菌的抗性[24]。在冷胁迫或外源H2O2作用下,水稻GPX 的表达上调。水稻线粒体OsGPX3 的沉默会导致水稻线粒体中H2O2大量积累、并抑制根的伸长生长[25]。与耐寒性较差的品系相比,冷胁迫下耐寒性较强水稻的悬浮细胞的GPX 活性明显增强[26]。
POX 有2 种完全相反的功能。在peroxidative cycle 中POX 利用酚类、木质素前体、生长素或次生代谢物质提供的电子将H2O2分解成H2O 和O2[27];而在hydroxylic cycle 中,POX 能催化以超氧阴离子为主的多种ROS 的形成[28]。POX 功能复杂,在植物生长发育各时期的多个代谢途径中发挥作用,如细胞壁代谢、伤口愈合、生长素代谢[29]、花青素的积累等[30]。转录组学分析发现,冷胁迫下,马铃薯POX 的表达上调[31]。辣椒CaPO2 基因在寒冷、干旱、高盐等逆境诱导下表达升高,增强了辣椒对逆境和炭疽病的抗性[32]。麻风树幼苗在短期的抗寒锻炼过程中POX 活性显著升高,增强了对冷胁迫的耐受力[33]。
目前,研究植物耐寒性与过氧化物酶关系常用水稻、拟南芥等草本植物为材料[16-32],以木本植物作材料的报道很少[33-35],以桉树为材料的此类研究鲜有报道。Fawal 等[36]建立的The PeroxiBase(http://peroxibase.toulouse.inra.fr/)为研究过氧化物酶的功能和代谢奠定了基础。本研究参考The PeroxiBase 数据库中4 类巨桉过氧化物酶基因的序列,分析了3 种耐寒性不同桉树5 ℃冷处理24 h 后,rboh、APX、GPX、POX 4 类共16 种过氧化物酶基因的转录变化。本研究可为桉树ROS 代谢和耐寒机理的研究及耐寒桉树育种提供参考。
1 材料与方法
韦邓桉(E.wetarensis ×E.dunnii)、邓恩桉(E.dunnii)和湘邓桉(E.dunnii xiangdeng)的半年苗龄树苗,由湖南省森林植物园提供。耐寒性由弱到强顺序:韦邓桉、邓恩桉、湘邓桉。
取大小一致、长势良好的3 种桉树树苗置于16 h 光/8 h 暗光周期,光照强度为365 lx 的人工气候箱中,(5 ±1)℃冷处理24 h。对照组温度为(26 ±2)℃,其他条件与处理组相同。
用打孔器取约50 mg 新鲜叶片于液氮中研磨成粉。先用1 mL RNAiso-mate for Plant Tissue 处理,再按RNAiso Plus 试剂的操作手册步骤提取总RNA,溶于30 μL RNAase-free H2O。用Nanodrop 2000c 和1.2%琼脂糖电泳检测总RNA 质量和浓度。在10 μL 反应体系中分别加入5 ×gDNA Eraser Buffer 2 μL,gDNA Eraser 1 μL 和总RNA 1 μg,用RNAase-free H2O 补齐至10 μL 后瞬时离心混匀,30 ℃反应5 min 以去除总RNA 中残存的基因组DNA。再在上述反应体系中依次加入5 × Prime-Script Buffer 4 μL,PrimeScript RT Enzyme Mix Ⅰ1 μL,RT Prime Mix 1 μL 和RNAase-free H2O 4 μL,瞬时离心混匀,37 ℃反应15 min,85 ℃5 s 使酶失活,所得产物为初始cDNA。用EASY Dilution(for Real Time PCR)将初始cDNA 稀释1 倍用于后续qPCR(real-time quantitative PCR qPCR)的模板。上述所用试剂均为宝生物工程(大连)有限公司产品。
目的基因选择及引物设计:根据The PeroxiBase(http://peroxibase.toulouse.inra.fr/)数据库中4 类巨桉过氧化物酶基因的序列,用primer3plus 软件设计qPCR 引物。经qPCR 预试验从4 类过氧化物酶基因(rboh、APX、GPX、POX)中筛选出16 个(每类4个)扩增效率高、特异性好的基因作目的基因。按黄真池等[37]选择RTEF 基因作内参基因。目的基因编号和引物序列及内参基因引物序列见表1。
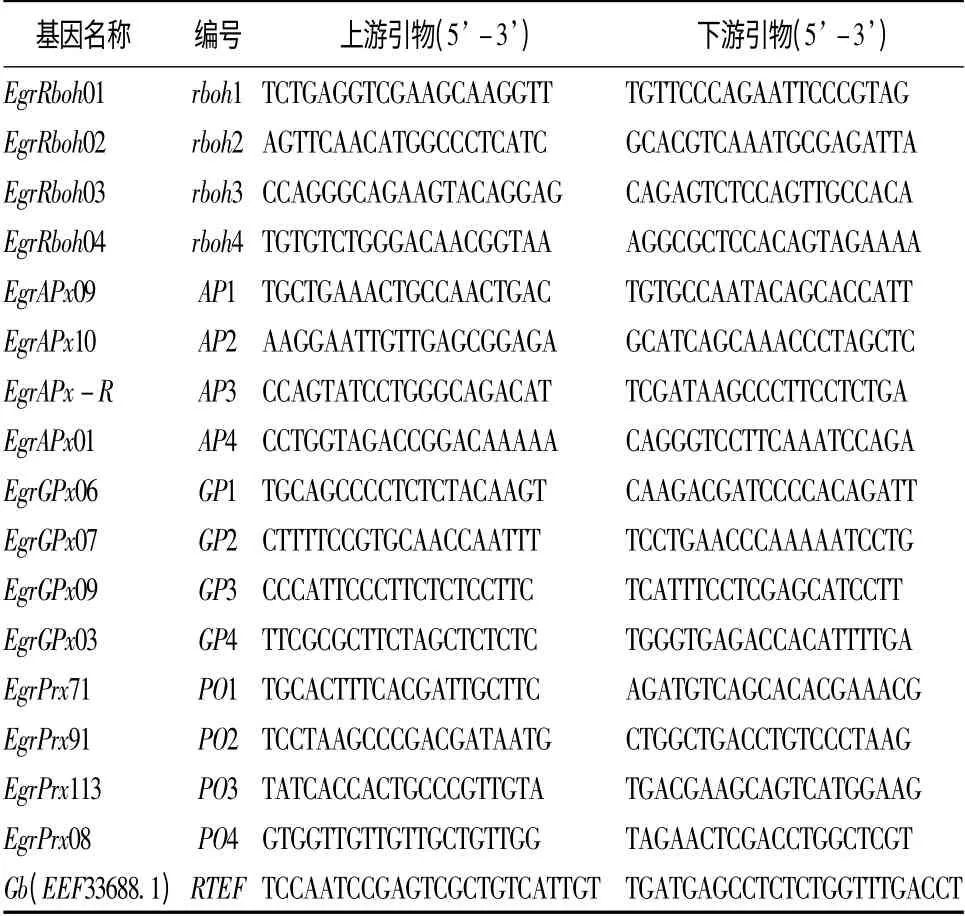
表1 4 类16 种过氧化物酶基因的编号和引物序列及内参基因的引物序列
qPCR 扩增:qPCR 反应仪器为Chromo 4TM System(Bio- Rad)。qPCR 反应体系25 μL,分别是SYBR Premix Ex TaqTMⅡ(Tli RNaseH Plus)(2 ×Conc)12.5 μL,10 μmol/L Primer F 和Primer R 各1 μL,ddH2O 8.5 μL,稀释后的cDNA 模板2 μL。扩增程序:94 ℃9 s,58 ℃9 s,72 ℃15 s,延伸后荧光读数,共40 个循环。从70~95 ℃,每升高1 ℃荧光读数1 次,根据融链温度检测反应的特异性。每个反应3 次重复。用Opticon Monitor 3.1 软件分析各基因的扩增效率、Ct值。设常温下基因的表达量为1,采用相对定量的Pfaffl 法,计算各基因冷处理后的相对表达值。
2 结果与分析
2.1 冷处理后不同耐寒桉树rboh 基因的转录变化
冷处理后,3 种桉树4 个rboh 基因的转录均发生了明显的改变(表2),各树种间的转录变化有显著差异(P <0.05)。冷处理后,除耐寒性最差的韦邓桉的rboh1 和rboh3 基因的转录显著增强外(相对表达量分别是常温下的2.143 9 倍和1.418 2 倍),3 个树种rboh 基因的表达均被抑制(相对表达量<1)。其中,rboh1 和rboh3 基因的相对表达量与3 种桉树的耐寒性强弱呈显著的负相关,rboh2 和rboh4 基因的相对表达量与3 种桉树的耐寒性强弱呈正相关。
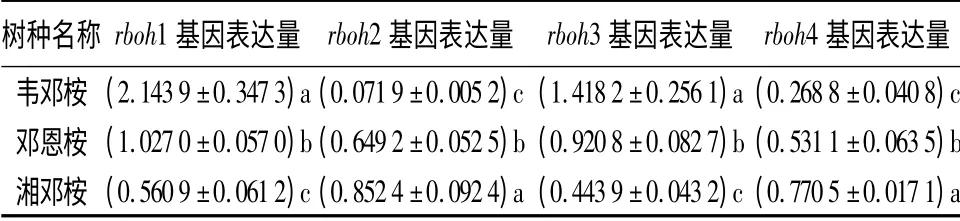
表2 冷处理后3 种桉树叶组织4 个rboh 基因的表达变化
rboh 基因编码产生超氧阴离子的NADPH 氧化酶。冷处理后,耐寒性最差的韦邓桉的rboh1 和rboh3 基因的转录显著增强,可能会使细胞中ROS的含量急剧上升,导致ROS 对细胞膜结构、蛋白质、核酸和脂质等的损伤,加速冷害的发生。低温下,耐寒性较强的邓恩桉和湘邓桉的rboh 基因的表达均被抑制,阻止了ROS 的产生,缓解了ROS 伤害,对这两个树种抵抗冷胁迫有利。
2.2 冷处理后不同耐寒桉树APX 基因的转录变化
冷处理后,3 种桉树间的APX 基因转录变化存在显著差异(P <0.05)(表3)。耐寒性最强的湘邓桉的AP1 基因被冷诱导表达的效果最为明显(相对表达量是常温下的3.21 倍)。AP1、AP2、AP4 这3个基因冷胁迫下的相对表达量与树种的抗寒性呈正相关关系。冷处理后,韦邓桉、邓恩桉和湘邓桉AP3基因的相对表达量分别是1.510 9、1.007 3、0.696 7。说明低温诱导了韦邓桉AP3 基因的表达,对邓恩桉和湘邓桉AP3 基因的表达则不影响或起抑制作用。APX 在清除ROS,维持ROS 代谢平衡状态过程中起关键作用。冷胁迫下,耐寒性较强的邓恩桉和湘邓桉APX 的表达升高,增强了细胞清除ROS 的效率,减轻了冷胁迫对植物组织的伤害。

表3 冷处理后3 种桉树叶组织4 个APX 基因的表达变化
2.3 冷处理后不同耐寒桉树GPX 基因的转录变化
除GP2 外,冷处理引起3 种桉树的GPX 基因表达上调(表4)。其中上调幅度最大的是耐寒性最强的湘邓桉的GP4 基因(相对表达量是常温下的3.969 9 倍)。除GP1 外,冷胁迫下GP2、GP3、GP4的表达量均是湘邓桉的最高,且与韦邓桉和邓恩桉间呈显著性差异(P <0.05)。冷胁迫下,韦邓桉GP1 基因的相对表达量为3.121 7,与邓恩桉和湘邓桉间呈显著差异。GPX 是植物细胞中清除ROS 的关键酶类,定位于胞质、叶绿体、线粒体和内质网等部位。冷胁迫下,耐寒性最强的湘邓桉GPX 的总体表达水平最高,增强了逆境下细胞清除ROS 的能力,减缓了冷胁迫伤害。但就GP1 基因而言,耐寒性最弱的韦邓桉的相对表达量却为最高。这可能是GPX 在细胞中的定位不同,对冷胁迫的应答机制不同。

表4 冷处理后3 种桉树叶组织4 个GPX 基因的表达变化
2.4 冷处理后不同耐寒桉树POX 基因的转录变化
冷胁迫下、3 种桉树POX 同工酶的相对表达量变化差异显著,耐寒性较强的邓恩桉和湘邓桉POX的上调幅度小于耐寒性较弱的韦邓桉(表5)。除了韦邓桉的PO1 基因及邓恩桉和湘邓桉的PO2 基因,冷处理引起3 种桉树的POX 基因的表达上调。其中韦邓桉的PO2、PO3 和PO4 的上调幅度最为显著,分别为常温下的3.567 5、4.564 0、4.936 0 倍。低温处理后,耐寒性较强的邓恩桉和湘邓桉的PO2 基因表达受抑制(相对表达量分别为0.792 3 和0.528 3)。冷胁迫下,韦邓桉的PO1 基因表达受抑制(相对表达量为0.509 5),而邓恩桉和湘邓桉的PO1 基因增强,分别达到常温下的1.535 6 倍和2.633 8倍。植物POX 由超大基因家族编码,种类多样,功能复杂[32,38]。表5结果表明,冷逆境下桉树POX 的表达模式具多样性和复杂性。
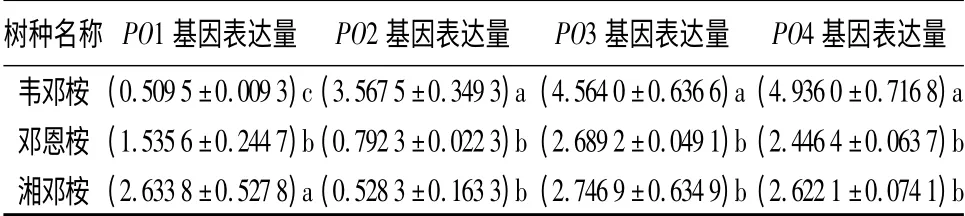
表5 冷处理后3 种桉树叶组织4 个POX 基因的表达变化
3 结论与讨论
随着栽种范围不断北移,桉树生产面临低温逆境的巨大威胁[4]。对桉树耐寒机理的研究多集中在分析电导率、可溶性糖、可溶性蛋白、游离脯氨酸、丙二醛、细胞膜脂肪酸、保护酶活性、光合性能等生理指标的变化[39-40]。Keller 等[41-42]分析了冷胁迫下冈尼桉的表达谱,并推测表达谱的改变增强了冈尼桉的解毒能力和对冻害的抵抗力。关于冷胁迫下桉树过氧化物酶的表达变化的研究尚未见报道。
本研究分析了3 种不同耐寒性桉树5 ℃冷处理24 h 后,rboh、APX、GPX、POX 4 类共16 种过氧化物酶基因的转录变化。冷胁迫下,韦邓桉rboh1、rboh3、AP3、GP1、PO2、PO3 和PO4 等基因的相对表达量明显增高,总体表现为产生ROS 的rboh 表达增强,清除ROS 的APX 和GPX 总体表现为表达受抑制。冷胁迫下,韦邓桉POX 表达量增幅最大,但POX 的功能具有两面性,既能在peroxidative cycle中将H2O2分解,又能在hydroxylic cycle 中催化多种ROS 的形成。冷胁迫下,湘邓桉4 个rboh 基因的表达均被抑制,AP1、AP2、AP4 的表达增强,GP2、GP3、GP4 的表达增强,PO2 表达受抑制、PO1、PO2 和PO4 的相对表达倍数虽然增高,但不如韦邓桉升高幅度大。总体表现为产生ROS 的rboh 类基因的表达受抑制,分解ROS 的APX 类和GPX 类基因的表达则显著升高。显而易见,耐寒桉树产生ROS 的rboh 类基因的表达受抑制,分解ROS 的APX 类和GPX 类基因的表达显著升高,基因的转录调节降低了低温下细胞中的ROS 水平,减轻了ROS 伤害,增强了耐寒性。
有趣的是,冷胁迫下3 种桉树4 类过氧化物酶的转录变化趋势均不完全一致,说明过氧化物酶类基因的转录调节方式的多样性和复杂性。这种现象的发生可能与过氧化物酶同工酶在细胞中的定位和功能不同有关。将此类酶的同工酶在细胞中精确定位将推动其功能与作用机理的研究。本研究探讨了不同耐寒性桉树冷胁迫下rboh、APX、GPX、POX 4 类共16 种过氧化物酶基因的转录变化,发现AP1、GP3、GP4 等基因的诱导表达能增强桉树的抗寒性,rboh1、rboh3、PO1 等基因的表达上调加剧冷胁迫下的ROS 伤害。本研究可为桉树ROS 代谢和耐寒机理的研究及耐寒桉树育种提供参考。
[1] 欧阳乐军,沙月娥,黄真池,等.广州一号桉树高效组培再生体系的建立[J].东北林业大学学报,2012,40(7):14-17.
[2] Grattapaglia D,Vaillancourt R E,Shepherd M,et al.Progress in myrtaceae genetics and genomics:Eucalyptus as the pivotal genus[J].Tree Genet Genomes,2012,8(7):463-508.
[3] 谢耀坚.中国桉树育种研究进展及宏观策略[J].世界林业研究,2011,24(4):50-54.
[4] e Silva F C,Shvaleva A,Broetto F,et al.Acclimation to shortterm low temperatures in two Eucalyptus globulus clones with contrasting drought resistance[J].Tree Physiology,2009,29(1):77-86.
[5] 徐建民,李光友,陆钊华,等.南方桉树人工林雨雪冰冻灾害调查分析[J].林业科学,2008,44(7):103-110.
[6] Zhu J,Dong C H,Zhu J K.Interplay between cold-responsive gene regulation,metabolism and RNA processing during plant cold acclimation[J].Current Opinion Plant Biology,2007,10(3):290-295.
[7] Apel K,Hirt H.Reactive oxygen species:metabolism,oxidative stress and signal transduction[J].Annual Review of Plant Physiology and Plant Molecular Biology,2004,55(1):373-399.
[8] Tsukagoshi H,Busch W,Benfey P N.Transcriptional regulation of ROS controls transition from proliferation to differentiation in the root[J].Cell,2010,143(4):606-616.
[9] Passardi F,Theiler G,Zamocky M,et al.PeroxiBase:the peroxidase database[J].Phytochemistry,2007,68(12):1605-1611.
[10] Kobayashi M,Kawakita K,Maeshima M,et al.Subcellular localization of strboh proteins and NADPH-dependent-generating activity in potato tuber tissues[J].Journal of Experimental Botany,2006,57(6):1373-1379.
[11] Torres M A,Dangl J L.Functions of the respiratory burst oxidase inbiotic interactions,abiotic stress and development[J].Current Opinionin Plant Biology,2005,8(4):397-403.
[12] 丁坤峰,谭晓荣.植物NADPH 氧化酶研究进展[J].生命科学,2010,22(8):723-728.
[13] Yun K Y,Park M R,Mohanty B,et al.Transcriptional regulatory network triggered by oxidative signals configures the early response mechanisms of japonica rice to chilling stress[J].Bioinformatics Plant Biology,2010,10(1):16-20.
[14] Roxas V P,Lodhi S A,Garrett D K,et al.Stress tolerance in transgenic tobacco seedlings that overexpress glutathione S-transferase/glutathione peroxidase[J].Plant Cell Physiology,2000,41(11):1229-1234.
[15] Zhai C Z,Zhao L,Yin L J,et al.Two wheat glutathione peroxidase genes whose products are located in chloroplasts improve salt and H2O2tolerances in Arabidopsis[J].Plos One,2013,8(10):739-744.
[16] Caverzan A,Passaia G,Rosa S B,et al.Plant responses to stresses:role of ascorbate peroxidase in the antioxidant protection[J].Genetics and Molecular Biology,2012,35(4):1011-1019.
[17] Kawakami S,Matsumoto Y,Matsunaga A,et al.Molecular cloning of ascorbate peroxidase in potato tubers and its response during storage at low temperature[J].Plant Science,2002,163(2):829-836.
[18] Lim S,Kim Y H,Kim S H,et al.Enhanced tolerance of transgenic sweet potato plants that express both CuZnSOD and APX in chloroplasts to methyl viologen-mediated oxidative stress and chilling[J].Mol Breed,2007,19(3):227-239.
[19] Sato Y,Masuta Y,Saito K,et al.Enhanced chilling tolerance at the booting stage in rice by transgenic overexpression of the ascorbate peroxidase gene,OsAPXa[J].Plant Cell Reports,2011,30(3):399-406.
[20] 曾秀存,孙万仓,方彦,等.白菜型冬油菜抗坏血酸过氧化物酶(APX)基因的克隆,表达及其活性分析[J].作物学报,2013,39(8):1400-1408.
[21] Herbette S,Roeckel Drevet P,Drevet J R.Seleno-independent glutathione peroxidases[J].Febs Journal,2007,274(9):2163-2180.
[22] Koh C S,Didierjean C,Navrot N,et al.Crystal structures of a poplar thioredoxin peroxidase that exhibits the structure of glutathione peroxidases:insights into redox-driven conformational changes[J].Journal of Molecular Biology,2007,370(3):512-529.
[23] Milla M A R,Maurer A,Huete A R,et al.Glutathione peroxidase genes in Arabidopsis are ubiquitous and regulated by abiotic stresses through diverse signaling pathways[J].The Plant Journal,2003,36(5):602-615.
[24] Chen S,Vaghchhipawala Z,Li W,et al.Tomato phospholipid hydroperoxide glutathione peroxidase inhibits cell death induced by Bax and oxidative stresses in yeast and plants[J].Plant Physiology,2004,135(3):1630-1641.
[25] Passaia G,Fonini L S,Caverzan A,et al.The mitochondrial glutathione peroxidase GPX3 is essential for H2O2homeostasis and root and shoot development in rice[J].Plant Science,2013,208:93-101.
[26] Wang X,Fang G,Li Y,et al.Differential antioxidant responses to cold stress in cell suspension cultures of two subspecies of rice[J].Plant Cell,Tissue and Organ Culture,2013,113(2):353-361.
[27] Passardi F,Penel C,Dunand C.Performing the paradoxical:how plant peroxidases modify the cell wall[J].Trends in Plant Science,2004,9(11):534-540.
[28] Passardi F,Longet D,Penel C,et al.The class III peroxidase multigenic family in rice and its evolution in land plants[J].Phytochemistry,2004,65(13):1879-1893.
[29] Cosio C,Dunand C.Specific functions of individual class III peroxidase genes[J].Journal of Experimental Botany,2009,60(2):391-408.
[30] 穆春,王丽,贾晓琳,等.RNAi 抑制过氧化物酶基因Rsprx1 表达促进萝卜花青素的积累[J].中国生物化学与分子生物学报,2013,29(9):867-872.
[31] Evers D,Legay S,Lamoureux D,et al.Towards a synthetic view of potato cold and salt stress response by transcriptomic and proteomic analyses[J].Plant Molecular Biology,2012,78(4/5):503-514.
[32] Choi H W,Hwang B K.The pepper extracellular peroxidase Ca-PO2is required for salt,drought and oxidative stress tolerance as well as resistance to fungal pathogens[J].Planta,2012,235(6):1369-1382.
[33] Ao P X,Li Z G,Fan D M,et al.Involvement of antioxidant defense system in chill hardening-induced chilling tolerance in Jatropha curcas seedlings[J].Acta Physiologiae Plantarum,2013,35(1):153-160.
[34] 陈雨春,黄一青,彭柳青.低温处理对耐寒粗枝木麻黄无性系生理指标的影响[J].林业科学研究,2011,24(4):523-526.
[35] 张卫华,张方秋,徐大平,等.三种相思树种的耐寒性评估[J].林业科学研究,2008,21(6):842-846.
[36] Fawal N,Li Q,Savelli B,et al.PeroxiBase:a database for large-scale evolutionary analysis of peroxidases[J].Nucleic Acids Research,2013,41(1):441-444.
[37] 黄真池,欧阳乐军,张龙,等.桉属植物内参基因的筛选与评估[J].西北农林科技大学学报,2013,41(10):67-72.
[38] 黄真池,彭舒,欧阳乐军,等.Cu2+,Cd2+,Hg2+对玉米幼苗生长和抗氧化酶活性的影响[J].西北农林科技大学学报,2012,40(1):37-42.
[39] 列淦文,薛立.桉树抗寒生理研究进展[J].广东农业科学,2012,39(5):56-58.
[40] 刘建,项东云,周坚.桉树抗寒生理及分子机理研究进展[J].西南林学院学报,2006,26(5):81-85.
[41] Keller G,Marchal T,SanClemente H,et al.Development and functional annotation of an 11,303-EST collection from Eucalyptus for studies of cold tolerance[J].Tree Genetics & Genomes,2009,5(2):317-327.
[42] Keller G,Cao P B,San Clemente H,et al.Transcript profiling combined with functional annotation of 2,662 ESTs provides a molecular picture of Eucalyptus gunnii cold acclimation[J].Trees,2013,27(6):1713-1735.

