超声心动图评估稳定期慢性阻塞性肺疾病患者右心功能的价值
朱博鹰 ,李 青 ,左红卫
(1.天津中医药大学研究生院,天津 300193;2.天津中医药大学第二附属医院超声科,天津 300150)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种以持续气流受限为特征的可以预防和治疗的疾病,气流受限呈不完全可逆、进行性发展,与气道慢性炎症反应增强、肺接触有毒颗粒或气体相关[1];在全球疾病死亡率中排第4位,预计到2020年,位居世界疾病经济负担第5位[2]。其重要的心血管并发症为肺源性心脏病,因为进行性肺动脉高压导致的右心压力负荷过重,显著影响预后,早期发现右心功能改变能有效控制其进展。
超声心动图具有简便、价格低廉、无辐射等优势,已成为临床重要检查手段。本文运用美国超声心动图学会(American Society of Echocardiography,ASE)于2010年公布的《超声心动图评估成人右心功能指南》[3]研究稳定期COPD右心功能。
1 资料与方法
1.1 一般资料 收集2013年11月至2014年5月64例COPD患者,均符合2007年中华医学会呼吸病学分会制定的《慢性阻塞性肺疾病诊治指南》[4]中的诊断标准,病情属稳定期。其中肺功能Ⅱ级29例,中度,FEV1/FVC(第一秒用力呼气容积与用力肺活量之比)<70%,50%≤FEV1(第一秒用力呼气容积预计值)<80%预计值,男25例,女4例,年龄40~72岁;Ⅲ级 35例,重度,FEV1/FVC<70%,30%<FEV1<50%预计值,男30例,女5例,年龄44~75岁。另选择同期健康体检者33例作为对照组,男28例,女5例,年龄48~78岁,3组年龄差异无统计学意义。运用ASE推荐指标采集右心结构及功能参数。COPD组及对照组的剔除标准:排除先天性心脏病、瓣膜病、心肌病及其他可能导致右心室功能改变的因素。
1.2 仪器与方法 采用GE Vivid E9彩色多普勒超声诊断仪,探头为M5S,常规行二维及彩色多普勒检查。受检者均取左侧卧位,平静呼吸,同步连接心电图,切面包括左室长轴、短轴、四腔心和剑突下四腔心切面,以右室为图像中心。TDI调整至高帧频(143~268帧/s,平均 175帧/s)。 测量数据:①右室大小和壁厚度,包括右室流出道(RVOT)近端内径、RVOT远端内径、右室基底径、右室中径、右室长径、右室壁厚度、右室左室比值;②右室收缩功能,包括三尖瓣收缩期位移(TAPSE)、右室面积变化率(FAC)、心肌做功指数(tei index,Tei指数)、组织多普勒三尖瓣侧壁部瓣环收缩期峰值速率(S’);③右室舒张功能,包括下腔静脉塌陷率、三尖瓣收缩期峰值流速/舒张峰值流速(E/A)、E/e’、右房大小。以上数据由1人测量3次取平均值。
2 结果
ASE推荐的指标有19项,3组结果见表1~3。
表1 3组右室大小和壁厚度比较(±s)
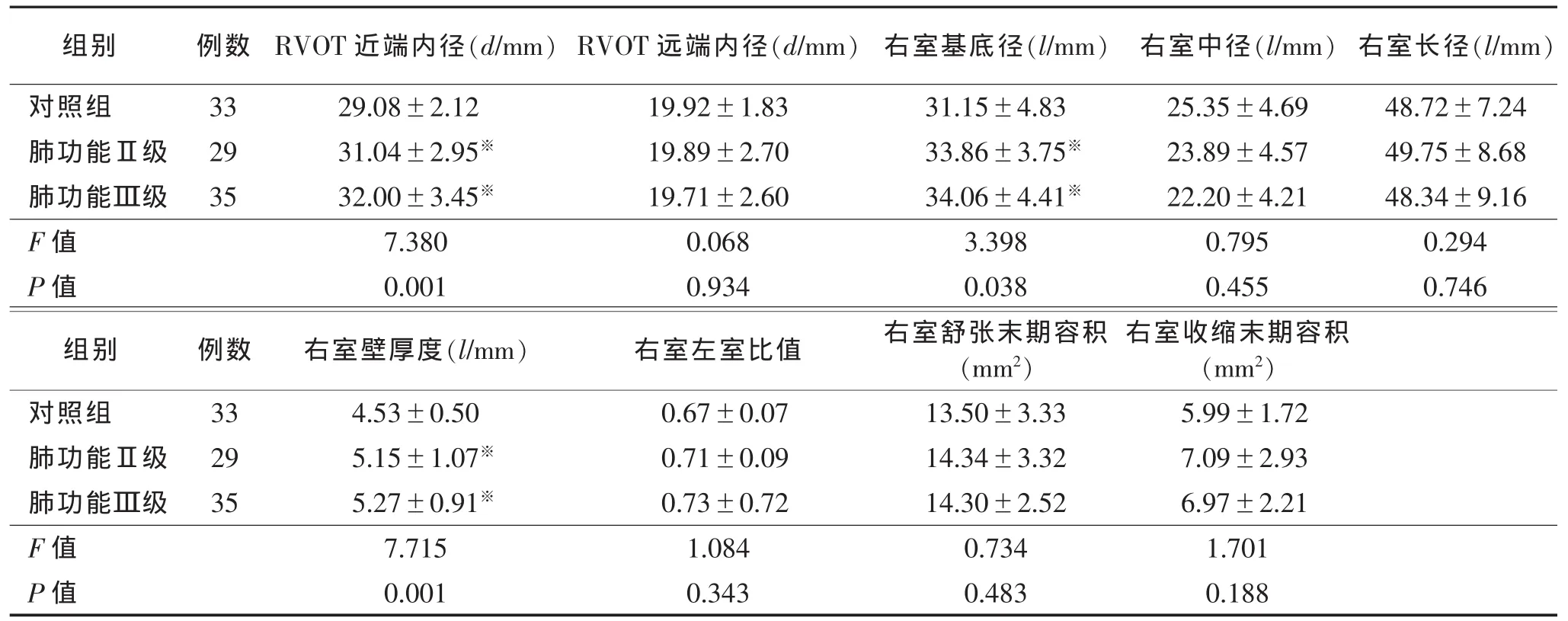
表1 3组右室大小和壁厚度比较(±s)
注:RVOT:右室流出道,与对照组相比,※P<0.05;与肺功能Ⅱ级相比,△P<0.05。
RVOT近端内径(d/mm) RVOT远端内径(d/mm) 右室基底径(l/mm) 右室中径(l/mm) 右室长径(l/mm)29.08±2.12 19.92±1.83 31.15±4.83 25.35±4.69 48.72±7.24 31.04±2.95※ 19.89±2.70 33.86±3.75※ 23.89±4.57 49.75±8.68 32.00±3.45※ 19.71±2.60 34.06±4.41※ 22.20±4.21 48.34±9.16 F值 7.380 0.068 3.398 0.795 0.294 P值 0.001 0.934 0.038 0.455 0.746右室壁厚度(l/mm) 右室左室比值 右室舒张末期容积(mm2)组别 例数对照组 33肺功能Ⅱ级 29肺功能Ⅲ级 35右室收缩末期容积(mm2)4.53±0.50 0.67±0.07 13.50±3.33 5.99±1.72 5.15±1.07※ 0.71±0.09 14.34±3.32 7.09±2.93 5.27±0.91※ 0.73±0.72 14.30±2.52 6.97±2.21 F值 7.715 1.084 0.734 1.701 P值 0.001 0.343 0.483 0.188组别 例数对照组 33肺功能Ⅱ级 29肺功能Ⅲ级 35
表2 3组右室收缩功能比较(±s)
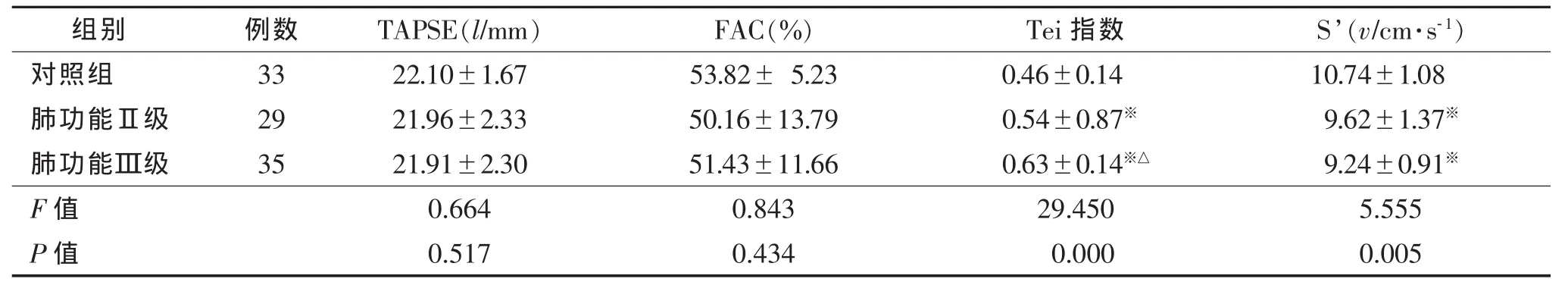
表2 3组右室收缩功能比较(±s)
注:TAPSE,三尖瓣收缩期位移;FAC,右室面积变化率;Tei指数,心肌做功指数(排除房颤2例和房室传导阻滞1例);S’,组织多普勒三尖瓣侧壁部瓣环收缩期峰值流速。与对照组相比,※P<0.05;与肺功能Ⅱ级相比,△P<0.05。
TAPSE(l/mm) FAC(%) Tei指数 S’(v/cm·s-1)22.10±1.67 53.82± 5.23 0.46±0.14 10.74±1.08 21.96±2.33 50.16±13.79 0.54±0.87※ 9.62±1.37※21.91±2.30 51.43±11.66 0.63±0.14※△ 9.24±0.91※F值 0.664 0.843 29.450 5.555 P值 0.517 0.434 0.000 0.005组别 例数对照组 33肺功能Ⅱ级 29肺功能Ⅲ级 35
稳定期COPD患者的RVOT近端内径、右室基底径、S’、右室壁厚度大于正常组(P<0.05),下腔静脉塌陷率低于对照组(P<0.05)。正常组、肺功能Ⅱ级、肺功能Ⅲ级Tei指数呈递增趋势(P<0.05)。
Tei指数、S’、RVOT 近端内径、右室基底径、E/A、FAC与肺功能的Pearson相关分析见表4,图1。
相关性测量可以看出Tei指数与肺功能呈负相关,而S’与肺功能呈正相关,提示肺功能恶化与Tei指数和S’密切相关。
表3 3组右室舒张功能比较(±s)
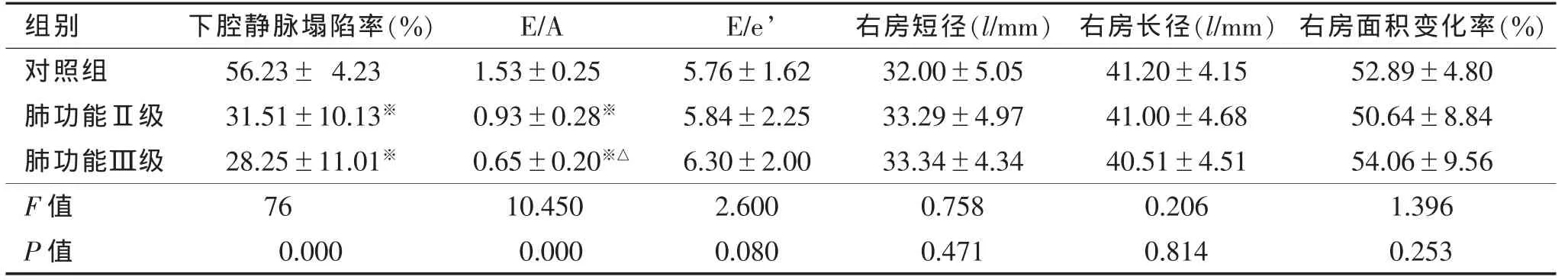
表3 3组右室舒张功能比较(±s)
注:与对照组相比,※P<0.05;与肺功能Ⅱ级相比,△P<0.05
组别 下腔静脉塌陷率(%) E/A E/e’ 右房短径(l/mm) 右房长径(l/mm) 右房面积变化率(%)对照组 56.23± 4.23 1.53±0.25 5.76±1.62 32.00±5.05 41.20±4.15 52.89±4.80肺功能Ⅱ级 31.51±10.13※ 0.93±0.28※ 5.84±2.25 33.29±4.97 41.00±4.68 50.64±8.84肺功能Ⅲ级 28.25±11.01※ 0.65±0.20※△ 6.30±2.00 33.34±4.34 40.51±4.51 54.06±9.56 F值 76 10.450 2.600 0.758 0.206 1.396 P值 0.000 0.000 0.080 0.471 0.814 0.253
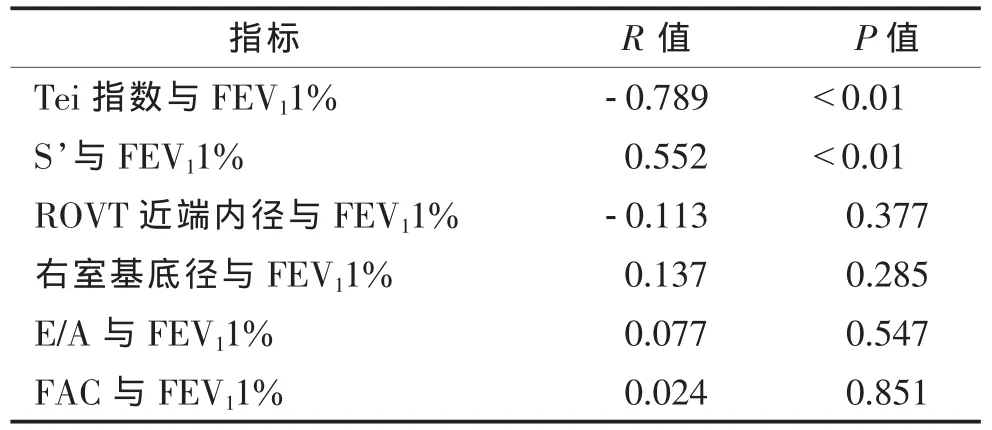
表4 测量指标间Pearson相关分析
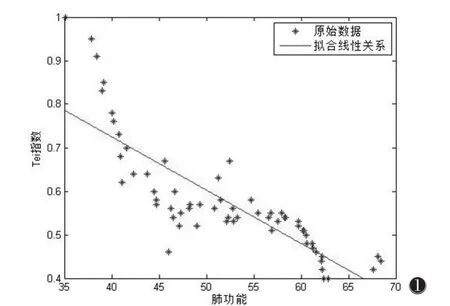
图1 肺功能与Tei指数的相关性分析
3 讨论
COPD由于长期的气道阻塞造成肺泡缺氧及二氧化碳潴留,促使肺血管收缩,从而引起肺动脉压升高,增加右心负荷,另外肺部反复感染导致的高炎症状态和内皮功能紊乱也会导致肺动脉压升高。肺动脉重塑可发生在COPD任何时期,包括轻度COPD患者,甚至是肺功能正常的吸烟人群中[5]。2010年欧洲呼吸学会指出即使是轻度的肺疾病也会引起右心功能变化;Cuttica等[6]的研究强调了右室功能在COPD患者锻炼耐受和预后中的重要性;另外Kawut等[7]的一项大样本研究指出,在无临床诊断心血管疾病患者中右心扩大可导致心功能衰竭甚至猝死,因此COPD稳定期患者,虽未造成明显的肺动脉高压,早期发现右心功能减低能一定程度上指导临床,改善患者预后。
在本研究中,COPD稳定期与对照组相比,在腔室大小方面,首先出现RVOT近端内径、右室基底径的增大,但在肺功能Ⅱ级和Ⅲ级患者中差异不明显,相关性试验中2个测值与肺功能亦没有明显相关。
COPD引起的进展性肺动脉高压可导致右室增大和肥厚,最终发展为右心功能不全[8-9],但Kawut等[10]利用MRI研究332例稳定期COPD患者腔室大小变化,发现与正常组相比,COPD患者右室容积减小。Jorgensen等[11]认为此现象与气道炎症导致的胸腔内血容量减少有关,另外胸腔和腹腔压力差减小,导致腔静脉回心的血流减少;Harhay等[12]认为与炎症因子、C反应蛋白和IL-6的增多有关;但目前还没有研究说明炎症因子如何相互作用导致右室容积减小。而本研究中右室舒张末期和右室收缩末期容积在各组间差异无统计学意义,原因可能与样本量较小、COPD病情较轻、二维超声心动图的局限性有关。右室呈半月形,心肌由表面的环形肌束和里面的纵形肌束构成,其形状高度依赖负荷,因此很难使切面达到标准化;指南中提出的切面是以右室为中心的切面,即使把右室打到最大,仍不能排除每个个体胸骨后的腔室解剖变异对图像的限制;右室小梁丰富,导致识别心内膜困难,也会对结果造成误差。因此,二维超声心动图不是评估稳定期COPD右心腔室大小的首选方法。
Tei指数可反映右室整体的收缩和舒张功能,是评价右心整体功能的一个可靠指标,因不依赖右室几何形状、重复性强且不受心率、后负荷和三尖瓣反流的影响而广泛应用于临床。本研究中Tei指数与肺功能呈负相关,3组中Tei指数差异有统计学意义。ASE提出S’<10 cm/s提示收缩功能不全,S’随着肺功能的降低而降低,在肺功能的相关性试验中与肺功能明显相关,说明S’是一个较敏感的指标,但在肺功能Ⅱ级和Ⅲ级患者表现不明显,原因可能是样本量较小。另外,国内外认可的衡量右室收缩功能指标还有TAPSE和FAC。TAPSE第一次用来评价右室收缩功能是在1984年由Kaul等[13]提出,此后不多学者研究其与右室收缩功能的关系,在心衰患者和肺动脉高压患者中,其与MRI测量的右室射血分数(RVEF)相关性很好,并且可作为预测COPD合并心衰患者的短期、长期生存率的指标[14-15]。本研究中各组TAPSE并无明显差异,Meluzin等[16]研究不合并肺动脉高压(PH)的COPD患者时TAPSE没有明显变化,大部分>20 mm。本研究右室面积变化率差异无统计学意义。稳定期COPD患者右心收缩功能虽然减低,但仍尚处于代偿阶段,评价右心收缩功能较敏感的指标是Tei指数和S’。
右室舒张功能不全会减少右室充盈量,增加右室舒张末期压力和右房压力,甚至导致液体潴留和消化道淤血。研究[17]显示,右室舒张功能异常与右室压力和后负荷有关,降低后负荷后,右室舒张功能可改善。本研究中3组间E/A差异明显,对照组舒张功能正常,随着肺功能减低,舒张功能也逐渐减低,但是E/A易受呼吸的影响,在患者呼气末屏住呼吸后测量更加准确。E/A结合右房大小则具有更好的敏感性,本研究中肺功能Ⅲ级患者E/A明显减低、E/e’均数>6,右房左右径和前后径有增大的趋势,右室舒张功能明显减低,因此多指标综合评估稳定期COPD患者右室舒张功能能够弥补单个指标的不足。
ASE推荐使用下腔静脉内径和吸气相塌陷率估测右房压力,但本研究发现塌陷率变异较大,本组患者病程较长,导致肺气干扰严重,因此笔者认为不适合作为唯一证据来评价,需结合其他证据。
综上所述,稳定期COPD患者因长期后负荷增大首先出现的腔室变化是ROVT近端内径、右室基底径的增大;随着肺功能的降低,舒张功能减低,右室收缩功能减低但尚处于代偿阶段;Tei指数是评价右室整体功能较敏感的指标;S’是评价右室收缩功能较敏感的指标;舒张功能的评价需结合E/A、E/e’和右房大小来综合评估。
本研究的局限性:缺乏MRI评估右心功能的金标准作为依据,缺乏肺功能Ⅳ级和肺动脉高压患者作为对照,另外收集的病例较少,且缺乏随访资料,有待进一步探讨。
[1] Global Strategy for Diagnosis,Management and Prevention of COPD (2014 update).http://www.goldcopd.com
[2] World Health Report.Geneva:World Health Organization.Available from URL:http://www.who.int/whr/2000/en/statistics.htm;2000
[3] Rudski LG,Lai WW,Afilalo J,et al.Guidelines for the echocardiographic assessment of the right heart in adults:a report from the American Society of Echocardiography endorsed by the European Association of Echocardiography,a registered branch of the European Society of Cardiology,and the Canadian Society of Echocardiography[J].J Am Soc Echocardiogr,2010,23:685-713.
[4]中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2007年修订版)[J].中华结核和呼吸杂志,2007,30(1):8-17.
[5] Hilde JM,Skjorten I,Grotta OJ,et al.Right ventricular dysfunction and remodeling in chronic obstructive pulmonary disease without pulmonary hypertension [J].J Am Coll Cardiol,2013,12:1103-1111.
[6] Cuttica MJ,Shah SJ,Rosenberg SR,et al.Right heart structural changes are independently associated with exercise capacity in non-severe COPD[J].Plos One,2011,6:e29069.
[7] Kawut SM,Barr RG,Lima JA,et al.Right ventricular structure is associated with the risk of heart failure and cardiovascular death:the Multi-Ethnic Study of Atherosclerosis (MESA)--right ventricle study[J].Circulation,2012,126:1681-1688.
[8] Kong D,Shu X,Pan C,et al.Evaluation of right ventricular regional volume and systolic function in patients with pulmonary arterial hypertension using three-dimensional echocardiography[J].Echocardiography,2012,29:706-712.
[9]王蕾,朱建忠.超声心动图评价慢性阻塞性肺疾病患者右心室功能的研究进展[J].中国中西医结合影像学杂志,2013,11(4):440-443.
[10] Kawut SM,Poor HD,Parikh MA,et al.Cor pulmonale parvus in chronic obstructive pulmonary disease and emphysema:the MESA COPD study[J].J Am Coll Cardiol,2014,64:2000-2009.
[11] Jorgensen K,Markus MF,Nel RN,et al.Reduced intrathoracic blood volume and left and right ventricular dimensions in patients with severe emphysema:an MRI study[J].Chest,2007,131:1050-1057.
[12] Harhay MO,Tracy RP,Bagiella E,et al.Relationship of CRP,IL-6,and brinogen with right ventricular structure and function:the MESA--Right Ventricle Study[J].Int J Cardiol,2013,168:3818-3824.
[13] Kaul S,Tei C,Hopkins JM,et al.Assessment of right ventricular function using two-dimensional echocardiography[J].Am Heart J,1984,107:526-531.
[14] Kjaergaard J,Akkan D,Iversen KK,et al.Right ventricular dysfunction as an independent predictor of short-and long-term mortality in patients with heart failure[J].Eur J Heart Fail,2007,9:610-616.
[15] Wahl A,Praz F,Schwerzmann M,et al.Assessment of right ventricular systolic function:comparison between cardiac magnetic resonance derived ejection fraction and pulsed-wave tissue Doppler imaging of the tricuspid annulus[J].Int J Cardiol,2011,151:58-62.
[16] Meluzin J,Spinarova L,Bakala J,et al.Pulsed Doppler tissue imaging of the velocity of tricuspid annular systolic motion;a new,rapid,and non-invasive method of evaluating right ventricular systolic function[J].Eur Heart J,2001,22:340-348.
[17] Gan CT,Holverda S,Marcus JT,et al.Right ventricular diastolic dysfunction and the acute effects of sildenafil in pulmonary hypertension patients[J].Chest,2007,132:11-17.

